- 本文轉載自作者twitter
在這篇文章中我會針對該科技新報文章所提及的內容進行闢謠科普,關於關於其引用的研究的闢謠科普詳見本文上篇:【闢謠科普兩不誤】「mRNA 疫苗爭議浮現,MIT:自然免疫系統失靈」這篇文到底有多少錯?上篇:破解有疑慮的引用文獻及判斷文獻可信度小技巧分享。
筆者目前研究領域跟工作狀態:免疫學博士候選人,預計於 2023 年 2 月正式取得博士學位,研究主題為愛滋疫苗與功能性抗體,具備在生物安全等級三級實驗室工作的資格與能力,最近在發表地獄中載浮載沉。
針對原始文章內錯誤的句子我會寫出是哪部分錯誤,並逐一科普,各段文字來自原始文章截圖;而跟那兩篇引用文獻有關的句子我用紅色底線標注,考量到文獻品質不佳在本篇中不多加討論(詳情請見本系列文上篇),在這篇中我也會分享一些跟疫苗副作用相關的發表,[]內的數字代表下方引用文獻reference列表對應到哪些學術發表,這篇文章很長,推薦抱持著輕鬆的心情慢慢看。

錯誤點:
- 疫苗研發量產需要時間,跟不上病毒突變速度是正常的;已有完成臨床試驗的疫苗的病毒如HBV其實也還持續在開發效果更好的疫苗,總有天選之人打了疫苗沒效,有些疫苗則是要根據施打者過往病史來做選擇。
- 疫苗的功效不只有防止感染,能降低感染後重症率、住院率、死亡率等也算是疫苗的功效。
- 現在流行的病毒株跟當初開發疫苗時的病毒株差異極大,整體效果下降非常正常,並不是因為疫苗讓免疫系統變爛,而是病毒變厲害。
- 號稱麻省理工的研究偏向文獻綜述,把一堆文獻抓在一起加上一些分析錯誤的數據,通篇沒有文獻或正確數據可以佐證其論點
- 該荷蘭研究數據量與分析方式有疑慮,不應用其下定論
疫苗為什麼會跟不上病毒變種速度?為什麼疫苗防止感染能力變差?
要回答這些問題答案必須分為兩個面向:
1.哪些因素會影響病毒出現新變種的速度:
- 病毒本身特性[1–3]
- 總感染人數與人口密度[4]
- 受感染者的免疫狀態[5–7]
- 病毒突變後增強的能力[8][9]
新冠病毒的突變速度不是全部病毒中最快的,但也不慢,再加上其能夠在物品表面上存活時間長又有無症狀之帶原者[1][10],使其能快速傳播讓總感染人數上升,在人口密度較高的國家/區域確診病例數上升更為顯著,感染人數越多病毒傳遞越遠,在這過程中出現新變種的可能性就會跟著上升[4]。
而病毒不會只感染特定族群,有些免疫力低下或是一些因為疾病免疫系統受到影響的人也會被感染,跟免疫力健全者相比這些人的免疫系統難以清除病毒[5–7],之前在南非就有一個案例是一位 HIV 感染的 22 歲女性持續被 beta 病毒株感染 9 個月,接受 HIV 治療約兩個月並從 covid 感染恢復後,其研究團隊發現該女子身上的病毒株已有超過 20 個新突變[6]。
隨著病毒不斷傳播、突變、傳播、突變,目前主流病毒株 Omicron 家族其實具有比過往病毒株更好的免疫逃避性,能夠躲過免疫系統與感染/疫苗誘導出的抗體的追殺[8][9],同時也因為其免疫原性低,儘管確診後也無法產生足量有效的抗體對抗反覆感染,而病毒的免疫逃避性變好也代表可以逃過疫苗誘導出的抗體,疫苗保護力隨之下降[8][9]][11][12]。
上述因素層層疊加,使我們三不五時就會聽到有新變種的消息,同樣這些因素也影響了疫苗開發與效果。
2.疫苗開發與臨床試驗流程
疫苗開發到進入臨床試驗跑完整個流程其實非常曠日費時,近幾年順利通過三期臨床實驗的伊波拉疫苗(有獲歐盟批准)從研發到走完臨床實驗到正式上市也已經過了 20 多年[13][14]。
臨床試驗相關細節與名詞解釋在科學月刊 2018 年 7 月的文章 — 臨床試驗「盲不盲」與台灣藥物臨床試驗資訊網中有詳細解釋[15][16],而臨床試驗相關資訊可以在 ClinicalTrials.gov 上查詢,那是一個國際級臨床實驗資訊的資料庫[17],但這邊需要特別解釋一個臨床實驗的特性:臨床實驗一定會有報告如期中報告等,絕對會提交給監督審核的機構,但其報告是否向大眾公開、最後是否整理發表至期刊上等則不一定!所以如果一般大眾查不到某臨床實驗的公開的報告跟發表是在合理範圍內,其臨床試驗過程中的數據並沒有強制一定要公開,而最後失敗與否則會公開。
我自己的研究範圍就包含愛滋病疫苗,從過往已經宣告失敗的臨床試驗中找出失敗原因去改進或是檢測正在進行中的臨床試驗效果如何都在我的工作範圍之內,我們在做研究分析的同時病毒仍在外造成疫情,研究人員這端能做的主要是設計並篩選出可能成為疫苗候選的成分,通過細胞、動物實驗等去分析毒性、效力及可能可以用在人類身上的劑量,這些主要是在臨床前階段就會完成。
進入到第一階段臨床試驗時除了檢測疫苗在人類身上的安全性之外,我們也會測試不同疫苗濃度及施打方式等會不會效果更好,這時候會分非常多組,每組大概 10 幾人且有安慰劑組,將檢體寄送給不同專業的研究機構進行分析後最終會知道哪個配方跟施打方式是這些中最好的,如果安全性過關且在實驗室的實驗中有看到初步效果,在監督機關審核通過許可後會進到第二期臨床試驗,招募更多志願者並進一步分析疫苗有效性跟是否有潛在的不良反應(每個人身體狀況不同所以施打者越多就有機會觀察到更多不良反應),如果在此時發現效果不好、有過多嚴重不良反應等負面結果臨床試驗就會終止於此難以繼續進入第三期。
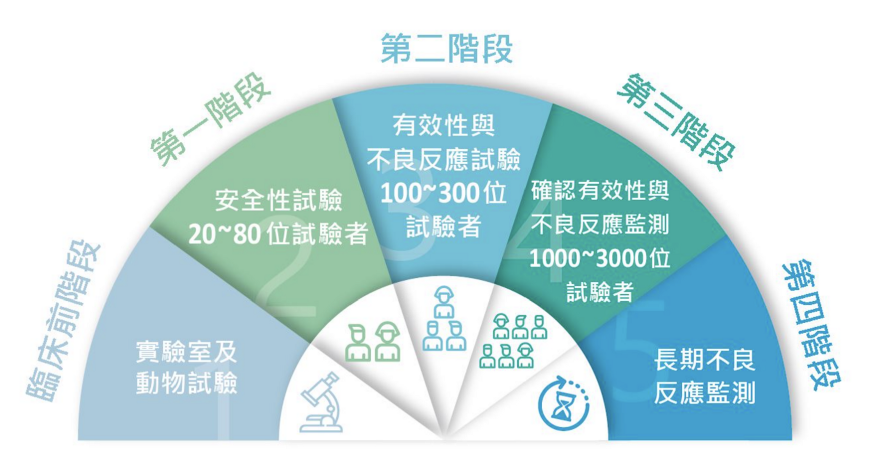
許多臨床實驗都有非常長的追蹤期,一年三年五年七年不等,但誰都沒預料到 Covid-19 疫情的爆發,倘若針對突然爆發的全球性疫情的疫苗仍要有原先那樣長得追蹤期,對全球民眾健康所帶來的傷害會超出預期,但儘管因為特殊狀況縮短 Covid-19 臨床試驗時間,開發出來也需要極佳的運氣與一定的時間,要生產足夠的疫苗同樣需要時間,這些都不是馬上完成的。
在疫情爆發之初有不少人提倡透過感染獲得群體免疫這個論點,這也使不少質疑為何要施打疫苗甚至選擇讓自己被感染。但其實已有免疫學領域大佬明確指出:傳統群體免疫的觀念可能不適用於 COVID-19 [18] 。下方的簡報是我針對該發表做簡單的科普,有興趣可以看一看。
最初群體免疫這個術語是從獸醫界開始使用[18],非常多學者想要知道那在人類流行病上同樣的理論是否適用,但在 20 世紀初期許多學者便已得知因爲疾病差異、免疫力持續時間、人口流動、所接受醫療資源差異等,人類想要單純通過感染獲得針對 Covid-19 的群體免疫基本上是不可能,需要透過適當公衛手段與有效的預防措施來控制感染數,爭取研發更有效的疫苗的時間等多管齊下才可能達成[19]。
看完上述資訊後讓我們回到:疫苗為什麼會跟不上病毒變種速度?為什麼疫苗防止感染能力變差?這兩個問題上,答案便會好懂些:
- 疫苗開發與產量都需要時間,但感染數量居高不下給病毒有出現新變種的機會,等疫苗上市時病毒已經突變無數次有新變種,自然追不上。
- 病毒的免疫逃避性逃過疫苗誘導出的抗體,疫苗保護力隨之下降。
控制疫情還是需要以適當公衛手段與有效的預防措施來控制感染數,爭取研發更有效的疫苗的時間並讓能夠施打的族群施打,多管齊下才可能達成。

錯誤點:
- 是先天性免疫“系統”,而非先天免疫細胞,他們成員很多
- 先天性免疫系統不會活化後就變成適應性免疫系統,先天性免疫系統中的細胞不會活化後就變成適應性免疫系統的細胞(樹突細胞另提),吞噬細胞再怎麼被刺激也不會瞬間變身變成B細胞
- T細胞與B細胞會不會產生記憶性、產生的記憶性多久跟病原體/抗原有關,不一定會在接受病原體/抗原刺激後出現。
人體的免疫系統分為先天性免疫系統與適應性免疫系統[20][21],而這兩者的區別為
先天性免疫系統:
- 非特異性反應,會對所有病源有反應
- 一接觸到病原馬上開始動工
- 不是所有先天性免疫系統的成員都有記憶性
- 包含發炎反應、補體系統與部分白血球(如吞噬細胞),部分成員會協助活化適應性免疫系統
適應性免疫系統:
- 對特定病原與抗原起反應
- 需要一點時間才會有強烈反應
- 有記憶性(會記得敵人一段時間)
- 淋巴球,T 細胞與 B 細胞屬於這裡!
先天免疫系統不會因為接觸到病原體就變成適應性免疫系統!他們同時存在有時互相幫忙,並以不同的機制保護人體。
而常常聽到人提到的 B 細胞與 T 細胞他們的保護身體的機制簡單來說是
B 細胞:
- 認識抗原(可能來自病原體或是疫苗)後大量製造能夠識別目標物的抗體
- 有些抗體如中和性抗體需要特殊的B細胞製造且成熟時間長
T 細胞:
- 識別受感染的細胞
- 協助 B 細胞更好的認識病原體的抗原
- 引導能夠清除的T細胞過來
- 清除受感染的細胞
- 殺死癌細胞[22]
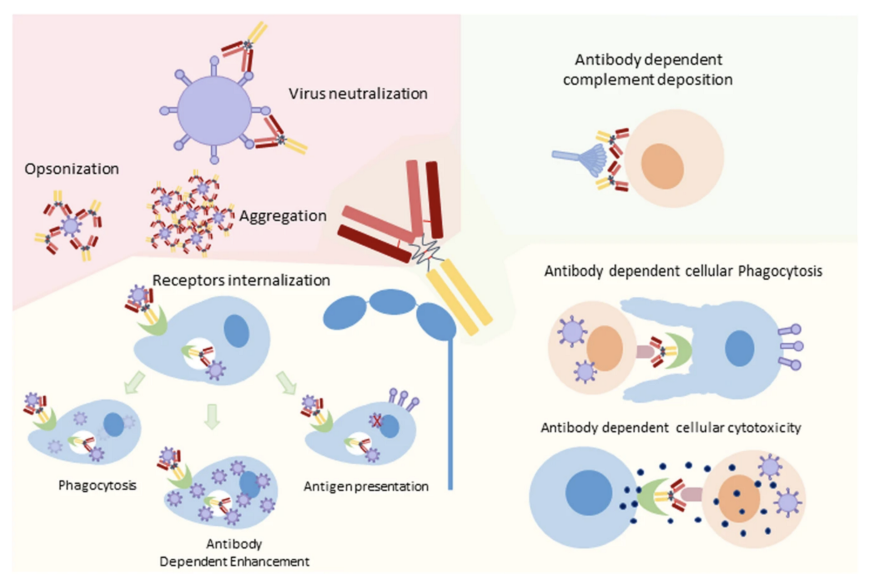
抗體、補體、抗體加上 T 細胞等組合產生多種機制,都是免疫中的一環缺一不可[23],但這些機轉中也有可能對身體造成危害的如抗體依賴增強作用Antibody-dependent enhancement (ADE),ADE能讓感染變嚴重[23][58]。倘若疫苗誘導出來的抗體做臨床前試驗或是第一期臨床試驗時發現有ADE,那該疫苗不會進到後續臨床試驗;而要觀察上市後的疫苗有沒有ADE可以從重症率死亡率是否激增來判斷,目前真實世界數據尚未看到Covid-19疫苗有ADE的問題,但有分析其可能機轉 [58][59],而在細胞實驗中感染Covid後部分誘導出的抗體有觀察到ADE [60]。
在癌症治療方面T細胞十分重要,其機轉非常複雜且需要不同細胞因子與受體協同合作[22]。B細胞與T細胞被活化後有些後代成員可能會成為具有免疫記憶的記憶B細胞與記憶T細胞等,未來如果碰到類似的抗原時可以有所反應,而能夠有多長的記憶時間則要看病源體/抗原特性來定,但這些被活化的免疫細胞不一定都能在未來提供有效的免疫反應。
在今年八月底發布於 medRxiv 上一篇尚未經通行審查但內容十分嚴謹(高機率已經投稿期刊正在進行審核)的論文指出:Covid 確診者(兩個月內)體內針對病毒抗原的特異性 B 細胞會使疫苗施打效果變差 [24],一分析確診者與未確診者施打 CoronaVac 疫苗後的免疫反應之研究指出過去有確診過的人施打疫苗後產生的中和抗體廣度較未確診者窄[25],這些研究其實揭示了因感染活化的免疫細胞甚至是記憶性免疫細胞並非在未來能成為我們對抗病源的好幫手,可能會成為讓疫苗效果變差的壞人[26]。
今年六月刊登於頂級期刊 Nature 的一篇發表更是指出 Covid 病毒進化非常多並且能夠抑制針對自己的免疫反應,這有利於反覆感染外,過往感染所產生的免疫銘印(immune imprinting)對未來再次面對不同 covid 病毒時的免疫反應產生負面影響,讓你的免疫系統(尤其是 T 細胞)對於新變種的抵抗力大幅下降[12],但在沒確診只有施打疫苗的族群上,尚未看到上述這些負面影響。

錯誤點:
- 訊號傳遞的關鍵不是只有干擾素,細胞激素非常重要
- 細胞被感染後不一會分泌干擾素,要先識別出來是敵人
- 三種類型的干擾素都很重要不分軒輊,在癌症治療的運用上不是只有第一型,第三型也有。
- 那篇號稱MIT但不是MIT的發表中沒有研究數據可以證實他所說的mRNA疫苗會破壞第一型干擾素的訊號傳遞。
能夠刺激觸發免疫系統活動的關鍵除了抗原外,宿主所產生的各種細胞激素(cytokine),其中包含文中所提到的干擾素(Interferon),能給予免疫系統進行各種不同的免疫反應[27][28],而 Covid-19 確診導致的細胞激素風暴(cytokine storm)同樣有細胞激素跟干擾素的參與[29]。
下方圖片中的內容是一篇探討 Covid 確診後的細胞激素風暴相關路徑與參與的細胞激素、干擾素成員圖,非常精美可以當作參考,或是看一看漂亮的圖表心情好。
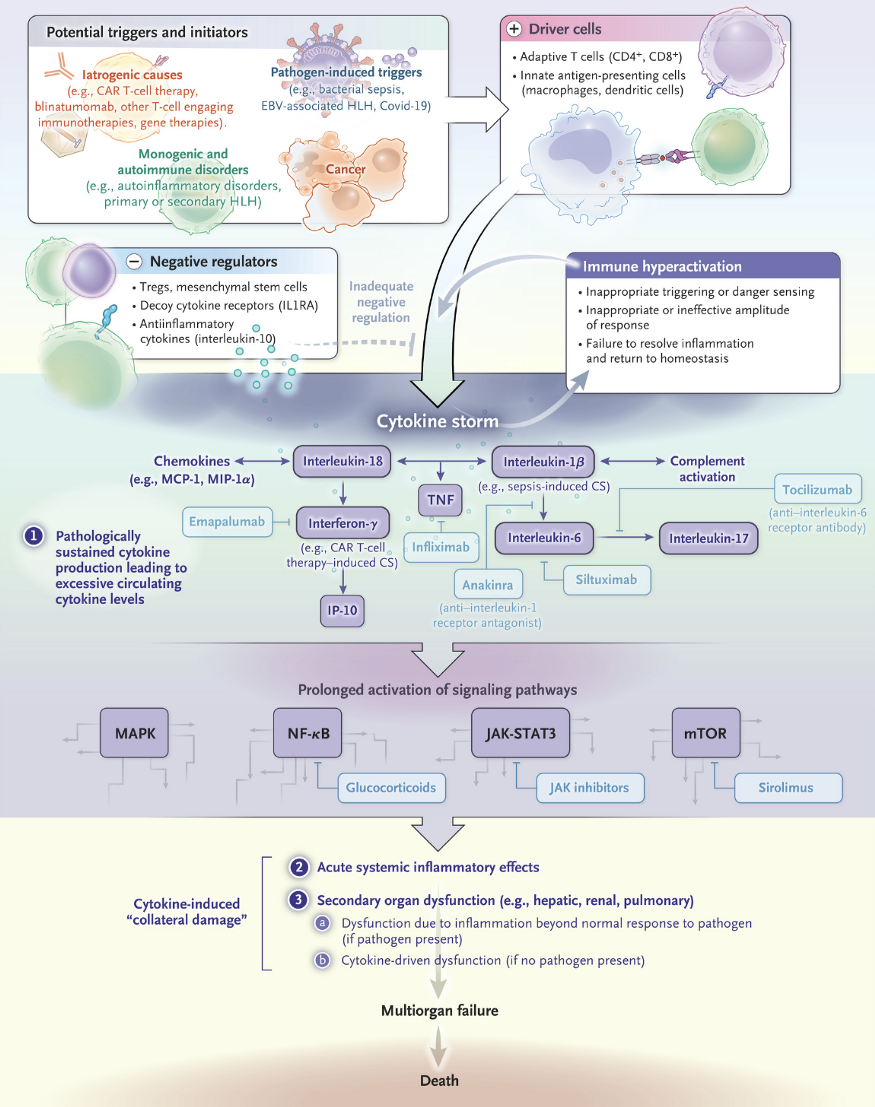
細胞激素參與身體中非常多的功能如:細胞訊息傳遞與調節免疫功能等,細胞激素家族非常龐大,而文中所提及的干擾素也是成員之一[27]。干擾素能夠影響病毒複製進而保護細胞不被感染與調節刺激一些免疫細胞,但病毒也不是毫無招架的餘地,有些病毒其實有拮抗干擾素的能力[28][30]。此外感染後的發燒、疼痛、發炎等症狀並非單純由干擾素引起,細胞激素也扮演了非常重要的角色[28]。
而干擾素分成三型,功能不完全相同但都很重要:
- 第一型:具影響病毒複製等功能,其成員有些被運用在治療肝炎,有些被用在治療多發性硬化症。[27][31]
- 第二型:誘導刺激免疫反應。[32]
- 第三型:較晚發現的成員,可能能夠影響病毒與真菌的感染。[33][34]
干擾素的確有跟其他療法如化療等一起運用在癌症治療上[35],其機轉與在治療上的運用也一直有在深入研究[36][37]。

錯誤點:
- 是細胞激素加上干擾素與其他被啟動的免疫機轉引起Covid-19確診後的最初症狀,不能說是由干擾素引起的
- 免疫觀念是流動的,疫苗也不是只有預防感染的功能,降低住院率、死亡率、重症率、緩解症狀等都是疫苗會具有的功能,更別提還有治療性疫苗這個類別
- 畫紅線的科學家表示的內容是錯的,疫苗接種對身體健康狀態有所要求,能接種疫苗者本身身體健康有一定水準,體內的免疫系統能夠清除病毒,打疫苗是讓免疫系統受到訓練後能更好的清除病毒,而施打疫苗後症狀輕微不代表身體沒抵抗
- 就現有研究來說(免疫系統正常的成人)不論接種疫苗與否,病毒在人體停留的時間沒有統計上的顯著差異
- 免疫系統功能低下者(如化療患者、愛滋病患者、特殊疾病患者等)被病毒感染後病毒可能揮之不去,但如果換作是普通人不論有沒有打疫苗免疫系統都有能力清除病毒,但能不能活到病毒被清除完又是另一回事。
Covid-19 確診後的症狀並非單純由干擾素引起,細胞激素也扮演了非常重要的角色[28],而疫苗功能其實不單純只有預防感染,減輕症狀與預防重症等也算是疫苗的功能[18]。
據目前現有研究來看,確診 Omicron 的人施打疫苗者與未施打疫苗者其實病毒量沒有太大的差距[38][39],但施打疫苗者可能因為體內的抗體與有記憶性的免疫細胞辨識出敵人並開始清除病毒所以症狀出現的較早(可見下方引用推文中的圖片)。
倘若是身體健康的成年人,施打疫苗者確診後體內病毒不會停留更長的時間[39],免疫系統會有能力將病毒清除;但倘若為免疫功能低下的人,如:特殊疾病患者、化療病人、愛滋病患等,比起健康的成年人他們體內的免疫系統較虛弱難以將病毒清除且確診後演化為重症的可能性較高,所以我們必須要小心不要讓他們被感染[5–7]。
而在這篇文章刊出不久候我收到一封信,信中說“ 如果長時間不清除疾病,可能會導致嚴重的疾病 ” 這段話可以用澳大利亞2022/06/11到2022/08/27的12週的感染新冠而住院(非加護病房)的確診案例數據去作佐證,之後我又收到一封信說我選用的數據錯誤,他給的數據只有New South Wales,不是澳洲全國。其實這兩封信中都犯了非常常見的數據分析錯誤,這樣的資訊也是假消息的愛用品,該如何破解呢?
錯誤點:
- 數據分析錯誤,分母取錯
- 要討論像是疫苗會不會影響確診率這樣的現象或假說不能只用一個地區的數據,這不是在討論不同地區因為醫療資源、人口密度等帶來的影響或案例報告。先撇開最後統計結果不提,這樣要 “只用一個地區的數據來應證一個可能會發生在全世界各地的假設” 的行為恰恰就是學術領域中會被人詬病甚至退稿的 “挑數據說故事”
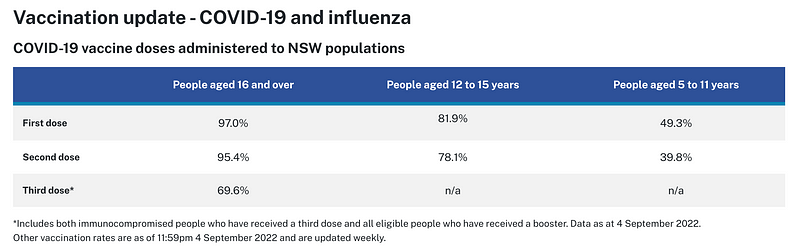
- 看時間:數據是2022年6~8月的數據,已能獲得充沛疫苗資源的國家來說該國國民絕大多數都有接種疫苗,以澳洲公布的數據來看16歲以上的澳洲人98%有接種一劑疫苗,兩劑為96.3%,三劑為71.7%,而New South Wales的人口數根據Population Australia這個網站上顯示在2022年6月底可能會達到 826萬人,而該地區16歲以上居民97%有接種一劑疫苗,兩劑為95.4%,三劑為69.6%(數據來源)

2. 分母要選對:在做如該信提到的感染機率比較時,我們必須要有施打疫苗者跟有施打疫苗者比,沒施打疫苗者跟沒施打疫苗者比,為什麼?因為你要比的是施打疫苗者跟沒施打疫苗者各自的感染機率,而以澳洲數據來看16歲以上施打至少一劑疫苗者有98%(20,209,451人),換而言之沒施打疫苗者大約是2%(412,428人);而在New South Wales16歲以上施打至少一劑疫苗者有97%(約8,017,050人),未施打疫苗者大約3%(大約247,950人)如果沒選對分母,算出來的數據會大錯特錯。
3. 小心分子裡有詐:做數據分析前我們必須要看數據有沒有妥善處理,儘管現在資訊較為發達,還是有可能有些數據會被標記或應該表記為unknown,因為其實際狀況如何以現有資訊來說未知,舉例來說
- 疫苗施打紀錄存疑需要額外查證
- 有在其他地方打過疫苗但沒有證明文件
- 在該系統中沒有出現有施打疫苗紀錄(可能其他地方有)等等
這些都會影響數據處理方式跟最終數據計算方式,這些unknown數據必須標示好並另外處理,不能跟其他數據混為一談更不能直接裁切掉忽視不理,更不能說為了讓數據量夠多我剔除unknown後多用幾週數據讓樣本數夠大,這已經能算惡意扭曲數據。
對於專業人士來說unknown這樣的數據的確是棘手,但相較於一般大眾我們有更多的權限去調取資料與做進一步數據清理分析,倘若真的處理不來我們也會如實告知,許多資訊因為涉及病人隱私絕對不會對外公開,所以問我們怎麼處理分類清理這些數據也沒用,更別提根據分析數據不同我們會用不同的統計方式,不是一般的加減乘除就可以理得清。
此外,在信中我有收到對方用來參考做計算的數據來源,而這張表一看問題就很大連拿來算的價值都沒有,爲什麼呢?
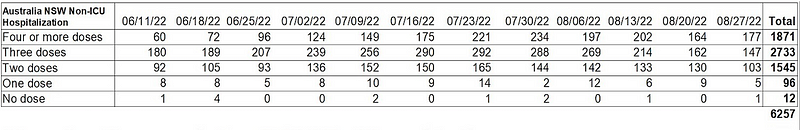
一位相關領域的博士去看原始數據後作出以下點評:
“ Unknown這群不管有沒有打疫苗也不能不理,而且光是8/20號的數據中unknown居然佔了27%(173/638住院數)的統計數,然後說當然不能分析? 他在開什麼玩笑? unknown只有幾種情形:
- 沒打
- 有打,沒有證明
- 打了不是澳洲認為OK的疫苗(台灣人最愛講高端不能出國)
- 有打的證明但不被認證
不把這些數據好好分類就直接當missing data處理,甚至在他提供的聯結中直接裁切不說明,就是惡意的扭曲數據的意義!”
對我來說他所用的數據還有另一個問題:年齡層資訊去哪了?病人是否有其他疾病呢?
讓我們再繼續使用2022年8月20日New South Wales的數據,住院者數量上升的年齡段集中在60歲以上的族群,詳情請見下圖:
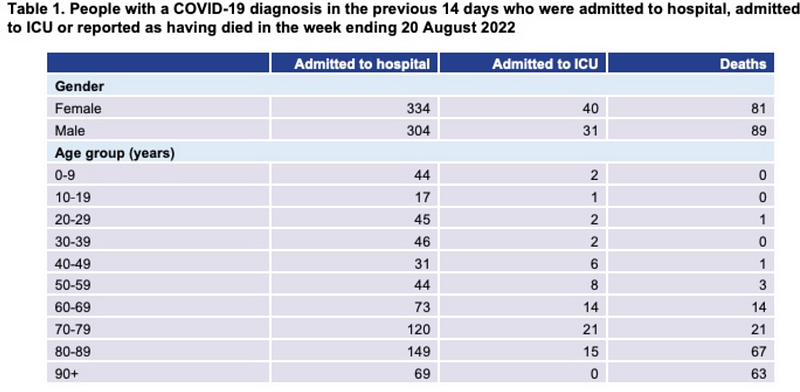
人類的免疫系統隨著年齡增長會有所影響,儘管都是16歲以上成年人,25歲的年輕人跟90歲的老人狀況不一樣,這就是為何在其他疫苗效力分析的文獻中會以10歲為一個年齡層區分開來分析,甚至連性別、種族等都是我們要考慮的因素,還要再考慮到施打了什麼疫苗;倘若取樣方式、思維邏輯錯誤,再怎麼計算最終結果也是錯的。
而且…儘管沒有權限去獲取所有數據細節,澳洲其實有數據庫已把寄件者想要知道的資訊算好了,New South Wales的數據與分析結果可點擊超連結查詢,在CovidBaseAU的網站上還有其他州與澳洲整體的數據相關分析可以查閱。
總而言之言而總之:
數據資訊充足沒有惡意處理、病人資訊明確並且數據量夠並且挑選適當的統計方式才可以進行數據分析,不是隨便加減乘除就會馬上得到真理
- (選配)複習一下國中與高中數學在機率統計方面的內容:可能對於有些人來說國高中所學的內容有點模糊了,所以在看到數據時做分析時會搞混應該用哪些數據當分子,哪些數據當分母,可以稍微複習一下。
而在原始文章中那個號稱MIT但根本不是MIT的發表在數據統計上犯的一個極大錯誤也是分母選擇錯誤,如果要算該疫苗的不良事件比例分母應該為“總施打人數”,而不是拿別的疫苗的施打人數來做加減乘除;同理在計算施打疫苗後的突破性感染比例其母數應該是施打疫苗者的人數,而沒施打疫苗者的感染比例則應適用沒有施打疫苗者的人數,別搞混嘍!

錯誤點:
- Covid-19 mRNA疫苗減弱適應性免疫反應方面沒看到有扎實實驗數據的發表,原文提到的根本不是MIT發表的發表也沒有相關數據可以佐證。
- B細胞在癌症治療中如何發揮功用還在研究中,而且B細胞能分泌的抗體種類很多,不是只有中和病原體的功能。
在本文撰寫的當下我以 google scholar 與 pubmed 查關鍵字 covid-19、mRNA vaccine、T cell、B cell 看到的主要是探討疫苗如何誘導 T 細胞與 B 細胞免疫反應,而細胞受損方面文獻主要在討論 covid 透過哪些路徑感染免疫細胞,確診對於免疫系統的影響(如 T 細胞多樣性降低,B 細胞失調等)等[40 – 44]。
在癌症治療方面 T 細胞的確有其一席之地,與不同細胞激素與細胞協調清除癌細胞[22][45][46],而近幾年的研究顯示 B 細胞與癌症治療與預後評估有所關聯,相關機制仍在研究[47][48]。

錯誤點:
- 先天免疫與適應性免疫缺一不可
- 被誘導出來的適應性免疫不一定有益
- 該荷蘭研究數據量與分析方式有疑慮,不應用其下定論
參與先天性免疫與適應性免疫的成員眾多且都很重要[27][28],但不一定所有機轉誘導出來的免疫反應都是你的好朋友[12][26]。而該荷蘭研究是否真的有顯著差異能夠證明疫苗施打後真的會影響 IFN-α 以其文章中的數據來看仍有疑慮,詳細討論在上篇中在此不多贅述。

錯誤點:
- 中和性抗體不會在一次疫苗接種後幾週就出來
- 有實際數據的研究與論文綜述指出疫苗可效刺激誘導T細胞而非活性下降
中和性抗體需要不短的成熟期,不可能在疫苗接種後幾週內產生[49][50],除非你已經是接種超過一劑疫苗,接著在第二或是第三劑疫苗施打後幾週內產生中和性抗體那可能還說得過去。而 mRNA 疫苗可以有效刺激與誘導 T 細胞與 B 細胞已在過往實驗中獲得證實[51],對於其導致心肌炎、心包炎與過敏等的可能機制也有不少研究團隊分析討論[52][53],並針對其安全性與哪些族群可能施打有較高的風險有所研究[52–54]。
mRNA 疫苗研究多年但實際大量運用在人體上也是第一次[55][56],比起其他傳統疫苗技術來說他有一定的優點如可以快速製備,同樣也有缺點如存放難度高、目前已知副作用不少以及缺乏傳統疫苗臨床試驗的長期追蹤,這些都是需要更多研究與更多時間才能知道答案。
整體來說「mRNA 疫苗爭議浮現,MIT:自然免疫系統失靈」文中部分內容正確,但更多的是似是而非跟描述方式不當,而構成這篇文章的兩篇引用文獻品質不佳甚至拿來當主打點的發表早已有國外文章分析其內容有多少問題[57],有興趣的人可以在 Reference 中找到連結查看。
引用文獻有誤、關於免疫學敘述有誤且偏頗,這是我對於「mRNA 疫苗爭議浮現,MIT:自然免疫系統失靈」這篇文章的評價;而針對該文的兩篇闢謠文 Reference 超過 60 個,遠超過原始文章中的引用文獻的數量,從此也可以看出要澄清假消息需要付出的心力有多驚人。
結語
會將這系列文拆成上下篇主要是因為「mRNA 疫苗爭議浮現,MIT:自然免疫系統失靈」是基於兩篇引用文獻再加上其他資料寫出來的,如果不將有標紅色底線的兩篇引用文獻相關內容先做闢謠科普這篇文章會很混亂很長。
沒有任何技術是完美的,隨著技術的發展、更多的研究與臨床觀察我們才能找到更適合的改進方向,進而讓不論是疫苗研發技術還是藥物療法開發等變得越來越好。但這世界上不會有任何事情是大家都接受的,總有攻擊的聲浪甚至有虛假資訊流竄,有些人儘管有高學歷,但那絕對不代表他們說的寫的是正確的,多的是這樣的人散播似是而非的資訊。
這系列文章的最後我想感謝在寫文章的過程中提供不同專業建議與見解的博士們(為了寫這篇文章我詢問了好幾位相關專業的博士),還有願意看到這行話的讀者,願這兩篇文章能夠讓沒有相關背景的大眾對於疫情相關的資訊判讀有些幫助,祝一切安好。
參考資料
- Amoutzias GD, Nikolaidis M, Tryfonopoulou E, Chlichlia K, Markoulatos P, Oliver SG. The remarkable evolutionary plasticity of coronaviruses by mutation and recombination: insights for the COVID-19 pandemic and the future evolutionary paths of SARS-CoV-2. Viruses. 2022 Jan 2;14(1):78.
- Schwarzendahl, F.J., Grauer, J., Liebchen, B. and Löwen, H., 2022. Mutation induced infection waves in diseases like COVID-19. Scientific Reports, 12(1), pp.1–11.
- Pathan, R.K., Biswas, M. and Khandaker, M.U., 2020. Time series prediction of COVID-19 by mutation rate analysis using recurrent neural network-based LSTM model. Chaos, Solitons & Fractals, 138, p.110018.
- Sharif, N. and Dey, S.K., 2021. Impact of population density and weather on COVID-19 pandemic and SARS-CoV-2 mutation frequency in Bangladesh. Epidemiology & Infection, 149.
- Mishra, M., Zahra, A., Chauhan, L.V., Thakkar, R., Ng, J., Joshi, S., Spitzer, E.D., Marcos, L.A., Lipkin, W.I. and Mishra, N., 2022. A Short Series of Case Reports of COVID-19 in Immunocompromised Patients. Viruses, 14(5), p.934.
- Maponga, T.G., Jeffries, M., Tegally, H., Sutherland, A.D., Wilkinson, E., Lessells, R., Msomi, N., van Zyl, G., de Oliveira, T. and Preiser, W., 2022. Persistent SARS-CoV-2 infection with accumulation of mutations in a patient with poorly controlled HIV infection. Available at SSRN 4014499.
- Hoffman, S.A., Costales, C., Sahoo, M.K., Palanisamy, S., Yamamoto, F., Huang, C., Verghese, M., Solis, D.A., Sibai, M., Subramanian, A. and Tompkins, L.S., 2021. SARS-CoV-2 neutralization resistance mutations in patient with HIV/AIDS, California, USA. Emerging Infectious Diseases, 27(10), p.2720.
- Focosi, D., Maggi, F., Franchini, M., McConnell, S. and Casadevall, A., 2021. Analysis of immune escape variants from antibody-based therapeutics against COVID-19: a systematic review. International journal of molecular sciences, 23(1), p.29.
- Nel, A.E. and Miller, J.F., 2021. Nano-enabled COVID-19 vaccines: meeting the challenges of durable antibody plus cellular immunity and immune escape. ACS nano, 15(4), pp.5793–5818.
- Riddell, S., Goldie, S., Hill, A., Eagles, D. and Drew, T.W., 2020. The effect of temperature on persistence of SARS-CoV-2 on common surfaces. Virology journal, 17(1), pp.1–7.
- Pulliam, J.R., van Schalkwyk, C., Govender, N., von Gottberg, A., Cohen, C., Groome, M.J., Dushoff, J., Mlisana, K. and Moultrie, H., 2022. Increased risk of SARS-CoV-2 reinfection associated with emergence of Omicron in South Africa. Science, 376(6593), p.eabn4947.
- Reynolds, C.J., Pade, C., Gibbons, J.M., Otter, A.D., Lin, K.M., Muñoz Sandoval, D., Pieper, F.P., Butler, D.K., Liu, S., Joy, G. and Forooghi, N., 2022. Immune boosting by B. 1.1. 529 (Omicron) depends on previous SARS-CoV-2 exposure. Science, 377(6603), p.eabq1841.
- https://www.jnj.com/johnson-johnson-announces-european-commission-approval-for-janssens-preventive-ebola-vaccine
- https://www.statnews.com/2020/01/07/inside-story-scientists-produced-world-first-ebola-vaccine/
- http://scimonth.blogspot.com/2018/07/blog-post_19.html
- https://www1.cde.org.tw/ct_taiwan/notes.html
- https://clinicaltrials.gov/
- Morens, D.M., Folkers, G.K. and Fauci, A.S., 2022. The concept of classical herd immunity may not apply to COVID-19. The Journal of Infectious Diseases.
- Eichhorn, Adolph. Contagious abortion of cattle. №790. US Department of Agriculture, 1917.
- Smith, A., 2000. Oxford dictionary of biochemistry and molecular biology: Revised Edition. Oxford University Press.
- Alberts, B., 2017. Molecular biology of the cell. WW Norton & Company.
- Waldman, A.D., Fritz, J.M. and Lenardo, M.J., 2020. A guide to cancer immunotherapy: from T cell basic science to clinical practice. Nature Reviews Immunology, 20(11), pp.651–668.
- Lin, L.Y., Carapito, R., Su, B. and Moog, C., 2022. Fc receptors and the diversity of antibody responses to HIV infection and vaccination. Genes & Immunity, pp.1–8.
- https://www.medrxiv.org/content/10.1101/2022.08.30.22279344v1
- Zhu, Y., Lu, Y., Tang, L., Zhou, C., Liang, R., Cui, M., Xu, Y., Zheng, Z., Cheng, Z. and Hong, P., 2022. Finite neutralisation breadth of omicron after repeated vaccination. The Lancet Microbe.
- Suryawanshi, R. and Ott, M., 2022. SARS-CoV-2 hybrid immunity: silver bullet or silver lining?. Nature Reviews Immunology, pp.1–2.
- Janeway, C.A., Travers, P., Walport, M. and Capra, D.J., 2001. Immunobiology (p. 600). UK: Garland Science: Taylor & Francis Group.
- De Andrea, M., Ravera, R., Gioia, D., Gariglio, M. and Landolfo, S., 2002. The interferon system: an overview. European Journal of Paediatric Neurology, 6, pp.A41-A46.
- Fajgenbaum, D.C. and June, C.H., 2020. Cytokine storm. New England Journal of Medicine, 383(23), pp.2255–2273.
- Elrefaey, A.M., Hollinghurst, P., Reitmayer, C.M., Alphey, L. and Maringer, K., 2021. Innate immune antagonism of mosquito-borne flaviviruses in humans and mosquitoes. Viruses, 13(11), p.2116.
- Ntita, M., Inoue, S.I., Jian, J.Y., Bayarsaikhan, G., Kimura, K., Kimura, D., Miyakoda, M., Nozaki, E., Sakurai, T., Fernandez-Ruiz, D. and Heath, W.R., 2022. Type I interferon production elicits differential CD4+ T-cell responses in mice infected with Plasmodium berghei ANKA and P. chabaudi. International Immunology, 34(1), pp.21–33.
- Kidd, P., 2003. Th1/Th2 balance: the hypothesis, its limitations, and implications for health and disease. Alternative medicine review, 8(3), pp.223–246.
- Espinosa, V., Dutta, O., McElrath, C., Du, P., Chang, Y.J., Cicciarelli, B., Pitler, A., Whitehead, I., Obar, J.J., Durbin, J.E. and Kotenko, S.V., 2017. Type III interferon is a critical regulator of innate antifungal immunity. Science immunology, 2(16), p.eaan5357.
- Hermant, P. and Michiels, T., 2014. Interferon-λ in the context of viral infections: production, response and therapeutic implications. Journal of innate immunity, 6(5), pp.563–574.
- Goldstein, D. and Laszlo, J., 1988. The role of interferon in cancer therapy: a current perspective. CA: a cancer journal for clinicians, 38(5), pp.258–277.
- Zaidi, M.R., 2019. The interferon-gamma paradox in cancer. Journal of Interferon & Cytokine Research, 39(1), pp.30–38.
- Dunn, G.P., Ikeda, H., Bruce, A.T., Koebel, C., Uppaluri, R., Bui, J., Chan, R., Diamond, M., Michael White, J., Sheehan, K.C. and Schreiber, R.D., 2005. Interferon-γ and cancer immunoediting. Immunologic research, 32(1), pp.231–245.
- Regev-Yochay, G., Gonen, T., Gilboa, M., Mandelboim, M., Indenbaum, V., Amit, S., Meltzer, L., Asraf, K., Cohen, C., Fluss, R. and Biber, A., 2022. Efficacy of a fourth dose of COVID-19 mRNA vaccine against omicron. New England Journal of Medicine, 386(14), pp.1377–1380.
- Boucau, J., Marino, C., Regan, J., Uddin, R., Choudhary, M.C., Flynn, J.P., Chen, G., Stuckwisch, A.M., Mathews, J., Liew, M.Y. and Singh, A., 2022. Duration of Shedding of Culturable Virus in SARS-CoV-2 Omicron (BA. 1) Infection. New England Journal of Medicine, 387(3), pp.275–277.
- Junqueira, C., Crespo, Â., Ranjbar, S., de Lacerda, L.B., Lewandrowski, M., Ingber, J., Parry, B., Ravid, S., Clark, S., Schrimpf, M.R. and Ho, F., 2022. FcγR-mediated SARS-CoV-2 infection of monocytes activates inflammation. Nature, pp.1–9.
- Pontelli, M.C., Castro, I.A., Martins, R.B., La Serra, L., Veras, F.P., Nascimento, D.C., Silva, C.M., Cardoso, R.S., Rosales, R., Gomes, R. and Lima, T.M., 2022. SARS-CoV-2 productively infects primary human immune system cells in vitro and in COVID-19 patients. Journal of molecular cell biology, 14(4), p.mjac021.
- Joseph, M., Wu, Y., Dannebaum, R., Rubelt, F., Zlatareva, I., Lorenc, A., Du, Z.G., Davies, D., Kyle-Cezar, F., Das, A. and Gee, S., 2022. Global patterns of antigen receptor repertoire disruption across adaptive immune compartments in COVID-19. Proceedings of the National Academy of Sciences, 119(34), p.e2201541119.
- André, S., Picard, M., Cezar, R., Roux-Dalvai, F., Alleaume-Butaux, A., Soundaramourty, C., Cruz, A.S., Mendes-Frias, A., Gotti, C., Leclercq, M. and Nicolas, A., 2022. T cell apoptosis characterizes severe Covid-19 disease. Cell Death & Differentiation, pp.1–14.
- Woodruff, M.C., Ramonell, R.P., Haddad, N.S. et al. Dysregulated naïve B cells and de novo autoreactivity in severe COVID-19. Nature (2022). https://doi.org/10.1038/s41586-022-05273-0
- Feng, S. and De Carvalho, D.D., 2022. Clinical advances in targeting epigenetics for cancer therapy. The FEBS Journal, 289(5), pp.1214–1239.
- Abrantes, R., Duarte, H.O., Gomes, C., Wälchli, S. and Reis, C.A., 2022. CAR‐Ts: new perspectives in cancer therapy. FEBS letters, 596(4), pp.403–416.
- Petitprez, F., de Reyniès, A., Keung, E.Z., Chen, T.W.W., Sun, C.M., Calderaro, J., Jeng, Y.M., Hsiao, L.P., Lacroix, L., Bougoüin, A. and Moreira, M., 2020. B cells are associated with survival and immunotherapy response in sarcoma. Nature, 577(7791), pp.556–560.
- Helmink, B.A., Reddy, S.M., Gao, J., Zhang, S., Basar, R., Thakur, R., Yizhak, K., Sade-Feldman, M., Blando, J., Han, G. and Gopalakrishnan, V., 2020. B cells and tertiary lymphoid structures promote immunotherapy response. Nature, 577(7791), pp.549–555.
- Moore, P.L., Williamson, C. and Morris, L., 2015. Virological features associated with the development of broadly neutralizing antibodies to HIV-1. Trends in microbiology, 23(4), pp.204–211.
- Gray, E.S., Madiga, M.C., Hermanus, T., Moore, P.L., Wibmer, C.K., Tumba, N.L., Werner, L., Mlisana, K., Sibeko, S., Williamson, C. and Abdool Karim, S.S., 2011. The neutralization breadth of HIV-1 develops incrementally over four years and is associated with CD4+ T cell decline and high viral load during acute infection. Journal of virology, 85(10), pp.4828–4840.
- Hogan, M.J. and Pardi, N., 2022. mRNA Vaccines in the COVID-19 Pandemic and Beyond. Annual Review of Medicine, 73, pp.17–39.
- Heymans, S. and Cooper, L.T., 2021. Myocarditis after COVID-19 mRNA vaccination: clinical observations and potential mechanisms. Nature Reviews Cardiology, pp.1–3.
- Risma, K.A., Edwards, K.M., Hummell, D.S., Little, F.F., Norton, A.E., Stallings, A., Wood, R.A. and Milner, J.D., 2021. Potential mechanisms of anaphylaxis to COVID-19 mRNA vaccines. Journal of Allergy and Clinical Immunology, 147(6), pp.2075–2082.
- Anand, P. and Stahel, V.P., 2021. The safety of Covid-19 mRNA vaccines: A review. Patient safety in surgery, 15(1), pp.1–9.
- Park, K.S., Sun, X., Aikins, M.E. and Moon, J.J., 2021. Non-viral COVID-19 vaccine delivery systems. Advanced drug delivery reviews, 169, pp.137–151.
- Heiser, A., Coleman, D., Dannull, J., Yancey, D., Maurice, M.A., Lallas, C.D., Dahm, P., Niedzwiecki, D., Gilboa, E. and Vieweg, J., 2002. Autologous dendritic cells transfected with prostate-specific antigen RNA stimulate CTL responses against metastatic prostate tumors. The Journal of clinical investigation, 109(3), pp.409–417.
- https://www.respectfulinsolence.com/2022/05/02/scientific-review-articles-as-disinformation/
- Halstead, S.B. and Katzelnick, L., 2020. COVID-19 vaccines: should we fear ADE?. The Journal of infectious diseases, 222(12), pp.1946–1950.
- Li, M., Wang, H., Tian, L., Pang, Z., Yang, Q., Huang, T., Fan, J., Song, L., Tong, Y. and Fan, H., 2022. COVID-19 vaccine development: milestones, lessons and prospects. Signal transduction and targeted therapy, 7(1), pp.1–32.
- Maemura, T., Kuroda, M., Armbrust, T., Yamayoshi, S., Halfmann, P.J. and Kawaoka, Y., 2021. Antibody-dependent enhancement of SARS-CoV-2 infection is mediated by the IgG receptors FcγRIIA and FcγRIIIA but does not contribute to aberrant cytokine production by macrophages. MBio, 12(5), pp.e01987–21.