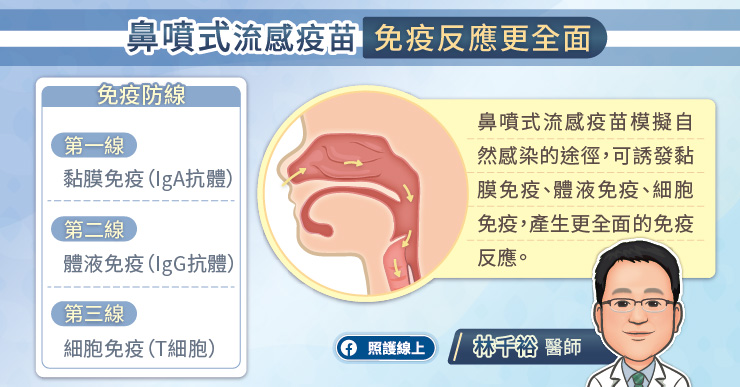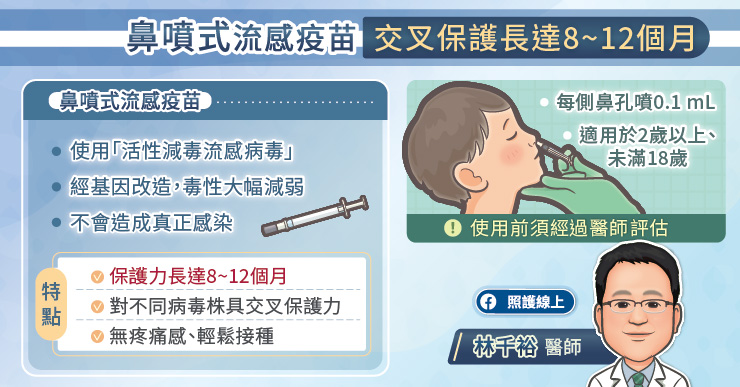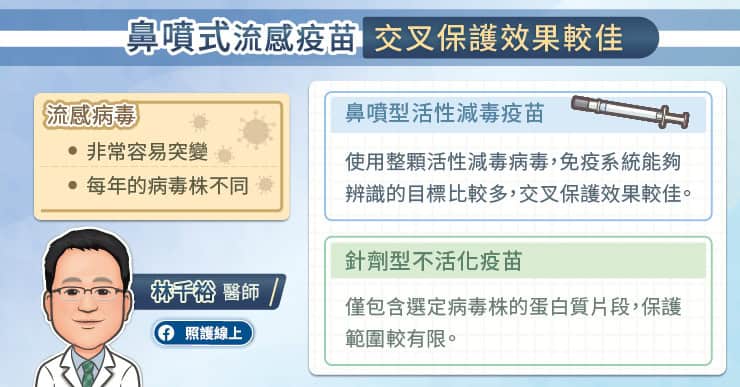
侵入者和宿主
儘管致命疾病看似想殲滅所有病人,但其實並非如此。事實上,每當免疫系統遭受攻擊時,侵入者和宿主之間就會展開軍備競賽。
穆勒解釋,以瘧疾為例,人類免疫反應和瘧原蟲(引發瘧疾的寄生蟲)的交互作用,維繫了人類和寄生蟲之間的平衡。「如果一種具備特定基因的寄生蟲變得普遍,就會有比較多人接觸到這種寄生蟲,從而演化出免疫力,」穆勒說明, 「如此這種寄生蟲就比較難在群體中傳播而存活,這會對該種寄生蟲施加選擇壓力,使其調整基因結構。」
穆勒說,這種過程稱為平衡性天擇,我們與古老的病原體之間常有這種關係。瘧疾其實可由多種不同的近親瘧原蟲傳播,穆勒指出,其中「間日瘧原蟲是比惡性瘧原蟲古老的人類寄生蟲,與我們一起演化的歷史較長」。他補充說明, 如此久遠的關係造成的結果就是,雖然間日瘧原蟲也可能導致病重和死亡,但機率比較晚出現的惡性瘧原蟲低得多。
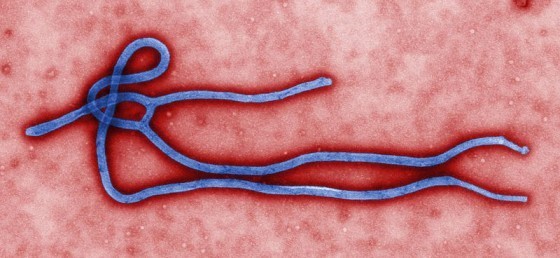
至於相對年輕的伊波拉病毒不久前才從果蝠跳船到猿猴和人類身上。根據世界衛生組織(WHO),大猩猩和黑猩猩等靈長動物都是使人類罹病的可能傳染源。然而穆勒指出,新的研究資料顯示這些靈長目動物跟我們一樣,都是「偶然宿主」,他說,「換言之,這些靈長動物感染並傳播了伊波拉病毒,但並非製造病毒的『常備宿主』。」他說明,目前認為伊波拉病毒最初的傳染窩是果蝠──而食用果蝠很可能是疫情爆發的原因。
伊波拉是相當晚近的病原體,這似乎能說明此種病毒為何如此致命。他指出:「伊波拉病毒和人類之間尚未彼此適應,因此病起來會非常嚴重,致死率很高,接著高致死率就會對人類的基因體施加選擇壓力──可能也就會對伊波拉的基因體施加選擇壓力,」他補充,「因為對病原體來說,通常殺死宿主並不是理想的演化結果。」
代代相傳
無論在哪個人類群體中,感染疾病的人口百分比很大一部分取決於病原體傳播的難易度。流行性感冒傳播迅速,且多數人都經常接觸這種病毒,因此通常只會產生溫和的感染症狀;某些突變的流感病毒對人則更有殺傷力,好比一戰後逾 5 億人罹患的「西班牙流感」就是一例,當時共造成 5000 萬到 1 億人死亡,另外新型流感(H1N1)更在 2009 年的大流行中奪走超過 20 萬 3000 人的性命。
「舉例來說,罹患瘧疾的機率取決於蚊子的數量和大家被叮咬的頻率,」穆勒解釋,「在傳染迅速的熱帶地區,多數人都會感染,而首次感染瘧疾的成年人若未經治療,死亡率約是 15%到 20%,兒童則稍低。」穆勒說,這個比例經過遺傳適應會大大降低。「族群很快能獲得對(致命) 瘧疾的免疫力,到第二次患病時的死亡機率就大幅下降,待罹病三到五次後,致死率已經近乎零。」
當然也有人無論在多惡劣的條件下都不會感染。不久前,人類基因體的解碼揭示了抵抗疾病能力的驚人事實。聲譽卓著的《自然》期刊於 2014 年 10 月號發表一篇由瑞士科學家主導的跨國團隊研究,此研究說明了為何某些人能迅速中和流感病毒──這類病毒一直長伴人類左右,而我們對它們也瞭若指掌。
原來中和病毒的是一些會附著在血球凝集素(haemagglutinin)上的抗體。 血凝素是病毒表面呈釘狀突起的蛋白,能牢結細胞中特定的醣鏈,像把尋找鎖孔的鑰匙,一旦找到,血凝素便附著在細胞上,然後像木馬屠城般釋出其他蛋白, 操控細胞的運作。
然而血凝素卻也是病毒的罩門。這支跨國團隊的科學家發現,某種抗體經過一次突變後便能中和多種流感病毒,方法是牢結於血凝素蛋白的特定部位。製造這種抗體需要一種叫 VH1-69 的基因片段,這種基因片段以兩種形式出現在人體中,其中一種可以產生前述能中和多種病毒的抗體──而擁有這種基因的人頗多。有些人缺乏這種基因片段,無法產生此抗體,但仍能結合其他基因片段,製造出抵抗流感的抗體,但是過程較費時,效果也不一定那麼好。科學家現在希望運用這項發現來研發疫苗,誘發廣效性的流感抗體反應。
但同時我們仍得感謝祖先已經賜給我們能抵禦多種感染的抵抗力,我們之所以擁有與生俱來的遺傳抵抗力,是因為先人接觸過這些病原體或其近親。此外, 突變也可能自發產生──我們也可能在偶然之中獲得防護,只不過這類自發性的突變在特定疾病爆發、經過天擇之前通常十分罕見。
穆勒說,這類突變能幫助我們打各式各樣的仗,有些戰役我們甚至渾然不覺。他表示:「許多突變能夠保護我們不被疾病奪走性命,這類突變不只影響基因對特定病原體的表現,還能幫助我們抵禦多種病原體入侵──甚至是我們從未碰過的種類,這現象就稱為交叉抵抗性。」
舉例來說,據估計有 1%的北歐人後代對愛滋病幾乎免疫──尤其是擁有瑞典血統的人,這些對人體免疫缺陷病毒(HIV)有高度免疫力的人身上都有一對突變基因,可防止免疫細胞產生一種名為 CCR5 的受體。這種受體就像一枚愛滋病毒專屬的鎖,一旦拿掉了這道鎖,愛滋病毒就無法闖入而佔領細胞。
耐人尋味的是,儘管 HIV 是相當年輕的病毒,但研究人員透過分子考古學, 估計此突變其實大約在中世紀時就已經出現。科學家認為此基因突變很可能是演化來幫助我們抵禦天花或痢疾的,這兩種都是千萬年來帶給人類無數苦難的恐怖疾病。
目前已知還有其他突變也提供了我們對疾病的抵抗力。舉例來說,身上帶有囊腫性纖維化突變基因(但非患者)的人更能抵抗霍亂等導致脫水的腸道疾病。 另外,遺傳了單個鐮狀細胞貧血症突變染色體的人(具有兩個突變染色體才會成為患者)也可能因此對瘧疾更有抵抗力。
但了解上述情況的成因是另一回事。穆勒說,儘管過去十年來,科學家在醫學基因體學的領域多有突破,也更了解疾病及疾病的成因,卻仍無法清楚了解為什麼一種主導血紅素(血液中輸送氧氣的分子)部分編碼、名為「α鏈」的基因一旦突變,便可能幫助我們抵禦多種傳染病。
種族抵抗力?
要明白戰勝疾病之道的關鍵,就是找出哪些人對抗疾病的表現最好,然後再研究原因。舉例來說,伊波拉病毒橫掃西非,儼然所向披靡,各界也持續殷切研發疫苗和有效的治療方法,但有個族群卻似乎對伊波拉病毒有與生俱來的抵抗力。
法國科學家在一項研究中發現,非洲中西部國家加彭的鄉村聚落中約有 15% 的人具備伊波拉抗體──其中有一些地區從未爆發過伊波拉疫情。科學家認為, 這些人很可能接觸過伊波拉病毒,或許是接觸了帶原狐蝠的唾液。科學家發現, 比起生態較不多樣的湖濱地帶,森林地區居民的伊波拉抵抗力較優異(某些村落甚至高達 33.4%),因為這些地方有蝙蝠等伊波拉病媒動物棲息。
不同種族對疾病的抵抗力各有差異,這點並不陌生,但基因如何影響人類對疾病的易感性,我們現在才開始了解。英國研究發現,來自印度半島的男性罹患心血管疾病的比例較高,而出身愛爾蘭和蘇格蘭的人則有較高機率死於癌症。
出生於加勒比海的男性死於中風的機率比一般人口高 50%,但華裔的男女性罹患心絞痛和中風的比例較低。且在這些研究中,抽菸、血壓、肥胖和膽固醇等已知的風險因子都無法解釋上述族群差異。
接著在 2013 年,北美科學家發現種族和抗體之間有個令人玩味的連結。他們發現人類許多抗體基因的表現及其能抵禦的對象都因人而異,亦即儘管我們接受針對大眾設計的藥物、治療和疫苗,但人人對病原體與疾病仍有獨一無二的反應。
抗體通常由一對免疫球蛋白、重鏈和一對輕鏈組成,而研究人員針對人類第 14 號染色體中由一百萬個核苷酸排列而成的免疫球蛋白重鏈基因區域進行定序,並有了迷人的發現。紐約西奈山醫學院的博士後研究員柯瑞.渥森(Corey Watson)表示:「我們以現有知識為基礎進行研究,發現人類基因體中免疫球蛋白重鏈基因座的 DNA 序列有些區段會缺失或新增插入──該區域正決定了抗體基因數量和多樣性。」他指出:「而這特徵很可能有種族差異。」
科學家很久之前便已經知道,免疫球蛋白重鏈基因座能有 50 多種抗體基 因,供 B 淋巴細胞抵禦各種感染和疾病;而渥森的研究團隊進一步篩選 425 位 亞裔、非裔和歐裔受試者的染色體,找到抗體基因有 11 個可能的 DNA 重要缺失和插入,且某些情況下影響了疾病易感性。
渥森強調:「目前一切才起步,但這些研究成果意味著,各種族過去在自然環境中接觸的特定病原體,增加了這類 DNA 的插入和缺損的頻率,進而影響了後代對疾病之罹患率。」
「在抗體研究領域中,『發掘中和流感抗體』等研究非常重要,因為這類研究指出了免疫球蛋白重鏈遺傳變異的重要功能,並且用來對付一種非常重要的傳染病──流行性感冒,」他說,「這類成果也顯示,我們思考免疫反應時,可能需要將遺傳變異的資訊納入考量──特別是用來找出高風險群,或人口中哪些族群能受益於更精確的標靶治療。」
渥森說,目前他沒有發現整個族群對特定疾病有抵抗力的例子。「但大家確實推測,群體中就是有人對特定疾病的抵抗力高人一等。」他補充說明,在某些情況下,遺傳變異有時在各族群中發生的頻率也會有差異。「但抵抗力是來自遺傳或其他潛在因素則說不準,」他指出。
穆勒也同意。「一個族群接觸一種新的病原體後會發生什麼事,很大一部分取決於病原體的類型,以及我們(包括個人與族群)是否曾接觸過相近的病原體,」 他表示,「甚至面對一些我們已經逐漸了解的疾病,好比地中海貧血,我們知道越多,便發現有待探索推敲的也越多。」
本文出自《探索頻道雜誌國際中文版》2015 年 03 月號第 26 期