- 作者/照護線上編輯部
- 本文轉載自 Care Online 照護線上《罹癌就得放棄工作?晚期肝癌口服標靶藥助彈性兼顧工作與生活!晚期肝癌治療圖文懶人包》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接

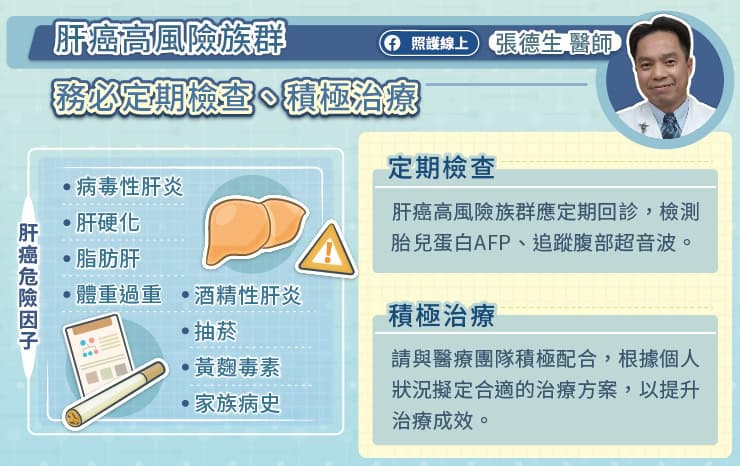
台灣肝癌每年約有上萬名新確診的肝癌個案,其中又以 45 歲以上、具備勞動生產力的族群佔多數 。而肝癌因早期症狀不明顯,直到腫瘤較大才可能出現腹脹、腹痛、黃疸等症狀,等到確診肝癌時已有約三成患者為不適合手術治療的晚期〔1〕,且疾病惡化速度快〔2〕。臺大醫院癌症微創中心黃凱文主任指出,根據最新的癌症登記報告,110 年新增的罹病數中 45 歲以上男性近七成〔1〕。可見對於勞動階級的威脅之大,罹病後可能嚴重他們的生活與生計。

晚期肝癌新藥藏自費風險,健保申請成功率不到五成
針對早期肝癌,一般會先評估進行手術治療。黃凱文醫師說明,中晚期肝癌除了使用手術局部治療外,若病人的狀況許可,還可進行全身性藥物治療,包括標靶藥物、免疫藥物等。晚期肝癌的健保用藥中,目前有一線藥物三種藥物,病人只要符合相關條件,醫師便會協助申請使用,其中有一項是新通過的標靶加免疫藥物的免疫治療組合〔3〕。
然而最新的藥物並不一定對病患就是最好的藥物。黃凱文醫師提醒:「目前健保規定三種藥物中只能擇一給付,倘若治療效果不明顯想改用其他藥物,接下來病人有可能要自費使用。」而新藥標靶加免疫的治療組合,相對於另外兩款藥物,健保給付條件較嚴格,如果半年內腫瘤沒有持續縮小,健保便不再給付〔4〕。若要自費繼續使用,經濟負擔就相當沉重。
「就我個人的經驗而言,第一次申請新藥大約只有四成晚期病人可以滿足健保給付條件,而後續第二、三次申請中,目前僅有一半病人能夠續用新藥。」對於健保續用狀況,黃凱文醫師如此分享。
選擇適合的治療方式,穩定用藥維持生活品質
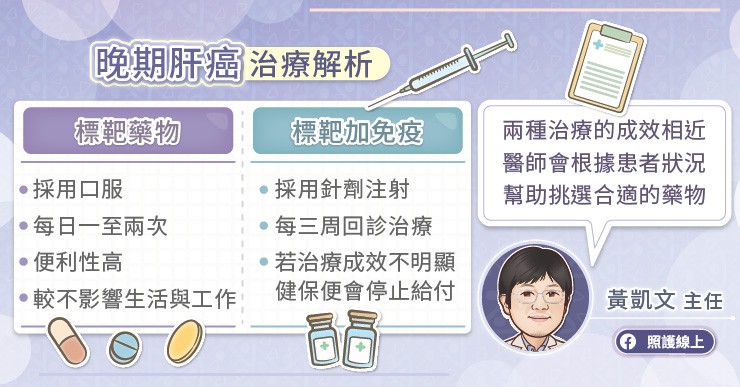
健保通過新藥後,肝癌治療選擇增加,黃凱文醫師指出,標靶加免疫的治療組合與口服標靶藥物的反應率、治療成效相近,不過標靶加免疫的治療組合採用針劑注射,病人需要每三週回診接受治療;而口服標靶藥,只要在家服藥每日一到兩次,病人無需每月來回跑醫院,回診次數相對少很多,對生活及工作影響也較小。
現階段晚期肝癌的治療,標靶藥物與免疫藥物都能發揮治療成效。在這些治療選項中並沒有絕對較好的選擇,重點在於適不適合。黃凱文醫師說明,醫師都會與家屬、病人詳細討論。綜合考量,每個人的健康狀況、家庭環境、經濟考量後,共同決策選擇合適的藥物。
由於肝癌早期沒有症狀,具有危險因子的民眾一定要定期追蹤檢查,早期發現、早期治療能夠達到較佳的預後。黃凱文醫師提醒,B 型肝炎或 C 型肝炎帶原者應該及早接受治療,現在已有成效卓越的抗病毒藥物,能夠避免肝臟持續發炎,降低罹癌風險。若確診中晚期肝癌,請不要灰心。黃凱文醫師說,肝癌的治療藥物持續在進步,治療選擇也越來越多。病人只要和醫療團隊密切配合,按部就班接受治療,便有機會達到長期存活!

筆記重點整理
一、 肝癌初期大多沒有症狀,在台灣,新增的肝癌個案中約三成肝癌患者在確定診斷時便是中晚期肝癌,不適合接受手術治療。肝癌的危險因子有很多,包括病毒性肝炎(如 B 型肝炎、C 型肝炎)、肝硬化、脂肪肝、體重過重、酒精性肝炎、抽菸、黃麴毒素、家族病史等。
二、 針對早期肝癌,一般會先評估進行手術或消融治療。而中晚期肝癌,除了使用手術局部治療外,若病人的狀況許可,還可進行全身性藥物治療,包括標靶藥物、免疫藥物等。
三、 標靶加免疫的治療組合與口服標靶藥物的反應率、治療成效相近,不過標靶加免疫的治療組合採用針劑注射,病人需要每三周回診接受治療,而口服標靶藥,只要在家服藥每日一到兩次,有助減少回診次數,對生活與工作的影響較小。
四、 新藥的健保給付條件相對較嚴苛,如果半年內腫瘤沒有持續縮小,健保便不再給付,患者需要自費使用藥物。
五、 現階段晚期肝癌的治療,標靶藥物與免疫藥物都能發揮治療成效。在這些治療選項中並沒有絕對較好的選擇,重點在於適合患者個人的狀況。
- 本文轉載自 Care Online 照護線上《罹癌就得放棄工作?晚期肝癌口服標靶藥助彈性兼顧工作與生活!晚期肝癌治療圖文懶人包》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接
參考資料
- 衛生福利部 110 年癌症登記報告
- Nathani, P., Gopal, P., Rich, N., Yopp, A., Yokoo, T., John, B., Marrero, J., Parikh, N., & Singal, A. G. (2021). Hepatocellular carcinoma tumour volume doubling time: a systematic review and meta-analysis. Gut, 70(2), 401–407. https://doi.org/10.1136/gutjnl-2020-321040
- 衛生福利部 全民健康保險藥物給付項目及支付標準共同擬訂會議藥品部分第 62 次會議紀錄
- 衛生福利部 藥品給付規定