本文轉載自諾貝爾化學獎專題系列,原文為《【2013 諾貝爾化學獎】將實驗帶入網際空間》
- 譯者/曹一允|美國德州農工大學 Karen Wooley 教授指導下取得博士,現於日本萊雅公司進行研究。
- 譯者/蔡蘊明|台大化學系名譽教授
化學反應以閃電的速度進行著;電子在原子核間跳躍,閃避著化學家們虎視眈眈的雙眼。2013 年的諾貝爾化學桂冠得主們利用電腦,讓化學的神祕路徑得以現形。對於化學運作的細部暸解,使得催化劑、藥物以及太陽能電池的最佳化變得更有效率。
將實驗帶入網際空間
全世界的許多化學家幾乎每天在電腦上設計以及執行實驗,透過馬丁.卡普拉斯(Martin Karplus)、麥可.李維特(Michael Levitt)以及艾瑞.瓦歇爾(Arieh Warshel)於 1970 年代所發展的方法,化學家們檢視著用肉眼無法看到的複雜化學過程之中的每一個小小的步驟。
爲了讓讀者感受到人類如何因此而受惠,讓我們用一個例子來開頭。請穿上你的實驗衣,因為我們要給你一個挑戰:創造人工光合作用。這個在綠葉中進行的化學反應,讓大氣充填了氧氣,也是地球上有生命存在的必要條件之一。但是從環境的角度來看,這是很有意義的,因為如果你能夠模擬光合作用,就能創造更有效率的太陽能電池。當水分解時會產生氧氣,但隨伴產生的氫氣則可以用於驅動我們的車輛。因此你有十足充分的理由參與這個計畫,假若你成功了,對解決溫室效應的問題,你也會有所貢獻。
一張圖超過千言萬語──但並非全部
做為第一步,你應該會上網去找尋那些控制光合作用的蛋白質的三維結構圖像。這些圖像均可從網路裡自由的取得,你可將圖像在電腦上隨意旋轉和扭曲,它揭露了巨大的蛋白質分子裡數以萬計的原子。在其中心某處,有一個小小的區域,被稱為反應中心,這就是水分子被裂解的地方。不過只有幾個原子是直接參與這個反應的。圖像很清楚的顯示了原子與離子相互坐落的位置,但卻無法說出這些原子與離子如何運作,這就是你需要搞清楚的。不知如何地,電子必須從水分子中取出,另有四個質子(H+)必須處理,這到底如何發生呢?

這個過程用傳統的化學方法基本上是無法弄清楚的,有太多的事情發生在一個毫秒(10-3秒)之內,這種速度排除了用試管實驗來研究之可能。從你的電腦圖像也仍然很難猜測反應的過程,因為圖像是在靜態取得的,然而當太陽照射在綠葉上時,那些蛋白質充滿了能量,而整個分子的結構改變了。為了瞭解這個化學反應,你需要知道充填了能量的分子結構是什麼樣子。
這就是需要召喚電腦程式來幫助你的時刻,而這些電腦程式就是基於 2013 年的諾貝爾化學獎得主們所奠定的基石。
理論與實踐──一個成功的相輔相成
利用這種電腦程式,你可以計算各種可能的反應路徑,這被稱為模擬(simulation or modeling),此法讓你對那些原子在化學反應的不同階段扮演的角色有些概念,而當你有一個可能的反應路徑時,會較容易執行真實的實驗,來證實電腦的對錯,這些實驗反過來提供了新的線索,以導致更好的電腦模擬結果;理論與實踐達到相輔相成的效果。結果是,化學家們花在電腦前面的時間,與花在試管之間的時間幾乎一樣多!
那麼這次諾貝爾化學獎得主們發展的電腦程式,到底有何神奇之處呢?
將兩個世界最好的整合起來
過去,當科學家們要在電腦上模擬分子時,他們擁有的程式不是基於古典牛頓物理,就是基於量子物理,二者各有其長處與短處。基於古典物理的程式能計算與處理大的化學分子,它們只能顯示靜態的分子,給予化學家們關於分子內的原子的相對位置很好的圖像,可是你無法用這些程式去模擬化學反應。在化學反應時,分子是充滿能量的,處在激發的狀態,古典物理就是無法理解這些狀態,而這就成為一個嚴重的限制。

當科學家們要模擬化學反應時,他們需要轉而求助量子物理;其二元理論(dualistic theory)將電子視為同時具有粒子與波動的雙重性質,其中著名的「薛丁格的貓」,藏在盒中,可能是活的也可能是死的。量子物理的強項在於它是沒有偏見的,其模型不包括科學家們的預測,因此這樣的模擬較為真實。但其缺點在於計算需要耗費龐大的電腦資源,因為電腦需要處理分子中的每一個電子以及原子核。這就好像一張數位圖像的像素(pixel)數目,像素越多,解析度越佳,但是需要較多的電腦空間。類似地,透過量子物理的計算,雖然可以描繪化學反應中的詳細過程,但是需要強大的電腦。在 1970 年代,這意味著科學家們只能對小分子進行計算。在模擬時,他們被迫忽略分子與周遭環境的作用,雖然真實世界中的化學反應大都在某些溶液中進行,但是假若科學家們計算時,要電腦將溶劑也一併考慮的話,他們將需要等待個幾十年才能得到結果。
所以古典物理與量子化學是兩個本質上不同,而且在某些方面相互衝突的世界。但是 2013 年的諾貝爾化學獎得主們,替這兩個世界打開了一扇大門。在他們的模型裡,牛頓與他的蘋果,跟薛丁格和他的貓合作。
量子化學與古典物理合作
在 1970 年代,在美國劍橋哈佛大學卡普拉斯的實驗室裡,開展了合作的第一步。卡普拉斯具有深厚的量子背景,他的研究小組發展的電腦程式,藉著量子物理的幫助可以模擬化學反應。他也發展了所謂的「卡普拉斯方程式」應用於核磁共振(NMR),那是一個化學家熟知的方法,乃基於分子的量子化學性質所建立的。當瓦歇爾完成他的博士學位後,在 1970 年進入了卡普拉斯的實驗室。他的博士學位是在以色列 Rehovot 的 Weismann 科學研究院所獲得的,該研究院擁有一台能力強大的電腦,被稱為 Golem,那是取自猶太傳說中的一位有生命的泥人的名字。透過 Golem 的幫助,瓦歇爾與李維特基於古典理論,發展了一個突破性的電腦程式,此程式能夠模擬各種分子,甚至於真正很大的生物分子。
當瓦歇爾加入卡普拉斯在哈佛大學的研究小組時,帶著他那古典的電腦程式,以這個程式為起點,他與卡普拉斯發展了一個新的程式,以不同的方式計算不同的電子。在大部分的分子中,每一個電子繞著特定的原子核運行,但是在某些分子中,某些電子可以毫無阻礙的在數個原子核間移動,這些「自由電子」可以存在於像是視網醛(retinal)這個分子中,此分子是嵌在眼睛的視網膜上。卡普拉斯對於視網醛有著長期的興趣,因為這個分子的量子化學性質,影響了某些生物的功能;當光照射在視網膜上,視網醛的自由電子就會得到能量,因此改變了分子的形狀,這是人類視覺的第一步。
最後,卡普拉斯與瓦歇爾終於能夠處理視網醛,不過他們是從具有簡單結構的類似分子開始的。他們發展了一個電腦程式,運用量子物理來處理自由電子的計算,但是用簡單的古典理論來處理其它的電子以及所有的原子核。在 1972 年,他們發表了研究結果,這乃是第一次有人能夠透過古典與量子物理的合作來處理化學相關的問題,但是此法僅能處理具有鏡面對稱性的分子(像人一般有一面鏡子在身體正中央而左右對映)。
一個萬用程式來計算生命的化學
在哈佛大學待了兩年之後,瓦歇爾又與李維特合作。此時李維特已經完成了英國劍橋大學的博士訓練,正值全球尖端的研究都在於探討像是 DNA、RNA 以及蛋白質這類的生物分子。他企圖用他的古典電腦程式,來對生物分子的結構做進一步的瞭解,然而限制仍然存在,僅能觀察靜態的分子。
李維特與瓦歇爾瞄準了一個很高的目標,他們想要發展一個程式用來研究酵素;也就是生命活體中,控制與催化化學反應的許多蛋白質。早在瓦歇爾還是一位年輕的學生時,他就對於酵素如何運作很好奇。透過酵素間的相互合作,生命才可能存在,它們控制了基本上所有生命體內的各種化學,如果你想要瞭解生命,你就必須瞭解酵素。
爲了能夠模擬酵素的反應,李維特與瓦歇爾必須讓古典與量子物理的合作更為順暢,這花了他們許多年去克服各種障礙。他們的探索始於 Weismann 科學研究院,但是當李維特在數年後完成了他的博士後研究的訓練,他回到了劍橋,在那裡瓦歇爾也來加入。在 1976 年,他們達成了目標,並發表了第一個酵素反應的電腦模擬,他們的程式是革命性的,因為它可以用在各種分子上,在模擬化學反應時,大小已經不成問題。
聚焦於運作的心臟
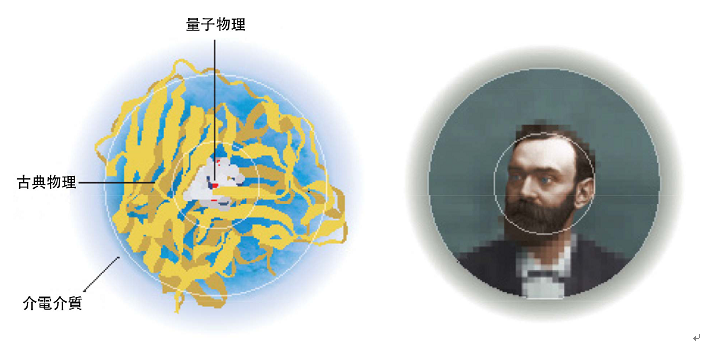
現在當化學家模擬化學反應時,他們需要時就會運用這種力量。他們對每一個直接影響化學過程的電子與原子核,進行吃力的量子物理計算,這樣,他們取得關鍵所在儘可能最佳的解析,分子其他的部分則用古典的方程式來模擬。
爲了不浪費電腦的能力,李維特與瓦歇爾將計算的負載進一步修減,電腦不需要一直處理分子中不重要部分的每一個原子,他們展示了可以將多個原子合併計算。
現在的計算中,科學家還在模擬時加入了第三個層次。簡單的來說,電腦可將離化學反應中心很遠的原子們包裹在一起,成為一個均勻的質體。在科學圈內,這被稱為介電介質(dielectric medium)。
模擬將帶我們進展至多遠決定在未來
因為現今的科學家可以用電腦來進行實驗,這讓我們對化學反應如何的進行得到了更深的理解。卡普拉斯、李維特以及瓦歇爾發展的方法的強度在於它們是萬用的,它們可以用來研究各種化學;從生命的分子到工業上的化學反應,科學家可以將太陽能電池、汽車用的催化劑或甚至於藥物最佳化,而這僅是舉幾個例子而已。
不過進展不會停在那裡,在李維特的一篇論文中,寫到了他的夢想:在分子的層次模擬生命體,那真是個極為誘人的想法。由 2013 年的諾貝爾化學獎得主們發展的電腦模擬,是極為有力的工具,到底它可將我們的知識推進到多遠,只有未來才能決定。
參考資料
- 本文譯自諾貝爾化學獎委員會公佈給大眾的新聞稿,原文可自以下官方網站取得:http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2013/popular-chemistryprize2013.pdf
- 若有興趣閱讀進階的資料,請由下列網址取得:
http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2013/advanced-chemistryprize2013.pdf