本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位。
- 採訪撰文|寒波
- 美術設計|林洵安
細胞小小一顆,內部運作卻複雜無比,堪比現代化城市,生產、物流、回收與廢棄物清運,每個環節都要考慮平衡,時時應付變局。中央研究院生物化學研究所的陳瑞華特聘研究員,發現細胞兩大資源回收系統的特殊互動:透過泛素─蛋白酶體系統來調控細胞自噬。簡單來說就是,細胞在一般狀況下如何維持平衡,面臨逆境時怎麼力挽狂瀾。在研究過程中,負責脂肪代謝的肝細胞當然也沒有缺席,將來我們對細胞自噬有更多瞭解時,就可能開發出有效控制非酒精性脂肪肝的藥物。論文於 2021 年 2 月發表於《自然通訊》(Nature Communications)。
細胞分解蛋白質的兩套系統:泛素與細胞自噬
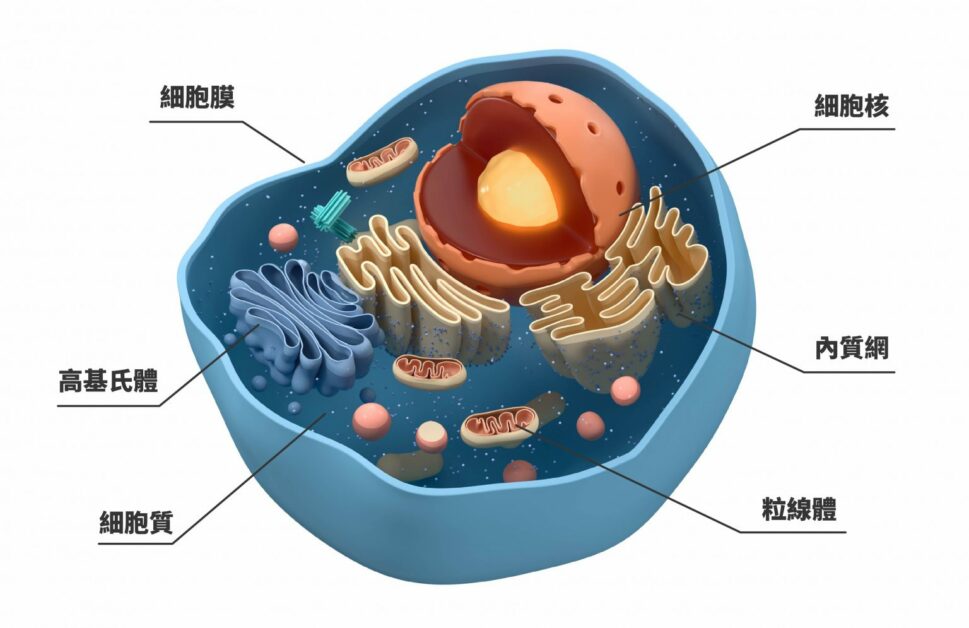
細胞內的蛋白質零件如有損壞,就需要分解與回收,主要依靠各有所長、也能互補的兩套回收系統:一套是「泛素─蛋白酶體系統」(ubiquitin-proteasome system,簡稱 UPS ),另一套是「細胞自噬─溶酶體系統」(autophagy-lysosome system)。
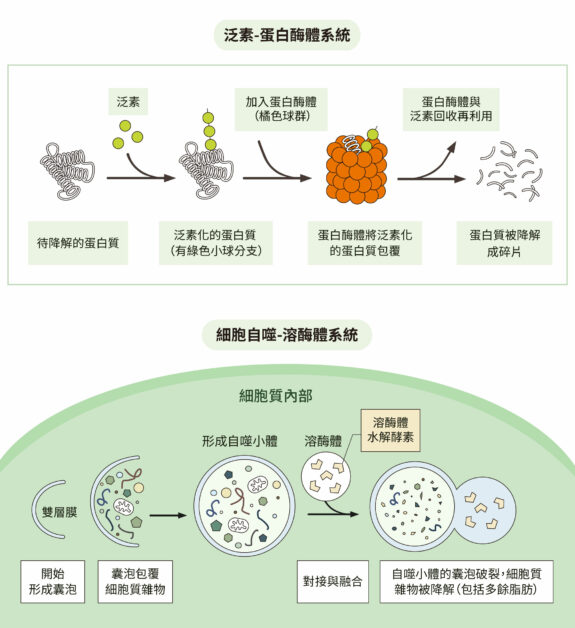
圖/研之有物(資料來源│陳瑞華)
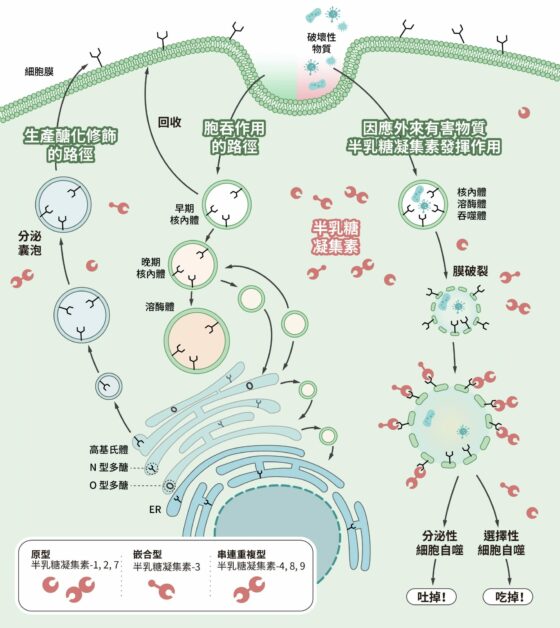
雖然 autophagy 的中文翻譯為「細胞自噬」,不過當細胞自噬啟動時,其實不是直接自我毀滅,而是在受到外在壓力時改善狀態、自我拯救。此一領域的先驅大隅良典(Yoshinori Ohsumi)在 2016 年獲得諾貝爾生理學或醫學獎。如今我們知道,細胞自噬可分為多種,可針對細胞內各種老舊廢物和有害物質進行分解,包含可溶及不可溶的蛋白質以及非蛋白質分子(例如後續會提到的脂肪)。
另一套細胞清運系統「泛素─蛋白酶體系統」處理的對象通常是可溶蛋白質。泛素會直接與目標結合做上記號,標記的目標會送往蛋白酶體分解。羅斯(Irwin Rose)、赫什科(Avram Hershko)、切哈諾沃(Aaron Ciechanover)藉此獲得 2004 年的諾貝爾化學獎。隨著研究愈來愈多,有些學者發現,兩套系統有時候會互相影響。
陳瑞華原本的研究對象是各種蛋白質修飾,而泛素化作用就是一種修飾蛋白質的方式,這使得她投入泛素的領域,開始探索蛋白質的分解與回收,也注意到泛素與細胞自噬有所聯繫的問題。道理其實不難想像:兩套系統的運作都涉及很多蛋白質,而這些蛋白質零件本身,也會成為需要分解或回收的對象。
泛素與細胞自噬的正向調控者「TRABID」
細胞自噬可分為很多種,陳瑞華關注的是依賴泛素的細胞自噬。一開始的切入點,是尋找促進細胞自噬的酵素。
把泛素加到目標蛋白質上頭的酵素叫作「泛素連接酶」(ubiquitin ligase),反之則是「去泛素酶」(deubiquitinating enzyme,簡稱 DUB)。人體有非常多種去泛素酶,測試 92 種之後,TRABID 最符合預期。增加這個酵素的作用能促進細胞自噬,可謂正向調控者。

泛素是由 76 個氨基酸組成的小型蛋白質,可以直接結合目標,也能互相串聯形成泛素鏈。
泛素的序列中,第 1 個氨基酸是甲硫氨酸(methionine,縮寫為 M),再來還有 7 個離胺酸(lysine,縮寫為 K),這些位點都能夠彼此修飾串聯,因此形成複雜的排列組合,這樣就賦予了泛素鏈多變的形式。
如果整串泛素鏈皆由同一種串聯組成,稱為同型鏈(homotypic chain)。根據泛素串聯的位置,可分為 M1、K6、K11、K27、K29、K33、K48、K63 共 8 種;而整串泛素鏈由不同種串聯組成的叫作異型鏈(heterotypic chain),又可以分為非支鏈型和支鏈型(branched)。
抑制泛素,促進細胞自噬
每種酵素都有專屬的催化對象。去泛素酶 TRABID 促進細胞自噬的專屬催化對象又是誰呢?
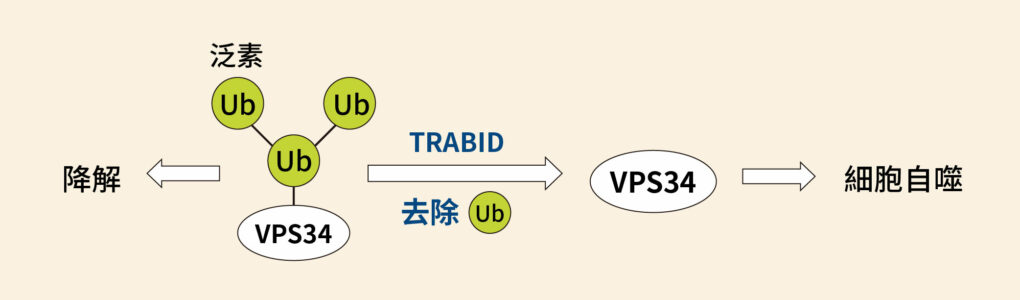
關鍵在於另一個酵素 VPS34,VPS34 是形成自噬小體的重要蛋白,全名為第三類磷脂肌醇 – 3 – 激酶複合體(class III PI3-kinase complex)。VPS34 會受到 K29、K48 泛素化修飾,令其遭到分解;而去泛素酶 TRABID 可以去除泛素,使 VPS34 不被分解。如此一來,激酶 VPS34 便可以促進細胞自噬的發生。
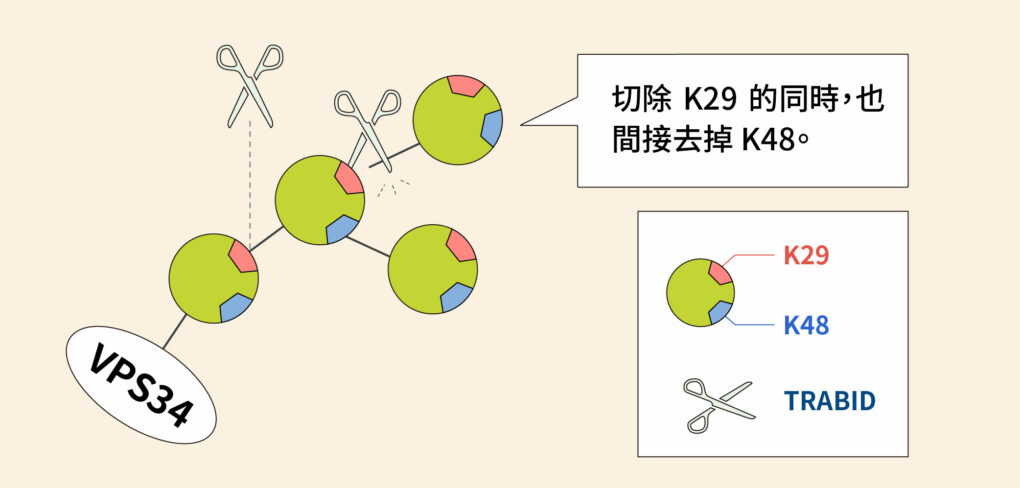
但這裡可看到一處蹊蹺:VPS34 受到 K29、K48 抑制,可是 TRABID 只能切到 K29,K48 應該不是它的處理範圍呀?合理的推論是:K29 和 K48 以異型鏈的形式一起作用,所以去泛素酶 TRABID 直接切除 K29 的同時,也間接切掉並不直接接觸的 K48。
泛素與細胞自噬的負向調控者「UBE3C」
細胞為了維持平衡,調控可謂一環扣著一環。既然存在針對激酶 VPS34 的去泛素酶,更早以前又是誰替 VPS34 加上泛素呢?過往研究發現,標記 K29、K48 的泛素連接酶叫作 UBE3C,而且是以支鏈連結。
調控基因表現可分為多個層次。基因會先轉錄為 mRNA,再轉譯為蛋白質;而泛素的調控屬於後轉譯修飾,也就是鎖定完工的蛋白質,卻不影響 mRNA 的階段。實驗結果指出,泛素連接酶 UBE3C 的作用一旦增強,激酶 VPS34 的 mRNA 表現量並不改變,但是蛋白質量下降,符合泛素該有的後轉譯調控方式。
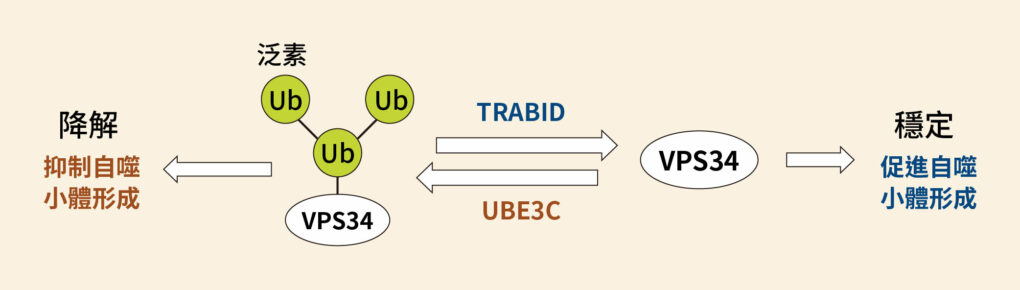
泛素連接酶 UBE3C 作用下會減少細胞自噬,可謂細胞自噬的負向調控者。但是問題又來了,如何證明 UBE3C 催化激酶 VPS34 進行 K29、K48 支鏈型泛素化?之前的研究方法僅能提供間接證據。
幸運的是,陳瑞華領導的這項研究還沒結束時,另一位專精泛素的學者發表一種新的分析方法,剛好可以回答上述問題。前面提過,泛素有很多種結合型式,理想的分析應該能區別支鏈型和非支鏈型泛素化,這就是「泛素剪裁法」(Ub-clipping)。
釐清泛素與泛素的連結──改造自口蹄疫病毒的分析工具
許多分子生物學的工具最初來自微生物,如限制酶(restriction enzyme)、PCR,以及當紅的 CRISPR 基因編輯,泛素剪裁法也不例外。
口蹄疫病毒(foot-and-mouth disease virus)感染細胞時,一如所有入侵者會受到抵抗;細胞利用 ISG15 蛋白質攻擊病毒,而病毒也會用蛋白酶(protease)反擊。有科學家注意到: ISG15 的形狀就像兩個泛素的合體,而口蹄疫病毒的蛋白酶專門針對這種結構。既然如此,這類蛋白酶是不是能用於切割連成一串的泛素呢?
上述構想後來成功,人為改造過的蛋白酶「Lbpro」,能精確地切割泛素與泛素之間的「RGG」氨基酸連結。被蛋白酶切完落單的泛素,上頭會連著兩個甘胺酸(glycine,縮寫為 G),假如本來是直鏈只會有 1 個 GG,原本為支鏈則會有 2 個 GG。
1 或 2 個 GG,這就造成重量上的落差。分子間這般的重量差異儘管很小,仍然足以被質譜儀分辨出來,這就是泛素剪裁法的威力。
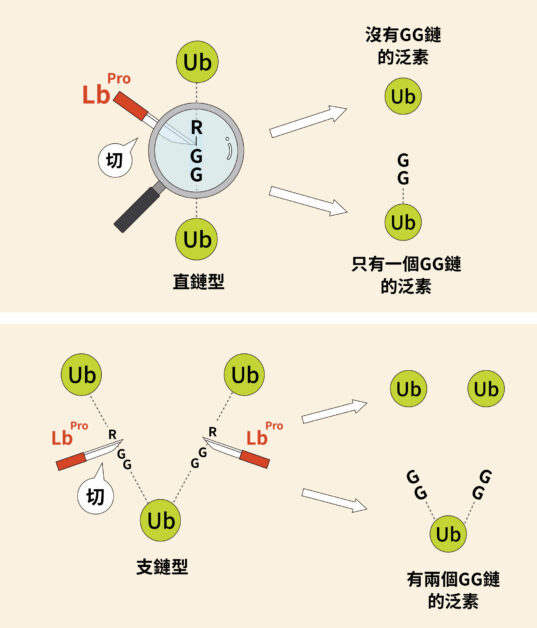
藉由新法助陣,陳瑞華團隊取得可靠的證據,看到泛素分支確實形成,證明泛素連接酶 UBE3C 確實將 K29 和 K48 以支鏈的形式標記到激酶 VPS34 之上。這也是泛素剪裁法,首度被用於細胞自噬的相關研究。
日常保持平衡,危局力挽狂瀾
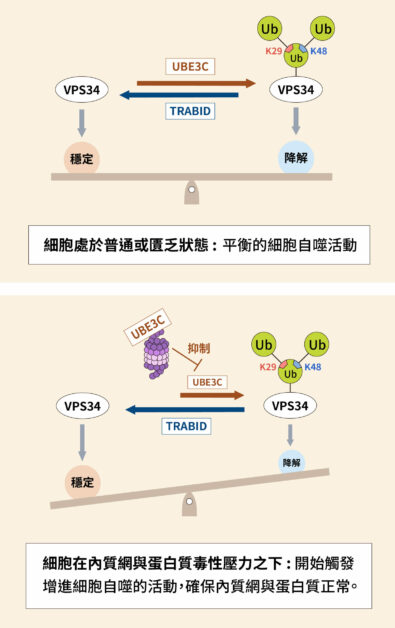
在瞭解泛素、VPS34、TRABID 與 UBE3C 之後,我們來梳理一下資訊吧。所謂開關、開關,有開就要有關。一系列實驗指出,是否啟動細胞自噬受到 3 個酵素影響:一旦泛素連接酶 UBE3C 加上支鏈修飾,令激酶 VPS34 被拖去摧毀,細胞自噬將受到阻止;若是去泛素酶 TRABID 發揮作用,令 VPS34 保持穩定,細胞自噬就會發生。
細胞處於普通或匱乏(starvation)狀態時,加泛素與去泛素的酵素,以互相對抗的態勢保持平衡。細胞面對危局時,原本的平衡遭到打破,細胞自噬成為一種自我救贖的手段。
陳瑞華團隊進一步實驗發現,內質網與蛋白質毒性壓力(ER and proteotoxic stresses)之下,泛素連接酶 UBE3C 會轉移位置到蛋白酶體;除掉拘束器(也就是UBE3C)之後,激酶 VPS34 便能促進細胞自噬發生,改善細胞狀態,提高生存機率。
未來有望應用到脂肪肝治療
細胞自噬是大部份細胞自我調整、保持平衡的重要手段,在某些特殊組織更扮演重要角色,例如肝細胞的代謝。過去研究發現,如果細胞自噬功能缺失,容易導致脂肪肝形成。
陳瑞華團隊使用小鼠作實驗動物,探討細胞自噬在非酒精性脂肪肝疾病(non-alcoholic fatty liver disease,簡稱 NAFLD)中的角色。在連續 12 週餵食高脂肪飲食後,享受高油脂大餐的快樂小鼠們體型明顯增大,對照組注入一般腺病毒,實驗組則注入帶有 TRABID 基因的腺病毒,繼續觀察 4 週。
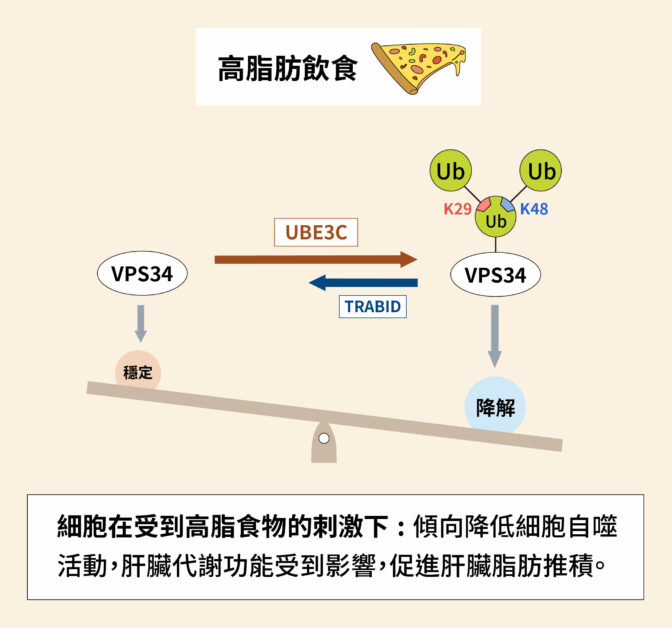
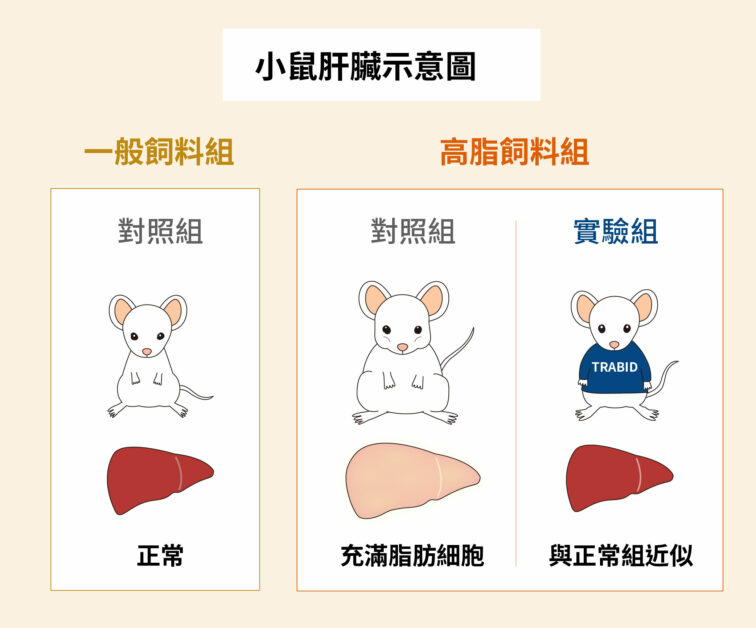
兩種不同處理之下,高脂餵食且注入一般腺病毒的對照組,肝臟細胞皆充滿脂肪,而且去泛素酶 TRABID 和激酶 VPS34 的表現量,以及細胞自噬的活性都明顯降低。而注射了 TRABID 基因的實驗組,因為人為促進了去泛素酶 TRABID 的表現,引發細胞自噬作用防止肝臟脂肪形成。
從實驗組的數據可以發現,小鼠多項脂肪相關的指標都有所降低,證實細胞自噬確實有阻止脂肪肝的作用,對肝臟代謝十分重要。這次的動物實驗是透過注射基因提升 TRABID 表現,如果未來能找到促進 TRABID 表現的藥物或關鍵小分子,則可望應用在非酒精性脂肪肝的治療或保健食品。
調控機制的平衡與不平衡
陳瑞華的研究成果讓我們對細胞自噬的調控又多一分認識。看起來好像很難,但是概念歸納起來並不複雜。調節細胞自噬的邏輯是一來一往的平衡(homeostasis),正向調控者作用,細胞自噬發生,反之亦然。
細胞自噬的基本機制,各種細胞多半是共通的;泛素在其中扮演阻止的角色,藉由控制泛素,便能有效影響細胞自噬。假如碰上逆境,需要促進細胞自噬時,抑制泛素即可達到目的。
在肝細胞中,細胞自噬有其特殊作用。假如細胞自噬的功能缺失,會影響脂肪代謝,長期下來可能導致脂肪肝病變;反之,若能在需要時能夠促進細胞自噬,未來脂肪肝治療就有新的契機。
延伸閱讀
- VPS34 K29/K48 branched ubiquitination governed by UBE3C and TRABID regulates autophagy, proteostasis and liver metabolism
- Insights into ubiquitin chain architecture using Ub-clipping
- Irreversible inactivation of ISG15 by a viral leader protease enables alternative infection detection strategies