呼吸是件稀鬆平常的事,但卻是最重要的生理反應,人可以一周不吃、不喝而不死,但只要短短幾分鐘不呼吸,你的生命就會快速的逝去。
人的呼吸是透過肺臟來達成,在新冠疫情爆發的當下,許多病患因肺部受損面臨著無法呼吸的窘境,這是多麼致命的事!而近期發表在 Med 期刊上的研究,提供了我們呼吸的新思路1——屁之呼吸。
呼吸作用,把美食變成能量代幣!
呼吸對生物非常重要,那為何生物需要呼吸呢?其實這與細胞進行的「呼吸作用」有關。
透過呼吸作用,細胞就可將食物分解,並將其轉換為可供細胞使用的能量代幣(三磷酸腺苷,也就是 ATP)。
這麼說起來看似非常簡單,但實際上呼吸作用非、常、複、雜!不是三言兩語可以講完(被生物化學荼毒過的各位夥伴,一起發出怒吼吧!)有機會再專門給大家講解。

這邊我們只需要知道:呼吸作用的主要功能就是「產生能量」,而其中需要氧氣,最終產生廢棄物如二氧化碳。簡單來說,這是一種「氣體交換」的過程,提供氧氣給細胞進行呼吸作用的同時,也將呼吸作用產生二氧化碳給排出。
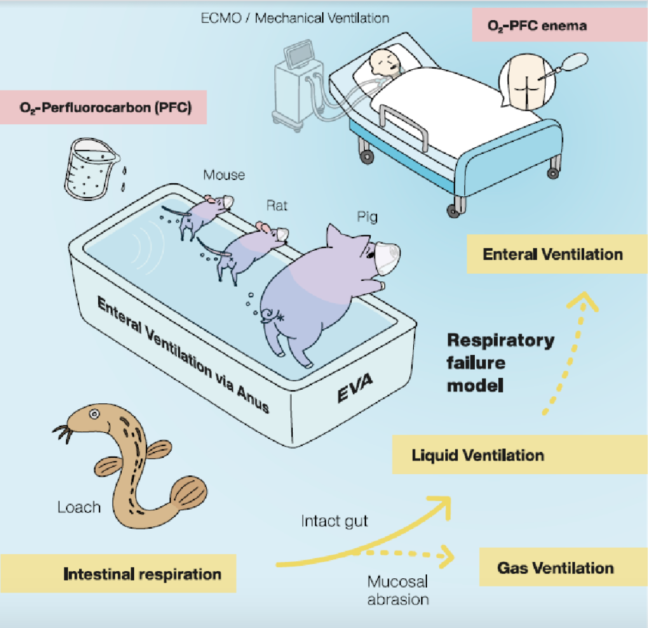
天哪!牠們竟然可以用直腸來呼吸!
不同的生物有不同的呼吸方法,微生物和一些構造簡單的生物(如水母),可靠擴散作用讓細胞直接進行氣體交換,而大型且構造複雜的生物,就需要由「呼吸系統」承接氣體交換的重任。
以脊椎動物為例,脊椎動物需仰賴紅血球將氧氣提供給全身各個部位,同時將二氧化碳帶走,而紅血球則在呼吸系統中進行氣體交換。
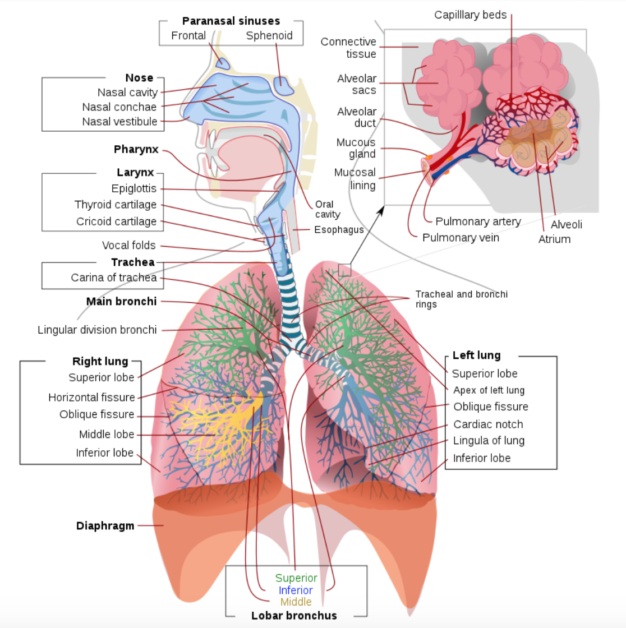
其中,人類是透過「嘴巴、鼻子」將空氣吸入氣管、支氣管、肺部再到肺泡,讓紅血球在肺泡中進行氣體交換,接著再把空氣沿著反方向被鼻子和嘴巴呼出體外,達成我們最熟悉的呼吸模式。
提到海裡的生物們,大家應該都能夠很快的說出,魚類是靠「鰓」來進行呼吸,但你能想像嗎?有的水生生物竟然會用「腸子」來呼吸!
聽起來很匪夷所思吧,但其實早在 1950、60 年代,科學家們就發現一些水生動物如海參跟泥鰍,在缺氧的環境中能靠「腸呼吸」的方式來增進氣體交換的效率。因為它們的腸上皮細胞和人的肺泡一樣,細胞較薄且佈滿微血管,非常利於紅血球進行氣體交換。

當科學家們發現泥鰍的腸呼吸後,就非常好奇:
哺乳動物的直腸上皮細胞也很薄、也佈滿微血管,既然泥鰍可以,那麼哺乳動物是否也能進行腸呼吸呢?
因此,科學家們很早就興致勃勃地開始對此進行研究,可惜當時的研究並沒有給出明確的答案,此後這一直是不少科學家爭論的話題。
近期,一個日、美聯合的研究團隊,重新開始針對這個問題深入研究,並提出了更清楚的答案1。
把氧氣直接灌入小鼠屁屁吧!
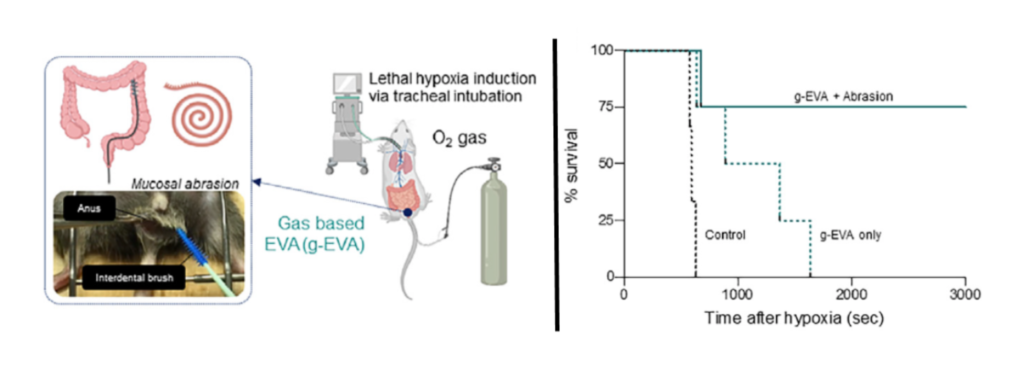
研究團隊首先設計一個腸道氣體通氣系統 (Enteral ventilation Via Anus , EVA),而 EVA 系統可以輸入純氧到小鼠的直腸。
首先,研究團隊比較了一般小鼠和 EVA 系統小鼠在極低氧條件下的表現:正常小鼠只能存活 11 分鐘,而使用 EVA 系統的小鼠的存活時間也不長,比起一般小鼠僅有增加一點點,延長到了 18 分鐘。
不樂觀的初步結果並沒有擊倒研究團隊,研究團隊進一步實驗發現,當切除小鼠直腸細胞的黏膜層之後,就可以增加氣體在直腸內的通透性,讓腸呼吸的效果更好。最終數據也顯示,切除直腸黏膜層、使用 EVA 系統的小鼠,在極低氧的條件下存活時間可以上升到 50 分鐘!
由此可知,小鼠確實能透過腸呼吸來克服缺氧環境。
進化!I-EVA 系統將含氧液體輸入直腸
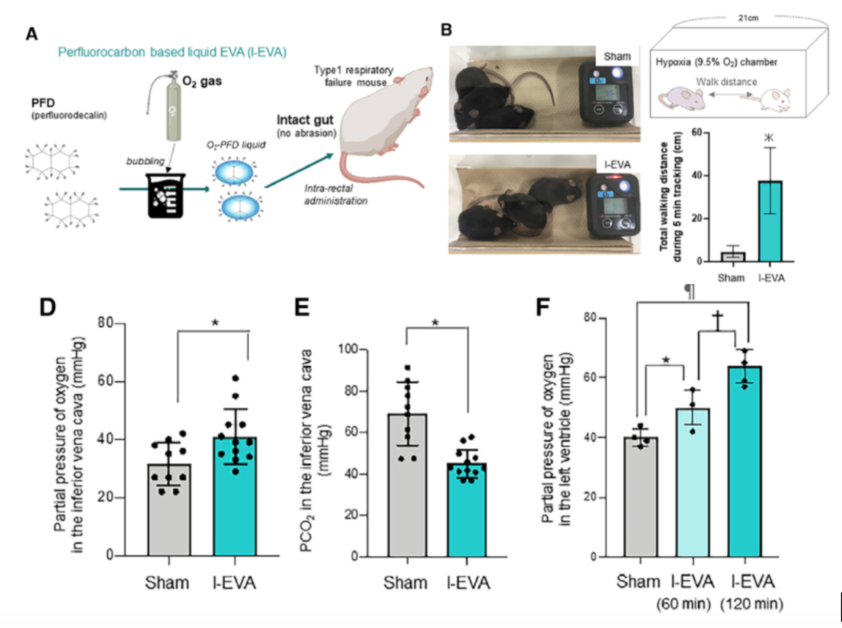
雖然這個結果證實了小鼠確實能進行腸呼吸,但鑒於 EVA 必須切除直腸的黏膜層才可以有效,這顯然不適合人類使用。因此研究團隊決定改變策略,將高含氧的「液體」直接灌入直腸內。
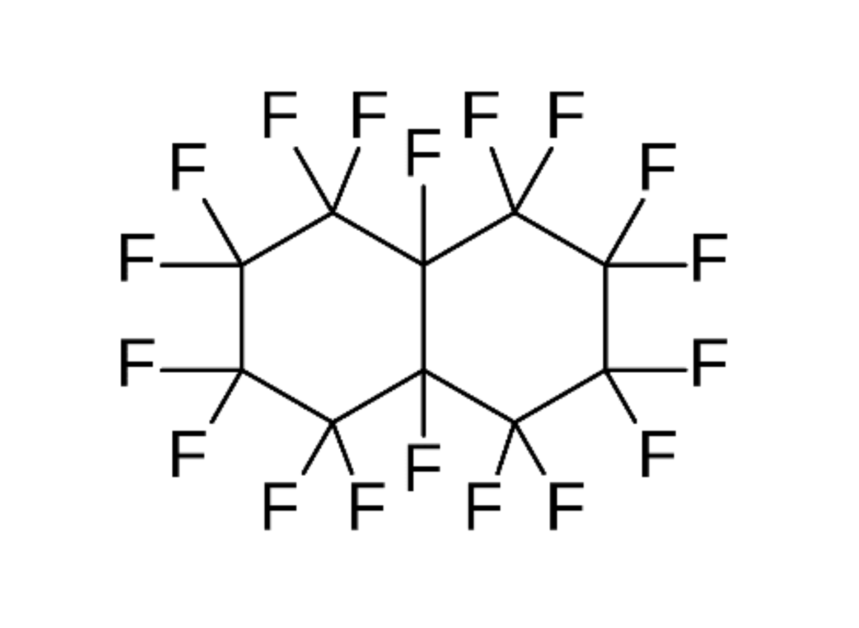
研究團隊選中全氟萘烷這個氟碳化合物,全氟萘烷是一種惰性液體,常溫下幾乎不會和人體反應且非常穩定,而且全氟萘烷有著極高的溶氧量,正常情況下每 100 mL 的全氟萘烷能溶解 49 mL 的氧氣,在醫療上不僅可做為液體氧氣使用,臨床上也證實將全氟萘烷灌入呼吸衰竭的病患肺部內,能有效緩解病患氧氣不足的問題2。
研究團隊把這種使用充氧全氟萘烷的腸道通氣系統稱為 I-EVA (liquid-based Enteral ventilation Via Anus)。和沒有使用 I-EVA 的小鼠相比,使用 I-EVA 的小鼠在低氧氣室中(含氧量 9.5%)走得更遠,並且有更多的氧氣到達它們的心臟。
大鼠與豬:血液含氧量上升、少副作用
I-EVA 在大鼠與豬的實驗中也得到不錯的結果:
- 大鼠和小鼠一樣,使用 I-EVA 後,大鼠能在缺氧環境中行走更遠的距離。
- 豬在缺氧環境下,皮膚會呈現蒼白無血色的冰冷狀態,但使用 I-EVA 後,豬的皮膚就變得溫暖且充滿血色,和豬在正常氧的情況下很接近。
另外,不論大鼠還是豬,在缺氧環境下使用 I-EVA,其血液內的含氧量皆有明顯上升;測試 I-EVA 的在大鼠和豬身上的生理影響後,數據也顯示 I-EVA 幾乎不會產生甚麼副作用!

綜合以上的結果,顯示 I-EVA 確實能緩解哺乳動物的缺氧問題,也證實了哺乳動物確實也能進行「腸呼吸」!
人類也能用屁屁進行腸呼吸嗎?
既然小鼠、大鼠到豬都能進行腸呼吸,那人類可以嗎?答案是:不確定。
雖然從上述的結果來看,理論上人類應該也能使用 I-EVA 系統進行腸呼吸,但這需要更多的實驗與測試。對此,研究團隊非常樂觀,也表示已經開始著手臨床試驗的相關準備了。
雖然知道人類也可能進行「腸呼吸」、從屁股灌入含氧液體讓人印象深刻,但這項研究真正的重要性在於提供氣體交換的新方法。
近期新冠疫情的爆發,讓許多病患的肺部受到嚴重的損害,而肺部的損傷會降低紅血球在肺部氣體交換的效率,這時即便使用呼吸治療器也未必能讓病患的紅血球獲得充分的氣體交換。因此,面對肺功能受損的病患,腸呼吸也許有可能成為不錯的替代方案。
那些人類進行「腸呼吸」前的二三事
真要施行起來,恐怕還是有不少問題要克服。

首先,既然是將全氟萘烷灌入直腸內,那是否需要先將病患的腸子洗乾淨呢?再來要用腸替代肺呼吸,那勢必要持續灌入全氟萘烷,腸子能承受住液體這樣持續的灌入嗎?最後是腸道功能的問題,腸畢竟不是拿來呼吸的器官,而是吸收營養與排便的,讓腸替代肺作為呼吸器官,勢必會影響腸的正常功能。
上述這些問題,在正式施行腸呼吸前,都要審慎思考。
雖然仍有不少問題有待解決,但腸呼吸作為肺功能衰竭病患的替代方案仍有著不錯的吸引力,就讓我們期待未來「腸呼吸」這種詭異的方式是否也能應用在人類身上吧!




































