大腦,是人類一大招牌特色。人類所屬的 Homo 曾經有過許多物種,最早的 Homo 誕生超過 200 萬年。新研究卻發現我們的額葉,要等到距今 170 萬年過後才形成。[1, 2, 3, 4]

人類簡史
人類的演化並非一步到位,而是延續數百萬年的漫長過程。已知紀錄中,最早的 Homo 化石距今 280 萬年,出土於東非;但是 200 到 280 萬年前這段期間,化石非常稀少。到了 200 萬年前左右,有巧人(Homo habilis)、魯道夫人(Homo rudolfensis)、直立人(Homo erectus),至少 3 種近親共存。
非洲以外最早的 Homo 化石,出土於亞洲西南部的喬治亞 Dmanisi 遺址,距今大約 177 萬年,一般認為是直立人,或是類似直立人的型號。但是更早以前,也許已經有其他人離開非洲。例如黃土高原便出土過距今 210 萬年的石器。
至於亞洲東部的直立人和其他古人類,像是北方的藍田人、北京人,南方的爪哇人、佛洛勒斯人(Homo floresiensis),都是距今 170 萬年以內的事了。一百多萬年來眾多 Homo 們之間複雜的交流、繼承、遷徙、取代、合體關係,曖昧難解。
現代化額葉是什麼時候轉型的?
大腦的改變,是人類演化史上非常關鍵的部分。但是頭殼是硬的,有機會形成化石;大腦軟軟的,幾乎不可能變成化石保存,又該怎麼研究呢?
幸好有些時候,大腦的形狀會印在頭殼上,就像軟體動物的印痕化石。這類樣本雖然稀罕,總是比沒有好,能夠提供極為寶貴的線索。
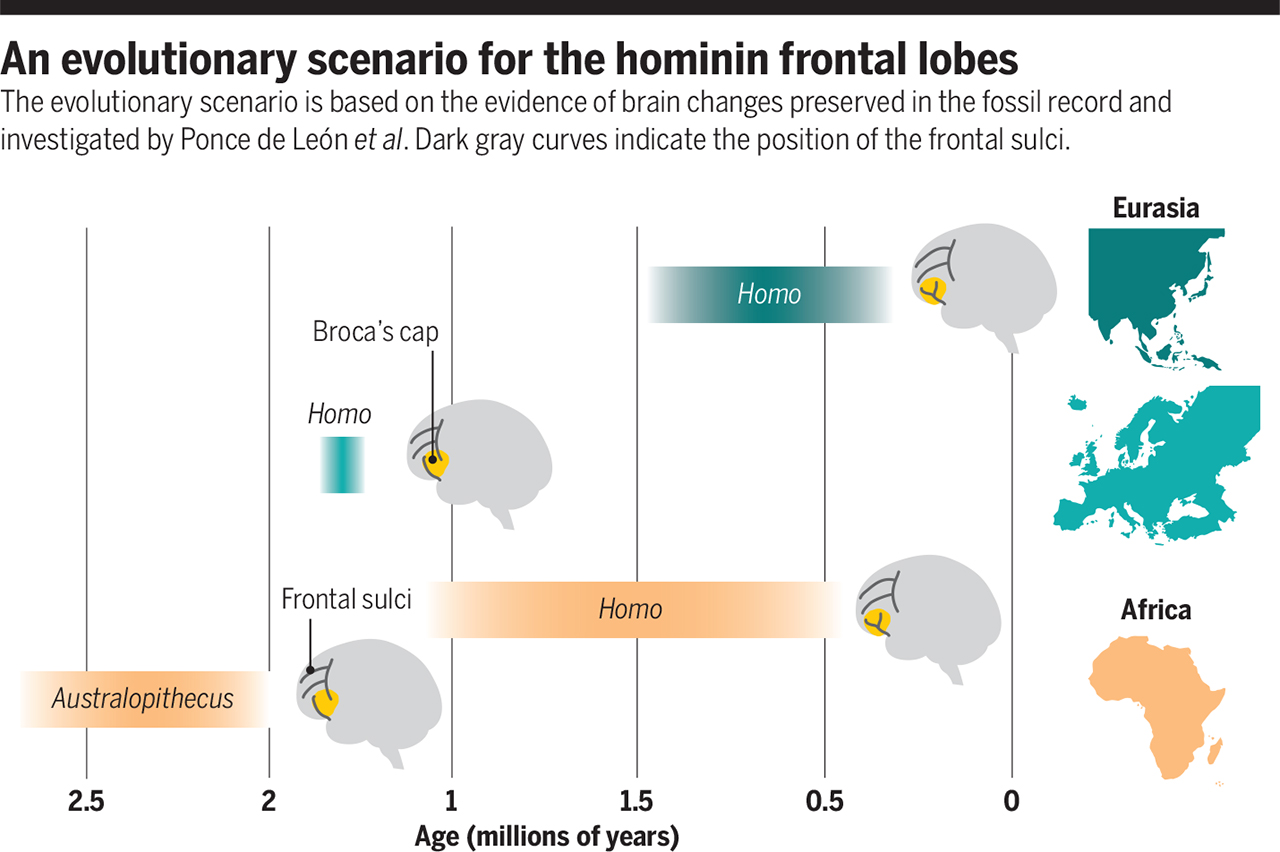
新研究比較不同地點、年代的古早頭殼,分析大腦組織的方式,特別是額葉(frontal lobe)。
額葉與認知、語言等功能有關,裡頭的布羅卡區(Broca’s area)對語言至關重要,可謂人之所以為人的一項基礎。
大腦是個很棒的東西,但是早期 Homo 的大腦不一樣
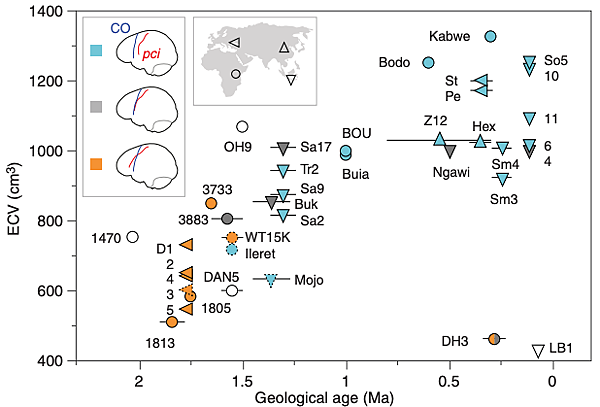
分析對象不只各色 Homo,也包括更資深的南猿。南猿超過 400 萬年前誕生,衍生出許多物種,一直到 200 萬年前全部滅團。Homo 當初應該就是由某群南猿改版而來,和其餘南猿共存了相當一段時間。
比較結果是:南猿的額葉和黑猩猩相似;而且連末代南猿,198 萬年前住在南非的泉源南猿(Australopithecus sediba)也不例外。上述結果並不意外,畢竟南猿的身體構造、體型、腦容量等特徵,和黑猩猩相去不遠。
那麼 Homo 呢?距今 200 到 280 萬年前期間欠缺樣本;約 200 萬年前的巧人,和南猿差別仍然有限;
值得玩味的是,已經離開非洲,喬治亞 177 萬年前的直立人,額葉組成竟然也還沒什麼改變!
之後大家都有了升級改版的額葉
要一直到距今 150 萬年前之後,才有明顯的轉變。在此之後,不論非洲的直立人、亞洲的直立人,或不太像是直立人的任何其他人,額葉組成都更接近我們。
此一階段另一顯眼的變化是,各地古人類的腦容量都變得更大。由此看來,額葉改版似乎和腦容量增大的趨勢一致。但是距今不是太久的 2 種小腦袋古人類:南非的納萊迪人(Homo naledi)、東南亞外海島上的佛洛勒斯人,卻可能也配備現代版額葉。
距今 20 多萬年的納萊迪人,以及數萬年前的佛洛勒斯人,某些形態特徵相當原始,生存年代卻相對晚近,因此難以判斷與其他人的關係,也不清楚他們的額葉在何時發生轉變。不過應該能夠判斷:腦容量和額葉組織的關係,並非完全一致。
另一點較為肯定的是,
距今 280 萬年前 Homo 首度誕生的時刻,額葉尚未改版,甚至到了一百萬年後,最早離開非洲的直立人也還沒有。額葉重組似乎發生在距今 150 到 170 萬年前,普及化是 150 萬年以後的事。

額葉組織再造,才能製作更複雜的石器?
不可忽略,額葉改變的年代,和石器技術發生轉型,更複雜的阿舍利(Acheulian)誕生的時期一致。
至今知道最原始的石器,拉米關(Lomekwian)出現於東非的肯亞,距今 330 萬年,不過僅限一時一地。超過 258 萬年前誕生的奧都萬(Oldowan),一直延續使用到幾萬年前。相比之下,176 萬年前首度於東非現蹤的阿舍利,手藝更為複雜。
從簡單的奧都萬到複雜的阿舍利,經過不短的 80 萬年,原因眾說紛紜。近來有研究指出,製作奧都萬或阿舍利時大腦的狀態不一樣,生產阿舍利時有更多腦區活躍(狀態和彈鋼琴意外類似)。
另一研究則認為,必需具備相當的溝通能力,才能傳承阿舍利的技藝。綜合來說,就是
需要更進階的認知與溝通能力,才能順利發展出阿舍利風格的石器。
- 延伸閱讀:短篇 會溝通才能成為高級工具人

最早的阿舍利出土於 176 萬年前,周圍沒有化石,不清楚工具人是何許人也。不過可以確定在阿舍利尚未發明以前,直立人已經離開非洲,而喬治亞直立人,以及之後亞洲東部的直立人,都沒有生產過阿舍利。
然而,假如說額葉改版,導致石器轉型,繼續追究下去就會面臨一個矛盾。原始版額葉的人,確實都只能做出簡單的奧都萬;但是升級版額葉的人,不見得就會生產阿舍利,仍有像東南亞的直立人-爪哇人那般,滿足於奧都萬。
論文推論是,較早的喬治亞直立人,和較晚的亞洲直立人之間沒有繼承關係;爪哇人這類亞洲直立人,是祖先在非洲升級完額葉以後,才再度離開非洲的移民後裔。如果論文的推論正確,他們配備改版過的腦袋,卻不會使用升級後的石器,將是個有趣的問題。
大腦是個很棒的東西,我希望每個人都有一個。
延伸閱讀
- 人類對自身起源的百年追尋
- 非洲200萬年前的人種多樣性:巧人、魯道夫人、直立人
- 200萬年前最早的直立人,有泉源南猿和粗壯傍人鄰居
- 至少 210 萬年前,已經有「人」移民東亞
- 短篇 誕生於176萬年前的阿舍利石器
- 大腦地圖的起點:發現「布羅卡區」 │ 科學史上的今天:4/17
- 曾是智人祖先的鄰居?納萊迪人新發現
- 哈比人的奇幻漂流 佛洛勒斯島洞窟裡的大謎團
- 莫維斯線與竹子假說:東方真的比較落後嗎?
參考資料
- de León, M. S. P., Bienvenu, T., Marom, A., Engel, S., Tafforeau, P., Warren, J. L. A., … & Zollikofer, C. P. (2021). The primitive brain of early Homo. Science, 372(6538), 165-171.
- The enigmatic origins of the human brain
- Modern human brain originated in Africa around 1.7 million years ago
- Our earliest ancestors weren’t as brainy as we thought, fossil skulls suggest
本文亦刊載於作者部落格《盲眼的尼安德塔石匠》暨其 facebook 同名專頁。