本文轉載自顯微觀點
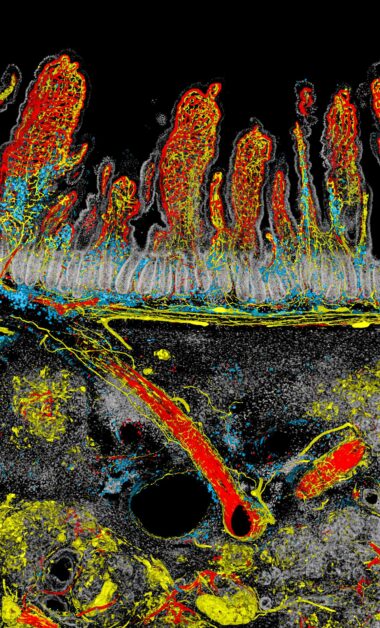
畫面中以腫瘤與腸道的交界處作為分割,上方為十二指腸的腸絨毛血管和神經網絡,下方則是侵襲的胰臟癌腫瘤,呈現出生命與疾病在邊界對峙的氛圍
連2024台灣顯微攝影競賽 評審都忍不住讚嘆:「影像具有魄力與情緒渲染力,讓人直觀感受到人體對抗癌症的不適和緊張。」
這幅「劍拔弩張」的影像由中研院基因體中心的博士後研究員簡宏任所拍攝。他目前的研究主題之一為探討胰臟癌的漸進發病過程中,出現的病變(lesion)和微環境變化。
他提到拍攝這張影像契機是當時正在做腫瘤轉移的試驗,正巧收到這個小鼠胰臟樣本。
「那隻老鼠的胰臟腫瘤剛好長在十二指腸的旁邊」,簡宏任表示,胰臟有很多神經,而胰臟癌特別之處在於腫瘤長大後,神經也會跟著長進去。
「但腫瘤中的神經從哪裡來?是從胰臟裡面自己長進去,還是從旁邊的器官?以概念上來說,你各自的器官神經理論上應該不會交錯吧!」但過去很少有人做過這樣的觀察和研究,而透過顯微鏡的觀察,發現神經從十二指腸的肌肉層,沿著血管長到胰臟腫瘤裡面。
「下面這是腫瘤範圍,神經會長進去耶!這還滿神奇的」,簡宏任一邊對著影像比劃,一邊興奮地分享研究發現。
胰臟癌很難治療的原因之一是腫瘤中沒有或是很少具有免疫細胞浸潤,即無免疫源性的腫瘤-「冷」腫瘤。但從影像中看到標記成藍色的免疫細胞順著血管和神經的網路進到腫瘤生長區域。「可見免疫細胞其實是可以進去的,但是為何這些免疫細胞無法發揮殺死癌細胞的作用或是僅駐留在腫瘤中的局部位置」,簡宏任坦言目前還沒有答案。
雖然對於免疫細胞和癌症之間的作用尚無明確解答,但影像的呈現仍然多少解開過去對於神經、血管和腫瘤之間如何交錯的疑惑。簡宏任表示,這都得歸功於3D組織學技術的發展。
器官很大病變很小 從2D走向3D找目標
胰臟癌又稱為「癌王」,因為癌症初期病人沒有任何不適,加上胰臟在腹腔深處,難以用超音波早期發現癌症病變,等到壓迫到其他器官出現腹痛、胃口差等症狀,腫瘤都已長得很大或是出現轉移,惡化速度快。
簡宏任研究的一部分就是觀察癌前病變的病理樣態。
胰臟很重要的功能分為內分泌和外分泌。內分泌為分泌胰島素調解血糖,外分泌則是分泌胰液含有多種消化酵素,進行醣類、蛋白質、和脂肪的消化作用。
簡宏任表示,胰臟腺泡細胞分泌的消化液需要透過導管結構送到消化系統,而研究發現這種導管結構可能會出現癌前病變,這些病變稱為胰臟上皮內瘤樣病變(pancreatic intraepithelial neoplasia, PanIN)。而PanIN也可能會由胰腺泡到導管化生(acinar-to-ductal metaplasia, ADM)發展而來。病變的進展是多重步驟的過程,除了病變細胞本身基因層面的改變之外,外在的微環境也會影響這些PanIN的發育。
因為胰臟組織裡細胞種類眾多,不同種類細胞的組成可能塑造出適合病變成長的環境;雖然這些病變並不一定最後都會走向癌症。而他所待的胡春美老師研究室,就在關注病變過程微環境的變化。
另一方面,胰臟癌難以早期發現,通常是轉移到肝臟,發現肝臟腫瘤後才回頭找出胰臟腫瘤。而發生遠端轉移之前,從原位胰臟腫瘤脫離的細胞團可能在血液中循環,這些細胞團被稱為循環腫瘤細胞簇(Circulating tumor microemboli, CTM)。
簡宏任另一部分的研究重心便是放在這些循環腫瘤細胞簇的特徵及其是否有喜歡的微環境,藉以找出可能的轉移熱點,以更好地了解癌症轉移並尋找治療的契機。
然而微環境「長成什麼樣子」,難以用一般分子生物的技術觀察,必須整合病理學的技術來「看見」其真實的樣態。
「但問題又來了,要怎麼找到這些小小的、開始發生病變的位置?」簡宏任說,在模式小鼠中,胰臟病變的平均直徑僅約100至200微米(µm,micrometer),以老鼠胰臟2公分乘以1.5公分的面積、厚度0.5公分來看,一個病變保守估計可能只佔胰臟體積的十萬分之一到百萬分之一。
過去受限於常規組織學技術的切片方法,研究者只能製備厚度3到5微米左右的樣本,以觀察組織薄片上二維(2D)空間的訊息。而且切片過程不僅得破壞樣本,對於無法明確知道起始位置、難以定位的目標來說,也無法準確擷取到想要的影像。
但是組織透明化技術允許研究者在不切片或是增加切片厚度的方式下製備出「厚」樣本,如此一來樣本就能保有立體的三維(3D)空間訊息。使用3D組織學技術便可以看到整體結構,再去找尋「不一樣」、「可能是病變」的部位加以觀察、分析。
簡宏任表示,3D組織學技術對於觀察隨機分布或是網狀、網路性質的結構特別有利。
組織透明化技術
使用光學系統觀察生物組織時,常會面臨因為光散色(light scatter )的問題,觀察深層樣本時會因為難以對焦而模糊。就算使用連續薄切片再3D重建,不僅耗時費力也常發生影像對位不易或是資訊不連續的問題。組織透明化技術則是將組織內部不同構成物質的折射率趨近一致化,將組織呈現出透明的效果。
不過3D組織學技術並不是這麼簡單,其中組織透明化是十分關鍵的步驟。2010年代初期第一代透明化技術出世後,應用這項技術的研究開始變得熱門,但主要都是以大腦為研究主體並加以改良。然而像是胰臟或是其他器官,當時應用此技術的研究較少且製備高品質樣本的過程充滿挑戰。
簡宏任提到,以胰臟為例,製備透明胰臟樣本的難處在於,作為消化器官的胰臟本身會分泌消化液。當實驗進行,老鼠一犧牲,血液停止循環時,那些消化液就「停留在原地,開始消化牠自己」。一旦前置處理不理想,看到有點缺損的器官就無法判定是已經發生病變,還是被消化液破壞,影響後續的影像品質。
除了胰臟外,肝臟也是不易製備出透明化樣本的器官之一。因肝臟受到膽紅素(Bilirubin)影響而有顏色,這些色素一方面會阻擋雷射激發組織內的標定結構,也會限制激發出的螢光訊號回到偵測器。如何漂白可以達到透明化效果又不會去除掉標定的抗原,便成為一大學問。因此,透明化技術必須對應不同器官建立合適的前處理流程以提升樣本品質。
前處理之外,折射率也是需要考量的因素,簡宏任碩博班期間的指導教授湯學成提出將組織「固化」的想法。
「90%以上的透明化技術最後都處在溶劑中漂浮的狀態,雖然可以從四面八方觀察,但折射率固態大於液態,液態大於氣態。若能把折射率提升,透明度更好便能看到更多資訊」,湯學成教授的團隊反覆試驗後研發出可同時將生物樣本透明化與固化的技術。
由於光在不同介質中的因不同折射率導致光的散射。他們依據流體折射率與密度之間所滿足的Gladstone-Dale關係式,以高折射率的高n丙烯醯胺共聚物(high-n acrylamide-based copolymer)來填充組織的空隙,使折射率一致,達到透明化目的。
再進一步用紫外光(UV)照射成為固態高密度共聚物,提高折射率並成為穩定的透明樣本。
這樣的透明化技術相較過去,不僅克服組織放在溶劑裡攜帶不易、蒸發等問題,在實驗過程中也發現固體透明組織具有抗螢光淬滅(antifade)的特性。
由於使用共軛焦顯微鏡觀測時,需要使用雷射激發抗體螢光,如果照射多次可能因為螢光強度衰減而漸漸觀測不到訊號。
但是湯學成教授團隊所開發的固態透明化技術,儘管進行500次雷射掃描,螢光訊號僅下降9% ± 2%;相比其他液態透明化技術的樣本下降幅度在55%至95%,可說是非常穩定,適合長時間、多次成像。
「當別人對研究存疑時,以往只能就影片或是拍好的圖片討論,但有了這個材料,就可以將樣本直接寄給對方」,除了上述的優勢,簡宏任認為新材料還能促進學術交流。
簡宏任介紹固態透明化技術,攝影/林任遠
點滿技能樹 喜獲銀獎
不過,組織透明化後雖能更加輕易找到病變位置,但拍攝「有拍照」跟「拍好照」是天差地遠的事。
「既然已經花了那麼多的精力、資源,做了這麼好的片子(樣本),那你要怎麼吸引『觀眾』(論文審查者、同儕),讓人家覺得研究、看到的東西,有那麼重要?」簡宏任認為安排顏色對比、構圖,以突顯影像中的重點是非常關鍵的。
以「對峙」這幅作品來看,簡宏任解釋,他通常將畫面面積最大的部分以白或灰等顏色處理,因此佔據畫面最大的腸道細胞以白色呈現並降低對比。至於神經與血管是他想強調的部分,便用較亮的紅、黃等色系,尤其大部分的人直覺認為血管是紅色,因此血管套上紅色,神經便給予黃色標示。免疫細胞則選擇藍色,在紅、黃色當中得以突顯,也避免以為是組織間交疊出的疊加色。紅、黃與藍的選色也應用了消減型的三原色(subtractive mixing color model)的概念,以不交疊的原色(primary color)凸顯不同結構的特色。
對於顏色、構圖呈現的敏銳度,也源自簡宏任過去的學經歷。簡宏任並非一開始就走上研究之路。國中畢業後選擇高職就讀的他,選修科目的平面設計與視覺藝術奠定了他美學的基礎;但在學術學程的課程中,他也發現自己對生物也挺感興趣,因此大學選擇分子生物暨人類遺傳學系就讀。
只是相較於「看不見」的分子生物,簡宏任更喜歡「看得見」的生物(顯微)影像。投身固態組織透明化技術的研究後,當中有些需要用到紫外光等儀器設備,也因為簡宏任高職時曾參加微控制相關的社團,喜歡動手操作,因此可以自己架設一些小型機台。
簡宏任笑說:「這次得獎算是把過去學的技能串在一起,技能樹剛好都點滿。」不過他也謙稱,得獎是運氣,在作品展看到其他人的作品時,可以看到不同技術在製備上也都有其厲害之處;銀獎抑或優選還是看評審的選擇,只能把自己最好的部分拿出來展現。
簡宏任介紹固化系統。攝影/楊雅棠
固化過程若是讓液態慢慢凝固,一方面時間漫長,另一方面容易出現不均勻的問題。因此簡宏任索性運用過去社團習得的技術,自行動手製作「固化系統」。從選擇適合波長的紫外線光源和照射時間,以避免蛋白質變性或是氣泡跑進透明化樣本,到組裝焊接,簡宏任全都自己來。