本文由行政院環境保護署毒物及化學物質局之推動化學物質綠色生活知識教育平臺計畫企劃,泛科學執行
- 文/楊朝源
說起元素週期表,大概是每位學生們念書時,最怕遇到的惡夢之一吧。從氫鋰鈉鉀銣銫鍅,一路背到氦氖氬氪氙氡,除了元素常常名字看不懂,整個元素週期表的形狀還非常奇怪,讓記憶難度提高。生吞活剝背完中文後,還有元素符號、原子序、等大魔王在後面摩拳擦掌,根本讓人背到懷疑人生。

雖然元素週期表很可怕,但你可知道今年,也就是西元 2019 年,正是元素週期表誕生的第 150 年,被聯合國設為國際化學元素週期表年!在這大喜之年,就讓我們放下以前的恩恩怨怨(?)了解一下元素週期表這 150 年來經歷的風風雨雨吧。
誕生於俄國科學家之手,北境永不遺忘
元素(elements),也就是組成物質的基本單位,自古以來每個文明都有各自的敘述與想像來說明,例如古代中國的五行說(金木水火土),古希臘的四大元素(水火氣土)等等。從這些學問中,不難想像古人對於物質的好奇。然而究竟是什麼東西構成了我們的世界?在近代科學中,法國科學家拉瓦節(Antoine-Laurent de Lavoisier)跨出了第一步。
十八世紀末,被後世譽為「現代化學之父」的拉瓦節發起了一場革命,給予世人對於元素的新理解,而後十九世紀初有了英國科學家道爾吞(John Dalton)的原子說,原子量成為分辨元素時的一大利器。在這之後,各個元素開始陸陸續續地被發現,但是面對越來越多的元素種類,學者們試過各式各樣的排列方式,卻沒有一個令大家都信服的結果,來為這些元素分類與排序。

就在所有科學家都摸不著頭緒的時候,俄國科學家門德列夫 (Dmitri Ivanovich Mendeleev)於 1869 年提出了他的元素週期表。
他將化學相似的元素分為七個家族(當時尚未發現第八族元素),按照原子量的大小進行排列,並且預測了四個元素的存在。然而,門德列夫的元素週期表並沒有在發表時就一炮而紅,讓人們高喊元素週期表元年到來,而是成為眾多元素週期表中的其中一個,競爭正確答案的寶座。
之後過了六年,也就是 1875 年,法國科學家布瓦伯德朗(Paul Émile Lecoq de Boisbaudran)從鋅礦中提煉出了一種新的元素,被命名為鎵(Ga)。
這個發現的驚人之處不僅僅是因為發現了新的元素,更因為鎵的原子量、化學性質以及比重等等特性,都與門德列夫的「類鋁」預測幾乎一致,這樣精準的預測結果讓世人開始注意到門德列夫的元素週期表。
接著科學家陸陸續續在 1879 年發現了鈧(Sc),1886 年發現了鍺(Ge),更是讓世人對門德列夫的想法更加信服。因為他的洞見,150 年後,我們仍然敬佩這位俄國的科學家,他的貢獻將不會被世界所遺忘。

瞭解原子,揭開元素週期表的規則
剛剛說到,元素週期表是為了讓科學家將元素排序所產生的,因此元素週期表的背後必然有一定規則存在,才能使各式各樣的元素按照規律排列。而這些背後的祕密,卻是在門德列夫的元素週期表問世以後,才一點點的被揭開。
西元 1897 年,英國化學家湯姆森(Joseph Thomson)透過陰極射線發現電子,這個發現打破長期以來科學界認為原子不可分割的理論。在 1913 與 1932 年,拉塞福(Ernest Rutherford)和查兌克(James Chadwick)分別發現了質子與中子,對於原子構造的認識終於有了初步的進展。而帶有負電的電子、帶正電的質子與不帶電的中子,正是瞭解元素週期表規則的起點。
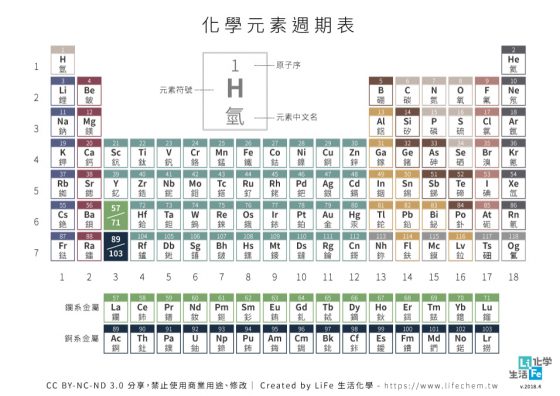
電子、質子和中子組成了原子,其中質子的數量代表了原子序,也就是上圖中元素左上的數字,因此從只有一個質子的氫為首,開始由左向右讀,元素的順序便是一氫二氦三鋰四鈹……,直到目前編號最後一個元素,也就是編號 118 的 Og,擁有 118 個質子。(編按:編號 117 的元素 Ts(石田)以及編號 118 的元素 Og(气奧)為新造字,多數電腦系統尚無法顯示這兩個字元,所以後面提到這兩個元素時一律以英文元素符號表示。)
為了保持原子的電中性,帶負電的電子必須要和帶正電的質子是相同的數量。電子在原子核週圍環繞,其運動的位置被稱為軌域。當目前的軌域被填滿後,電子就會排到下一層的軌域,也就是新的週期。目前的元素週期表有七個週期,由上而下每個週期的元素數量分別是 2, 8, 8, 18, 18, 32, 32。
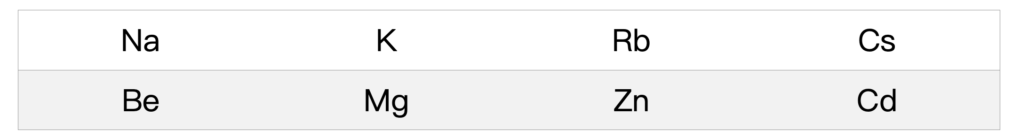
在原子最外層的價電子,則大大決定了原子的化學性質。因為當電子的數量可以填滿軌域的時候,原子就會趨於穩定,也就是不容易產生化學反應,反之原子為了填滿軌域,會進行化學反應來得失電子,以達到安定的狀態。換句話說,具有相同價電子的元素,也就是在元素週期表上同一行(族)的元素,通常會具有類似的化學性質。
舉例來說,8A 族的氦、氖、氬、氪、氙等元素,因為電子的數量剛好可以填滿電子軌域,故都是不容易起反應的穩定氣體,又被稱為惰性氣體。而 1A 族的氫、鋰、鈉、鉀等元素,則是因為剛好多了這麼一顆價電子,所以容易失去價電子,反應後會成為少了一顆電子的帶正電離子,如鈉離子(Na+)。2A 族則有類似情形,只是會變成帶有正 2 價的離子,例如鈣離子(Ca2+)。7A 族的情形則反之,氟、氯、溴等元素需要獲得電子來滿足電子組態,因此常見帶一個負電的離子,如氯離子(Cl-)。(編按:前述元素相關化合物的化學屬性,可上化學知識地圖查找資訊,如氰化銅、次氯酸鈉、全氟辛酸等。)
最後來說說中文的符號有什麼玄機吧,事實上你可以看到中文的元素就只有四個部首,分別是金、石、水、气。這四個部首就代表了該元素在常溫常壓下的狀態,若是固態金屬,就是金部,固態非金屬則用石部,液態的話就用水部,氣態當然就是气部。
說了這麼多,當你下次要記元素週期表的時候,想想這些背後的原因和規則,或許可以幫你省下不少功夫喔。
元素週期表的下一個 150 年,關於未知的新元素
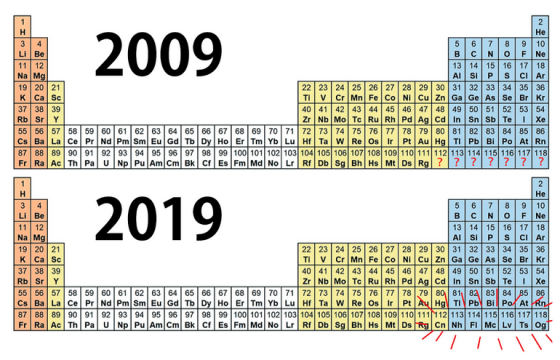
雖然今年已經是元素週期表發表後的第 150 年,但事實上,科學家到今天為止,仍然在嘗試找出新的元素。2009 年,元素週期表上的元素只有到第 111 號的錀(Rg),到了 2010 年,112 號元素鎶(Cn)正式被命名,兩年後,編號 114 的鈇(Fl)和 116 的鉝(Lv)也加入。
最終在 2016 年,113 鉨(Nh)、115 鏌(Mc)、117(Ts)與 118(Og)正式加入元素週期表,也就是元素週期表誕生第 147 年後,科學家們終於成功填滿了一到七週期中所有的空格了!
但是第七週期是找到所有元素的最後一塊拼圖嗎?德國化學家杜爾曼(Christoph E Düllmann)就說過:
「我不知道任何懷疑元素 119 與 120 存在的人。(I know of nobody who doubts that elements 119 and 120 can exist.)」也就是說,科學家們都相信第八週期元素的存在,只是目前為止尚未發現而已。
事實上,與其說是「發現」新元素,這些年倒不如說科學家「製造」出新元素還貼切一些,因為目前為止在自然界發現的元素只有約 90 幾種,其他的元素都是在實驗室裡面製造出來的。尤其是那些原子量超過 104 的超重元素們(superheavy elements),幾乎都是使用加速器使輕元素相互碰撞後產生的。
說起來簡單,但做起來可是困難重重,先不說每次的碰撞實驗都需要花上幾個月的時間去準備,成功合成出想要的元素後,這些重元素又會很快就衰退消失成其他元素,壽命從千分之一秒至一兩秒都有,根本就是實驗室裡的煙火秀。

在這短暫的時間中,還要想辦法從各種粒子中找到並去確定新元素的性質,這就像是要幫閃電拍照一樣困難的任務!
以元素 114 鈇(Fl)為例,當時部分的學者推測鈇是一個活性很低的元素,甚至與惰性氣態相近。但又因為鈇在元素週期表的位置在鉛之下,所以照元素週期表的規則來說,鈇的化學性質應該類似於重金屬。為了找出答案,科學家們設計了一場實驗:
他們讓鈇原子通過一個狹窄的黃金隧道,隧道一開始是熱的,但出口端的溫度會低至攝氏 -170 度。若鈇的性質與鉛相似,一開始就會被隧道所吸收,反之如果比較像惰性氣體,那就會移動到接近出口時才被吸收。然而等到實驗結果出爐後,兩組研究人員卻得到了相反的結果,也意味著學者們仍需要更多的實驗,來了解鈇這個元素。
這個故事向我們展現了研究超重元素的困難,即便如此,科學家們仍會努力地去找出下一個新的元素。
在 119 號元素以後的元素週期表,會有哪些神奇的元素?會在何時結束?又是否會一直保有週期性呢?回首元素週期表誕生 150 周年,讓我們預祝下一個 150 年一樣充滿發現與驚喜。
本文由行政院環境保護署毒物及化學物質局之推動化學物質綠色生活知識教育平臺計畫企劃,泛科學執行
參考資料
- Düllmann, C. E. (2019). 118 and Counting… The Periodic Table on its 150th Anniversary. Angewandte Chemie International Edition, 58(13), 4070-4072.
- 環保署化學局「化學知識地圖網站」—列管毒化物簡表
延伸閱讀