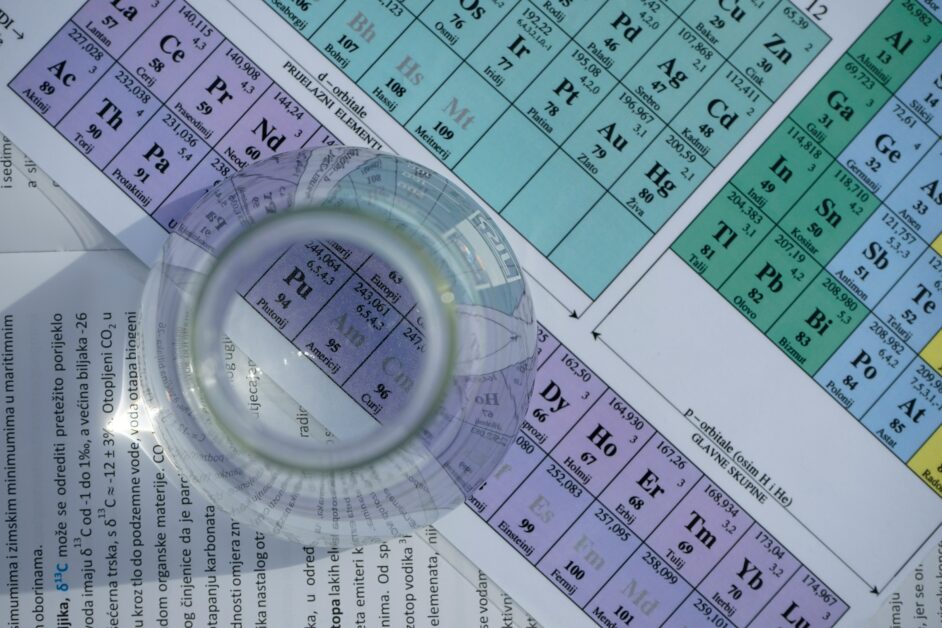
作者:張 澔(義守大學通識教育中心副教授)
十九世紀的週期表,就像一張天空星座圖,充滿了神祕的美感,如此迷人的圖案似乎暗藏了構成萬物的傳奇密碼。元素的性質與原子量之間是否存在某一種關係?這不是一個突然的想法,而是西方自然哲學對於自然奧祕的一種猜測與預測,而門得列夫並不是唯一有這種想法的人,然而為何大家卻只推崇他的成就?在20世紀初,隨著量子化學的發展,再加上新發現的元素,週期表如何逐漸蛻變成我們今天所看到的面貌?

元素週期表的創生
元素及原子是兩個構成近代化學發展的基石。從古希臘時代,不論是元素或者原子,便定義為構成自然萬物的最小物質。既然是構成萬物的最小單位,自然成為化學家夢想征服的聖地,如此才能真正瞭解萬物構成的奧祕。
十八世紀末拉瓦節的化學革命,讓我們逐漸開始知道哪些才是真正的元素,而十九世紀初道耳吞所提的原子理論,又讓原子量成為化學化合時必備的數據。在1815~1816年之間,英國化學家普勞特(William Prout, 1785~1850)觀察到,當時所知各種元素的原子重量都是氫原子重量的整數倍。1829年德國化學家德貝萊納(Johann Wolfgang Döbereiner, 1780~1849)提出了「三元群」(Triaden)規則,把當時已知的53個元素中的30個元素分成三大組。
在1862年法國化學家尚古多(Alexandre-Émile Béguyer de Chancourtois, 1820~1886),以義大利化學家坎尼扎羅(Stanislao Cannizzaro, 1826~1910)在1858 年於法國科學院宣讀元素週期表的論文中,將原子量數值作為基礎,闡述元素會按原子量大小來排列,呈現「碲螺旋」狀(telluric helix),因「碲」元素排列在此螺旋圖案的中間。
從1863年開始,英國化學家紐蘭德(John Alexander Reina Newland, 1837~1898)開始研究化學元素性質的週期性。1865年他受德貝萊納「三元群」的啟發,把當時已知的61 種元素按照原子量的大小順序排列,發現每隔7種元素便出現性質相似週期性,就如同音樂中的音階一樣,他稱之為八音律法(Law of Octaves)。
1864 年德國化學家邁爾(Julius Lothar Meyer, 1830~1895) 完成《近代化學理論》(Die Modernen Theorien der Chemie),在書中,他按照元素的化學鍵,將28個元素分為6族。但是在1870年的時候,他卻按元素及原子量的關係來排列它們的週期性。
門得列夫的崛起
1869年3月6日,在聖彼得市的蘇俄化學學會上,有一篇關於元素性質與原子重量有關的論文發表,署名門得列夫(Dmitri Ivanovich Mendeleev, 1834~1907),因為那天他正好生病,所以是由他的同事來宣讀。在同年,門得列夫將這篇論文節錄整理成二頁的德文,以〈有關元素的性質與其原子量的關係〉為標題,發表在《化學期刊》(Zeitschrift für Chemie)。在兩頁的內容中,包含一張元素週期表。

除此之外,尚有數個註解如:元素,按原子量的大小,性質會呈現逐步的變化; 化學相似的元素,它們的原子量如非出現一致(鉑、銥、鋨),便會是等量的增加(鉀、銣、銫);按原子量排列的元素與其價鍵相對應,從某一些程度而言,也與它們化學行為的差異相對應,如鋰、鈹、硼;氫是最輕的元素,理應被當作重量的標準;有些元素的原子量需要被訂正,如碲的原子量不是128,而是在123和126之間。
在這張週期表中,門得列夫共列有67個元素,他預測將會有原子量為45、68、70及180的元素存在,後來,除了原子量180沒有被發現外,其餘的三個元素,鈧(45)、鎵(68)、鍺(70),陸續被發現。在表中,門得列夫還對鉺、釔、銦、釷、碲與金的原子量表示質疑。
門得列夫將週期表論文發表在德國期刊上,這不僅帶動週期表觀念的流傳,也有助於他名聲的傳播。1859年門得列夫到海德堡大學,在本生(Robert Bunsen, 1811~ 1899)門下進修學習。隔年,他恰巧有機會參加卡斯魯爾化學會議。在會上,他學到亞佛加厥定律:在相同的溫度和壓力下,等體積的任何氣體都含有相同數目的分子。這點對於門得列夫在探討元素週期表有很大的啟發。
莫斯利的貢獻
在莫斯利(Henry Moseley, 1887~1915)的實驗前,元素在週期表上的排列是以原子量作為依據,有時候會產生一些混淆,或者無法解釋的地方,如原子量比較輕的鎳(58.693),應該排在鈷(58.933)之前,然而按照它們的化學性質來分析,鈷卻排於鎳之前。在1913 年的時候,莫斯利對照週期表進行實驗,他以陰極射線撞擊不同金屬的靶面,發現到金屬原子所放射出來的X射線頻率平方根與週期表的原子序成比例,此實驗稱之為莫斯利定律。

透過此實驗方法,莫斯利重新檢驗了週期表的元素排列,他實驗證明,鈷和鎳的原子序分別為27和28。另外,莫斯利也按此方法,指出原子序在43、61、72和75的元素是空白的。後來這些被莫斯利所預測的元素,在他去世之後,陸續被發現,前兩者是在大自然中極少量的放射性元素鎝(43)和鉕(61),後兩者則是自然穩定存在的過渡金屬元素鉿(72)和錸(75)。莫斯利的實驗正好證實了波耳原子模型,原子序就是原子中的正電荷數目。後來實驗發現,原子序便是原子核中的質子數。最重要的是,在莫斯利之前,原子序只是元素在週期表中一個位置,莫斯利不僅賦予原子序一個物理意義,並且是可以實驗測量的一項數值。
週期表所隱藏的祕密
為何元素化學性質會與原子重量產生關係,當然門得列夫無法正確來回答這個問題。然而隨著更多的元素被發現,再加上量子力學的發展,週期表的謎題逐漸柳暗花明。
在1897年英國化學家湯姆生(Joseph John Thomson, 1856~1940)透過陰極射線, 第一次發現到電子,打破了科學家長期以來對於原子不可分割的觀念,隨後,美國物理學家密立根(Robert Millikan, 1868~1953)利用精確的油滴實驗,測得原子中負電荷粒子的重量和電荷。1903年拉塞福(Ernest Rutherford, 1871~1937)發現,放射性的產生乃是由於原子的崩壞。隨後,在1911年拉塞福和德國物理學家蓋革(Hans Geiger, 1882~1945)發現,其實電子是圍繞原子核來運動。

在1913年波耳(Niels Bohr, 1885~1962)更發現,電子以不連續能量方式圍繞原子運動,其被稱之為軌道。當電子從一個軌道移動到另外一個軌道的時候,就會釋放出輻射。一年之後,拉塞福證實,在原子中存在一個帶有正電荷的粒子,稱之為質子。1932 年查兌克(James Chadwick, 1891~1970)實驗發現,在原子核中,除了帶正電荷的質子外,還有一個不帶電荷的中子,這讓科學家對於原子的結構知識更完整,也讓週期表的建立有更完整的基礎。
1923年波耳是第一位提出,元素週期表可以用原子的結構來解釋。隔年,英國理論物理學家斯通納(Edmund Clifton Stoner, 1899~1968)使用了德國理論物理學家索末菲(Arnold Sommerfeld, 1868~1951)的第三個量子數來解釋電子殼層。在1914~1915年期間,索末菲開始使用第二量子數(l:角量子數)及第三量子數(m:磁量子數),然而不論是波耳或者是斯通納都無法正確的來描述原子光譜在磁場中的變化,即所謂塞曼效應(Zeeman effect)。波耳很清楚這個缺點,所以寫信給他的好朋友包立(Wolfgang Pauli, 1900~1958),請求協助如何讓這個量子理論更完善。包立意識到,塞曼效應能夠影響的,應該只是原子最外殼層的電子而已,所以只需要修訂斯通納的原子殼中的次殼層結構便可,因此在1925年,他提出了第四個量子數,即所謂的自旋量子數,及包立不相容原理來描述。



除了包立不相容原理外,有關電子在殼層的排列,在1927年由德國物理學家罕德(Friedrich Hund, 1896~1997)所提出的罕德定則:當有多重軌道時,電子必須先以相同的自旋方式完成半填滿之後,才能以成對的方式填入軌域。除此之外,尚有1936年被提出的構築理論,不論是一個或者更多原子的軌道電子是以最少的能量來填入,在這情況下,原子、分子或者離子都會處於最穩定的電子組態。
所以原子的結構中,除了原子核外,每一個元素所擁有的電子,則是按照以上的方法而構成,而不同軌域所能夠填滿的電子數目則不同(s軌域可填2個電子;p軌域為6個;d 軌域為10個;f 軌域為14個)。因此,電子組態是解釋元素週期表最好的依據,換句話說,按電子組態所形成的週期表才最值得採信。
被時代所淘汰的週期表
除了發表在《化學期刊》的週期表外,門得列夫在1868~1872年之間至少還發表了7張以上的週期表。而1940年開始,4f電子軌域的鑭系元素(原子序57的鑭到71的鎦),及在5f電子軌域的錒系元素(原子序89的錒到103的鐒)陸續被發現,所以我們現今所使用的週期表,大約也是在1950年前後逐漸開始形成,當時有無數的週期表被提出。
在形狀為長方形的週期表,可以被分類成不同長度的週期表,除了氫與氦外,有含有8個元素的短週期,含有18個元素的中週期,含有32個元素的長週期。所以,週期表按它們的長度,可分類為短表、中表及長表。除了按表的長度來分類外,有些週期像同心圓,有些週期表圖看來像螺絲,有些像蝸牛,有些像雙鈕線。雙鈕形及橢圓柱螺旋形是按原子量所排列之週期表;盤繞螺旋形及八平面空間同心圓則是按電子組態來排列。
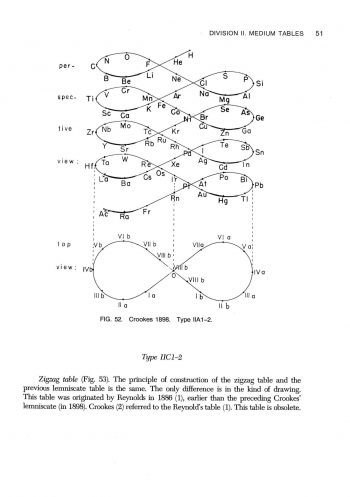
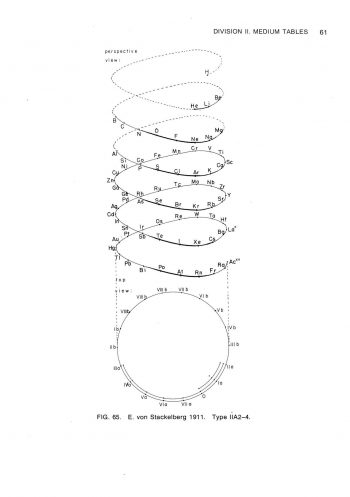

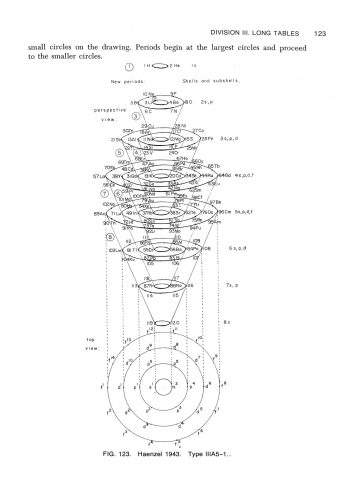
最終的成果
元素的性質與原子重量會出現週期關係,這聽來很神奇。在十九世紀時,化學家無法正確來解釋這個現象,一個是質量的東西,而另外一個卻是數量的東西。然而化學家實驗發現,這兩者之間出現週期性的變化,而且可以製作成一張表格。在那個時候,他們不知道為何會出現如此的關係,但是他們相信,可以在表格上,找到元素性質及原子量更多例子,也許最終有一天,當更多或者完整的週期表出現後,化學家便可以找到的答案。在建立更精確的週期表的過程中,它神奇的預測過新的元素,也幫忙校正一些原子的重量。
也許,門得列夫在1869年提出元素週期表,並非是一個「科學成就」,而是另外一個嶄新的問題:為何元素的性質與原子量出現週期關係?是的,電子組態便是答案。當我們知道,電子組態可以來解釋元素的各項性質時,我們似乎對元素性質的瞭解豁然開朗。然而另外一方面,過去週期表給我們那種神祕的美感,頓時消失,因為電子組態看來也是一個數量而已,它們是分布在不同軌域的電子數,而原子量就是原子核的中子和質子所組成,在原子中,有多少電子,就有多少質子,最後,我們看到就是數量和數量的關係,而不再是我們所認為的質量和數量所產生的關係,不再令人有一種神祕傳奇的魅力。
參考文獻:
- Mazurs, E. G., Graphic Representations of the Periodic System during One Hundred Years, University of Alabama Press, 1974.
- Meyer, L., Mendelejeff, D., Das Naturliche System der Chemischen Elemente – Ostwald’s Klassiker der Exakten Wissenschaften Nr. 68, Leipzig: Verlag von Wilhelm Engelmann, 1895.
- Van Spronsen, J. W., The Periodic System of Chemical Elements: A History of the First Hundred Years, Amsterdam: Elsevier, 1969.
延伸閱讀:
時代下的悲劇天才—莫斯利與原子序
人類所創造的物質—超鈾元素
什麼?!你還不知道《科學月刊》,我們46歲囉!
入不惑之年還是可以當個科青