- 翻譯/蔡蘊明,台大化學系名譽教授
他們開發出世界上最有力的電池
2019 年的諾貝爾化學獎頒發給了 John B. Goodenough (古迪納夫),M. Stanley Whittingham (惠廷翰)和 Akira Yoshino(吉野彰)三人,表彰他們為鋰離子電池的發展所做出的貢獻。
2019 年的化學獎由三人共同獲得,他們發明了鋰電池。圖/nobelprize 這種可充電電池奠定了如手機和筆記型電腦等無線電子產品的基礎。這也使得一個無石化燃料的世界成為可能,因為它可以使得從驅動電動車到儲存能量裝置的各種工具能運用可再生能源。
很少有一個元素能在戲劇中扮演中心的角色,但有關 2019 年諾貝爾化學獎的故事卻有著一個明確的主角:鋰——一個在大爆炸的頭一分鐘內所產生的古老元素。
人類在 1817 年意識到它的存在,那是由當時瑞典化學家阿弗魏德森(John August Arfwedson)和貝吉里斯(Jöns Jacob Berzelius)從斯德哥爾摩群島中的宇土(Utö)島之礦物樣品中所提煉出來的。
貝吉里斯用希臘字 “lithos”(石頭之意)來命名此新元素。儘管名字聽來很重,但它卻是最輕的固體元素,這就是為什麼我們幾乎不會感覺到現在隨身攜帶的手機的原因。
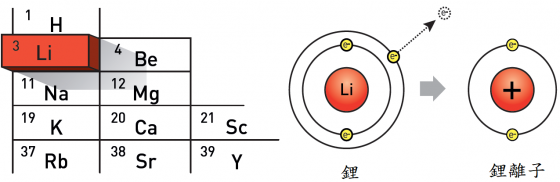
更正確的說──上述的瑞典化學家實際上並未發現純的金屬鋰,而是以鋰離子形式存在的鹽類。純的鋰不知引發了多少火災警報,尤其是在我們將要告訴妳/你的故事當中。
它是一種不穩定的元素,必須儲存在油中,以免與空氣反應。鋰的弱點──其反應活性──也是它的強項。
- 1970 年代初期,惠廷翰利用鋰釋放最外部那個電子的極大驅動力,開發出了第一個可運作的鋰電池。
- 1980 年,古迪納夫將電池的電動勢提高了一倍,創造出能獲得更強大而有用的電池之正確條件。
- 1985 年,吉野彰成功去除了這類電池中的鋰,而改成完全基於鋰離子的電池,使其安全性比使用純鋰更高了許多,因此讓這種電池真正具有實用性。
鋰離子電池為人類帶來了最大的好處,因為它們推動了筆記型電腦、手機、電動車以及由太陽能和風能產生的能量存儲裝置等等之發展。
現在,讓我們將時間倒退五十年,回到鋰離子電池發展之初,告訴你/妳那個具有高度充電性的故事。
汽油的霧瘴重振了電池研究
在 20 世紀中葉,世界上汽油驅動的汽車數量顯著增加,它們排放的廢氣加劇了大城市的有害煙霧,加上人們逐漸體認石油乃是一種有限的資源,這都對汽車製造商和石油公司發出了警報。因此他們這些企業體認到若要生存,就需要投資電動車和替代能源。

電動車和替代能源都需要可以存儲大量能量的高效能電池。在市場上,當時實際上只有兩種類型的可充電電池:1859 年發明但嫌笨重的鉛蓄電池(至今仍於汽油驅動車中用作啟動器電池),以及在 20 世紀上半葉所開發的鎳鎘電池。
石油公司投資新技術
石油用盡的威脅導致石油巨頭艾克森石油公司(Exxon)決定採取多元化經營。在一項基礎研究方面的主要投資中,他們招募了當時在能源領域最頂尖的一些研究人員,只要不涉及石油,他們可以自由地進行想做的研究。
惠廷翰就是1972年進入艾克森石油公司的研究人員之一。他來自史丹佛大學,在那裏他的研究包括含有原子大小空間的固體材料,而帶電離子可以附著於其夾層中,這種現象稱為插入(intercalation),此種材料的性質在離子插入其中後將會改變。在艾克森石油公司,惠廷翰和他的同事們開始鑽研可以插入離子的超導材料,這包括了二硫化鉭(tantalum disulphide)。他們將離子加入二硫化鉭中,並研究其導電性如何受到影響。
惠廷翰發現一種能量高度密集的材料
就如同在科學研究中經常發生的例子一般,這個實驗導致了意想不到且具有價值的發現。經證明鉀離子會影響二硫化鉭的導電度後,惠廷翰開始進一步詳細研究該材料,他觀察到此材料具有很高的能量密度。鉀離子和二硫化鉭之間的插入現象令人驚訝的具有豐富能量,當他測量該材料的電壓時,它只有幾伏特,但這已經比當時的許多電池更好。
惠廷翰很快意識到這是時候改換跑道了,轉向為發展未來的電動車中儲存能量的新技術。但是,鉭是較重的元素之一,而市場並不需要充斥更多笨重的電池──因此他用鈦取代了鉭,鈦具有相似的特性但重量要輕得多。
負電極中的鋰
鋰不是應該在這個故事中佔有重要地位嗎?好吧,這就是鋰進入故事中的時機──作為惠廷翰的創新電池中的負極。鋰並非隨機的選擇;電池中,電子應從負極(陽極)流向正極(陰極),因此,陽極應包含易於釋出其電子的材料,而在所有元素中,鋰是最容易釋放電子的。
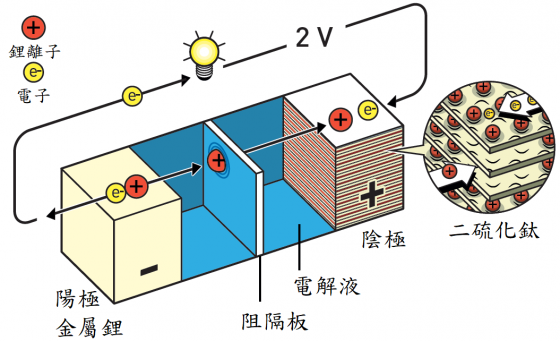
最終產生了可在室溫下運作的可充電鋰電池,並且──如同字面意義──具有很高的勢能(potential)。惠廷翰前往艾克森石油公司紐約總部討論這項計畫,會議持續了大約十五分鐘,管理部門小組隨後快速的決定:他們將利用惠廷翰的發現去開發一種商業上可行的電池。

不幸的是,將要開始生產電池的小組遭受了一些挫折。當新的鋰電池反覆充放電時,鬚狀鋰晶體從鋰電極中生長出來,當它們接觸到另一個電極時,電池短路導致爆炸。在消防隊撲滅了好幾次的火災之後,最終威脅要讓實驗室支付用於撲滅鋰火所需使用的特殊化合物。
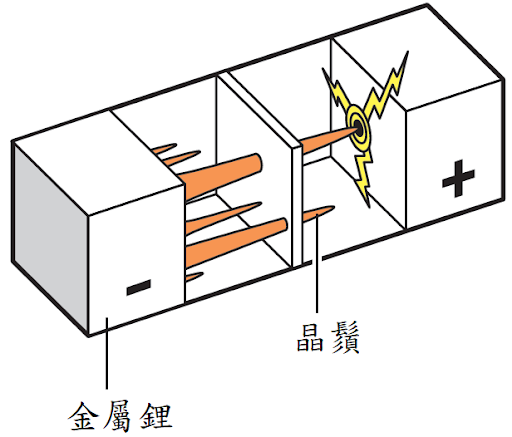
為了使電池更安全,他們在鋰金屬電極中添加了鋁,在兩電極之間的電解液也做了改變。惠廷翰於 1976 年宣布他的發現,並開始為了想在太陽能驅動的鐘錶中使用它的瑞士鐘錶製造商,小規模生產這種電池。
下一個目標是擴大可充電鋰電池的尺寸,使其可以為汽車供電。然而,石油價格在 1980 年代初急劇下跌,艾克森石油公司需要削減開支。因此研發工作被迫中止,而惠廷翰的電池技術則被許可給位於全球三個不同地區的三個不同公司。
但是,這並不意味著發展就停止了。艾克森石油公司放棄後,古迪納夫接手了。
石油危機使古迪納夫對電池產生興趣
小時候,古迪納夫在學習閱讀方面遇到了很多困難,這就是為什麼他被數學所吸引的原因之一,最終──在第二次世界大戰後──也被物理所吸引。他在麻省理工學院的林肯實驗室工作了數年,在那裡,他為隨機存取記憶體(RAM)的開發做出了貢獻,那仍然是一種計算機的基本元件。
古迪納夫和 1970 年代的許多其他人一樣,受到石油危機的影響,期望能為替代能源的發展做出貢獻。然而,林肯實驗室乃由美國空軍資助,不允許進行各種研究,因此當他受到在英國的牛津大學擔任無機化學教授一職的邀約時,接受了這個機會,並進入了能源研究的重要領域。
當鋰離子藏在氧化鈷中時的高電壓
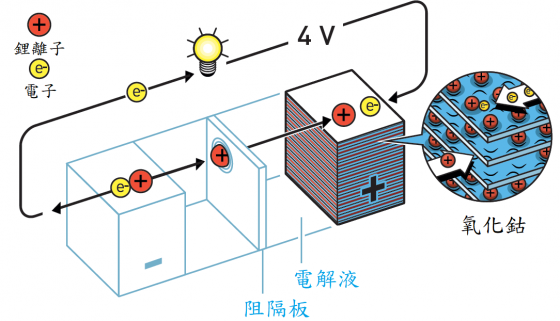
古迪納夫知道惠廷翰的革新性電池,但是他對物質內部的專業知識告訴他,如果使用金屬氧化物代替金屬硫化物作為陰極,此陰極可能具有更高的電位。因此其研究小組中的一些人企圖尋找一種金屬氧化物,能在插入鋰離子時產生高電壓,但是移除離子時不會崩塌。
這個系統性的搜索比古迪納夫不敢奢望的更為成功。惠廷翰電池產生的電壓超過 2 伏,但古迪納夫發現使用鋰鈷氧化物為陰極的電池,其電力幾乎是惠廷翰電池的兩倍,擁有四伏特的電壓。
成功的關鍵之一,是古迪納夫意識到不必像以前一樣,製造處於充電狀態的電池。相反的,可以在事後充電。1980年,他發表了這種新型的能量密集型陰極材料的發現。儘管它的重量輕,卻可產生電力強大的高容量電池,這是朝著無線革命所踏出的決定性一步。
日本公司需要輕量電池用於新電子產品
但是,在西方,隨著石油變得更便宜,人們對替代能源科技的投資和電動車的發展之興趣逐漸減弱。日本的情況則有所不同;電子產品的公司迫切需要能為其創新電子產品供電之輕量且可充電的電池,例如攝影機、無線電話和電腦。
看到這一需求的人是旭化成株式會社的吉野彰,或正如他所說的:「我只是聞出趨勢正在移動的方向,你可以說我擁有很好的嗅覺。」
吉野製造出首款商業上可行的鋰離子電池
吉野彰決定開發一個實用的可充電電池時,他使用了古迪納夫的鋰鈷氧化物作為陰極,並嘗試使用各種以碳為基礎的材料為陽極。先前之研究者已經展示了鋰離子可以插入石墨的分子層中,但是石墨會被電池的電解液分解。
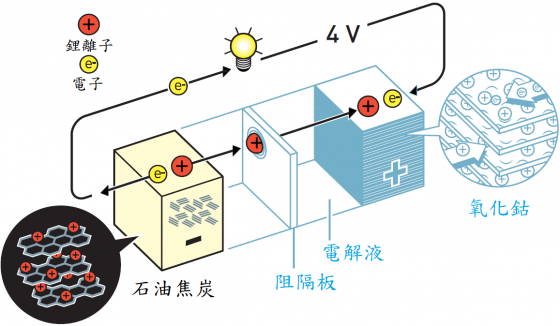
吉野彰的頓悟時刻 (eureka moment) 發生在他轉而嘗試使用石油焦炭(石油業的副產品)的時刻。當他將電子充入石油焦炭的時候,鋰離子被吸入此材料中。然後,當他開通電池時,電子和鋰離子流向電池中的氧化鈷陰極,並具有更高的電動勢。
吉野彰開發的電池穩定、輕巧、電容量高並且可以產生驚人的四伏特電壓。鋰離子電池的最大優點是離子被插入在電極中,其它大多數電池都是基於化學反應,其中電極會緩慢但肯定的產生改變。當鋰離子電池充電或使用(放電)時,離子會在電極間移動但不會與周圍環境發生反應。這意味著電池使用壽命長,並且在其性能下降之前可以充放電數百次。
另一個大優點是此電池中沒有純鋰。1986 年,吉野彰為了測試電池的安全性,他謹慎行事,使用了用於測試爆炸物的設施。他在電池上丟下了一大塊鐵,但是什麼也沒發生。但是,將此實驗重複在裝有純鋰的電池上,則發生了劇烈爆炸。
通過安全測試對此電池的未來至關重要,吉野彰說這是「鋰離子電池誕生的那一刻」。
鋰離子電池:無石化燃料社會所必需
1991 年,一家主要的日本大型電子公司開始銷售首款鋰離子電池,引發了一場電子革命。手機縮小,電腦變得可攜帶,並開發出了 MP3 播放器與平板電腦。
隨後,世界各地的研究人員在元素週期表中搜尋更好的電池,但尚無人能成功發明出一種電池能擊敗鋰離子電池所擁有的高電容量和高電壓。不過鋰離子電池已經改變而進化了,其中包括古迪納夫用磷酸鐵取代了氧化鈷,使得這種電池對環境更為友善。
與其它所有事物一樣,鋰離子電池的生產也會對環境產生影響,但也有巨大的環境效益。這種電池推動了乾淨能源技術和電動車的發展,從而有助於減少溫室氣體和微粒的排放。
通過他們的工作,古迪納夫、惠廷翰和吉野彰創造了無線和不含石化燃料的社會之適當條件,因而為人類帶來了最大的福祉。
譯註
因上文較為簡略,在此以使用石墨與氧化鈷為兩電極的鋰離子電池為例,進一步說明其運作。
當電池充飽了電時,石墨上擁有許多帶負電的電子,為了中和其負電荷使其穩定,於石墨層狀結構的夾層中含有等電量的鋰陽離子;相對的,此時的氧化鈷處於氧化的狀態,是以 CoO2 的形式存在,其中的鈷為正四價的氧化態。
於充飽電的狀態開始使用電池時,亦即開始放電,石墨極為陽極(負極),透過外部線路釋放電子(氧化),因為石墨上的負電荷開始減少,原先在夾層中的鋰陽離子相對太多了,為保持電中性,鋰離子會透過電池內部的電解液離開石墨極而流向陰極。反觀氧化鈷這一極,由外部線路輸入了電子產生還原,是為陰極(正極),被還原的是鈷離子,其氧化態數降低,但因氧離子的數目以及氧化態數(負二價)不變,陽離子相對的變少了,為了讓電荷保持中性,就是由上述流入的鋰陽離子來補充正電荷,也因而此極的結構式常以 LixCoO2 (0 < x ≤ 1) 來表達,稱為鋰鈷氧化物。在這種表達式中,鈷代表的不是單一的氧化價數,x 的數值則和參與的電子當量數有關;例如有 0.5 莫耳的電子輸入 1 莫耳的 CoO2 時,x 的數值為 0.5。
充電時則與上述過程相反,鋰陽離子透過電池內部流向石墨極。這種在充放電時,鋰離子於兩電極之間來回移動的現象類似搖椅,因此也被稱之為「搖椅式電池」。整個電池運作的原理其實並不牽涉鋰的氧化還原,不可誤解。
這種電池的成功不僅有賴於石墨的層狀結構中能插入鋰離子,同樣的氧化鈷也需要有同樣的能力。此外,當離子插入時不可產生過度的結構膨脹,因為這會脹破電極,反覆使用時,結構也不可崩塌。是否會在電極表面產生晶鬚(亦稱樹枝狀晶體;dendrite),也非常重要,上文中已經提及那會造成短路,釀成災害。電壓與可儲存的電力有關,是尋找新材料要追求的,但是電流也很重要。例如鋰離子在兩極內部以及電解液中的流動速率,影響瞬時可拉出的電流量,與實用有關,亦須考慮。是而要尋找適當的兩極材料,絕非口說般容易。
我們熟知鋰金屬與水會劇烈反應,產生氫氣。因此用鋰金屬作為放電時的陽極,主要的一個問題是其化學活性太高,有極大的安全疑慮。改以插入鋰離子的石墨為電極雖可改善此問題,但並不代表充滿電子的這個石墨電極就很安全。其實在充飽電時,此時的石墨極會處於一個高度的還原狀態,其化學活性仍然是高的,但這畢竟是二次電池(可充電式),在販售時不需事先充飽電,可避免意外,在上文中將之視為優點。這與常用的一次電池(如鋅錳電池)不同,那些電池買來時是處於電力飽滿的狀態,但因運作原理不同,牽涉的材料都很穩定安全,正常的使用下讀者不用擔心。
鋰離子電池的電解液也是一門學問,基本上因為水溶液會造成問題,可使用高極性有機溶劑溶解含鋰的電解質(如LiBF4)作為電解液。常用的溶劑包括如二甲基碳酸酯、亞乙基碳酸酯和伸丙基碳酸酯等。然而使用有機溶劑的最大缺點是普遍可燃,一旦發生意外更易導致火災。因此一個研究方向就是尋找固態的無機電解液,會安全許多,但其前提當然是鋰離子在其中的遷移速率必須夠快,才能實用。
譯者後記
鋰離子電池的確在最近數十年扮演了科技革新的重要角色,譯者近年拜常教普通化學之賜,平常亦經常關注電池研究的發展,因為能將化學能轉變為電能的電化學是普通化學裡的一個重要章節。

鑒於電池的重要性,無怪乎過去這幾年此領域的幾位重要學者獲頒諾貝爾獎的預測聲量一直名列前茅,譯者就常聽到系上的周必泰教授多次預測古迪納夫會得獎。
然而值得諾貝爾桂冠的學者何其之多,想正確預測並不容易。兩星期前閱讀九月二號出刊的美國化學與化工會誌時,剛好讀到一篇介紹古迪納夫的短文,此君已具九七高齡但仍然活躍。數日前(十月五號)於一場會議中,本系的楊吉水教授問我今年諾貝爾化學獎有何預測?我靈機一動立刻想到了古迪納夫。
星期一傍晚正值諾貝爾醫學獎公布,我在飯桌上與太座閒聊時,順道提及今年預測古迪納夫與另一日本學者(吉野彰)可能得獎,更提及我在美國化學與化工會誌上看到的文章,懷疑可能其中有人嗅到風向,且笑言請太座作證我今年的預測。今日傍晚公布得獎人時真讓我雀躍,猜了那麼多年,今年終於被我矇對!
回到嚴肅的一面,上文提及鋰離子電池對環境的負面衝擊,惜未多言。不久前在美國化學與化工會誌上(六月十五號刊)讀到的一篇封面主題文章,就在介紹鋰離子電池的回收問題。該文提及,目前只有 5% 的鋰離子電池被回收,相對地比較,車用鉛蓄電池的回收率則達約 100%。
這樣的比較或許並不公平,因為鉛蓄電池的結構簡單,而鋰離子電池的構造則相對複雜許多。從數字來看,預期到達 2030 年時,電動車的數量將達一億四千萬輛,從現在到 2030 年之間所淘汰的鋰離子電池預測將達一千一百萬噸。因此若不能提升鋰離子電池的回收科技和回收率,屆時對環境造成的負荷將很難想像。
今年為諾貝爾獎終於肯定鋰離子電池發展的喜事而歡呼時,請別忘了,這也應該是我們吹起鋰離子電池回收號角的當兒。
蔡蘊明謹誌於2019/10/10凌晨
- 感謝台大化學系的蔡明軒特別在假日加班幫忙將此文放上化學系的網頁。另感謝曹一允博士在第一時間對我的初稿提出之意見與討論
- 本文譯自諾貝爾化學獎委員會公佈給大眾的新聞稿,若有興趣閱讀進階的原文資料,請參考連結。
本文轉載自臺灣大學化學系〈2019年諾貝爾獎簡介〉。










































