為何選擇用「Gene」來當筆名?大一剛入學,要為 BBS 站取個帳號,當時我只是覺得一個英文名字剛好和生命科學的專有名詞一模一樣,十分有趣,完全沒有想到日後會和「Gene」的科學意涵結下不解之緣。
有些朋友不相信「Gene」真的是個英文名字,甚至聽我信誓旦旦地解說,還開玩笑說他們也想取名叫「Cell」、「DNA」或「Protein」。如此,我只能回說要不然乾脆叫「Genome」,這一來就比我大很多了。其實,「Gene」這名字來自古希臘文「γόνος」,意思是「生」(born),而這個名詞在遺傳學中,字源也是一模一樣的。
很不巧的,我博士班念的就是遺傳學,在美國加州大學戴維斯分校(UC Davis)當遺傳學實驗課的助教時,就有很多學生說我名字取得實在太妙了。然而事實上,我大學時期最討厭的必修課之一就是遺傳學,我導師說他大學時最不喜歡的必修課也是遺傳學,可是博士班念的是遺傳學,所以做人別太鐵齒,我當時心想這絕對不會發生在我身上,可是命運就是這麼愛捉弄人,決定念演化生物學當志業後,發現遺傳學真是最佳的工具,於是就步上了導師的後塵。
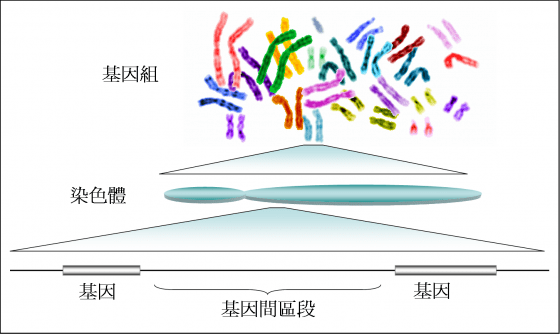
簡單來說,遺傳學就是門研究基因的生命科學學門。
顯微鏡底下,嘶嘶輕聲作響的麻醉台上的細小孔洞噴著二氧化碳,讓果蠅暫時沉睡,我們趁機輕輕地用羽毛或毛筆把帶有不同性狀的果蠅分群──那些博士班的果蠅遺傳學研究時刻,總能讓人一再讚歎孟德爾(Gregor J. Mendel,1822-1884)的先見之明。然而,不是在唸研究所拚學位、無升等壓力、不必拿科研計畫、沒有 KPI 考績要求下的修道院神父,是懷著什麼樣的心情和信念在為豌豆進行實驗的呢?
在念了遺傳學博士班後,三不五時就會在茶餘飯後接到親友的詢問,真是五花八門無奇不有,從單純好奇到試圖挑戰的都有,例如真的能夠用基因工程改造人類嗎?我們科學家為何要這麼變態地製造變種生物?如何生出更聰明健康的小孩?小孩的問題都是來自遺傳嗎?為什麼罕見遺傳疾病愈來愈多?

普立茲獎得主、英國衛報新人獎得主、暢銷書《萬病之王:一部癌症的傳記,以及我們與它搏鬥的故事》(The Emperor of All Maladies: A Biography of Cancer)作者辛達塔.穆克吉(Siddhartha Mukherjee)在聽到一位癌症病人在接受了很長一段時間的治療後向他請求「我願意繼續治療,但我要知道我在對抗的是什麼。」於是他就寫了本癌症的傳記,也就是不可多得的好書《萬病之王》。
《萬病之王》更是一本充滿熱情的書,是一本癌症的傳記,也是人類與癌症搏鬥的生命故事。在為癌症作了傳記後,來寫這本《基因:人類最親密的歷史》(The Gene: An Intimate History),似乎就是順理成章、天經地義的,因為癌症不就是因為基因出了錯嗎?那麼基因為何會出錯呢?
基因,科學史上最有力也最危險的觀念
然而,讀了《基因》,才深刻地瞭解到對穆克吉而言,追尋答案的動機沒那麼簡單。他出生在印度,他父母那一代最深沉的痛苦之一,是印巴分治後,被迫離鄉背井。然而禍不單行,穆克吉一家落腳的加爾各答(Kolkata),後來因印度教徒和穆斯林互相瘋狂屠殺,從印度最具活力的大城市,淪為一個三四流的破敗城市,迫使他們又要遠走他鄉。
對他們家族而言,傷痛還遠遠不僅於此。幾年前的冬天,穆克吉陪同父親回加爾各答到精神病院探望堂哥莫尼,這讓他回想到他的兩位叔伯拉結什和賈古皆可能患上了精神疾病,加上他父親也曾經兩度出現精神病的症狀,這難免讓他懷疑自己的家族是否帶有遺傳缺陷。如果真是如此,那為何他父親和姐妹會逃過一劫?他們的病有多少是天生的?又有多少是後天的?
《基因》就是他為了追尋眾多問題的答案而寫的,這本書也同時是一本傳記,探討基因的誕生、發展、影響和未來。穆克吉更不忘提醒我們:基於對基因充分的認知,它是科學史上最有力也是最危險的觀念。
遺傳學家經過了長久的瞎子摸象,我們愈來愈清楚基因是什麼,到今天,我們已能在實驗室裡輕易操作基因。儘管中途對遺傳本質的妄想,產生了納粹優生學禍害千萬人的悲劇。
生物其實就是一連串的資訊
孟德爾的發現理應為同一時代的達爾文(Charles R. Darwin,1809-1882)演化論錦上添花,但是,真正為達爾文演化論如虎添翼的「現代演化綜論」(Modern evolutionary synthesis),等到上世紀上半葉才逐步完成。達爾文的堂兄高爾頓(Sir Francis Galton,1822-1911)在對基因一無所知的情況下提出的優生學概念,反而大行其道,並間接導致了日後的種族迫害。時至今日,儘管納粹份子的各種「優生」作為已被世人同聲譴責,但人們仍止不住幻想基因存在「正常」的版本。
聰明絕頂的英國生化學家桑格(Frederick Sanger,1918-2013),發明了定序的藝術和技藝不只一次,而是兩次,而且成果是兩次諾貝爾獎。他先發明了定序蛋白質胺基酸序列的方法,接著挑戰了 DNA 的定序法大獲成功。當定序成為事實,人類基因體計畫就是義務,DNA 定序讓我們能一步一腳印地拼湊出整個基因體的近乎全貌,不過更有野心、好鬥的克雷格.凡特(J. Craig Venter ,1946-)卻提出了散彈槍法來抄捷徑,挾私人企業的資金和政府資助的人類基因體計畫比拚,雙方較勁加上技術革新大幅加速了定序的速度。

人類基因體計畫用了三千多位科學家的人力,花費了上百億美元(大概只夠在小布希政府入侵伊拉克初期燒半個月不到)在我大學畢業那年(2001年)獲得一份所謂的草圖,單單這張草圖就已是個劃時代的里程碑式成就。因為所費不貲,《基因》提到當初有不少科學家擔心如果不好好定序取得最佳品質的資料,以後都定序不到了怎麼辦?
結果科學家們顯然多慮了。在 2007 和 2008 年間問市的次世代定序技術,把定序的成本極大幅度地降低,讓我在這幾年內為幾種鳥類的全基因體定的序列,早已超過了一個人類全基因體(鳥類基因體大約為人類的三分之一)。而且,這幾年定序成本下降的程度,遠比資訊科技產業著名的摩爾定律(也就是每兩年積體電路的成本打五折)快上許多。在這十幾廿年間,我們已經能夠價廉物美地為任何一個人的基因體序列作本有字天書。
有字天書的字義與文法,破解中
人類基因體計畫完成後,我們赫然發現人類其實只有兩萬多個基因,甚至比起一些「低等」生物還少。原來基因的多寡和生物體的複雜度不必然有正比關係。許許多多基因的生物功能和作用仍然是謎團,我們還在努力解讀出這本天書的字義和文法。但是我們也不必妄自菲薄,科學家經過長年基礎研究的努力,確實也了解不少,至少我們知道了,未來很有可能可以用某些基因來預測罹患疾病的機率和藥物的功效。
為了了解基因的功能,在實驗室裡做跨物種的基因轉殖和選殖,是家常便飯,這和其他地方無數個大學實驗室裡天天上演的戲碼一樣,已不足為奇,事實上科學家在上世紀七十年代就開始這麼做了。不過,在進行重組 DNA 實驗的初期,科學界內外都有很激烈的辯論,《基因》一書中即生動地重現了當時的爭議。事後證明基因選殖不僅是有學術研究價值,更能救命,胰島素就是第一個利用重組 DNA 的方法製造的藥物。然而眾人起初都沒料到的是:一旦涉及商業利益,就會有專利爭奪大戰,差一點連基因的序列本身都能用來申請專利。
當我們對操弄基因習以為常時,就有科學家想要為基因突變而罹患罕見遺傳疾病的人進行基因治療。不過很不幸的,首個基因治療案例在不嚴謹的規劃下釀成大禍,導致基因治療在不短的一段時間成了髒話。而轉基因作物(基因改造作物)也在環保人士不分青紅皂白的抹黑下,在很多國家都無法栽種。我們不可否認,有些販售轉基因作物種子的大企業不太良善,不過無差別地對待所有轉基因作物不是明智之舉。

CRISPR 機制為基因編輯創造了革命性貢獻
當我還是窮學生時,要進行轉基因或剔除基因實驗,過程其實是極為複雜的,而且常常不能隨意地修改基因體的序列。一直到幾年前,在細菌細胞內找到一種針對病毒的特殊免疫機制 CRISPR,富想像力的科學家靈機一動把它修改成好用的遺傳學工具,於是我們居然能夠對基因體進行近乎隨心所欲的編輯了!就像用 MS Word 來編輯文字一樣(當然實際過程還是頗複雜的)!這個基因體編輯工具太具革命性了,有興趣可參考《基因編輯大革命:CRISPR 如何改寫基因密碼、掌控演化、影響生命的未來》(A CRACK IN CREATION: Gene Editing and the Unthinkable Power to Control Evolution)。
遺傳學家原本就知道對許多數量性狀而言,環境有著不同程度的影響。更複雜的是,環境對我們基因的影響還會體現在表觀遺傳學上。有些基因的資訊會像電腦儲存檔案時一樣,不太需要用到的檔案會被壓縮起來,也有些像讀教科書劃重點一樣,重要的或常需要用到的基因,會被劃上標記。很多時候,這些壓縮或標記就能讓兩個基因體完全一模一樣的人出現很不同的表現性,果真是「你的基因不是你的基因」。表觀遺傳學方興未艾,有興趣可參考《表觀遺傳大革命:現代生物學如何改寫我們認知的基因、遺傳與疾病》(The Epigenetics Revolution: How modern biology is rewriting our understanding of genetics, disease and inheritance)。
就因為基因是一個既複雜又危險的觀念,人類在探索的過程中走了不少叉路,以為基因決定了一切,或者以為後天決定了一切。前車之鑒就是前蘇聯生物學家李森科(Trofim Lysenko,Трохим Денисович Лисенко,1898-1976),他完全否定了孟德爾遺傳學,自以為是地以為單單後天的刺激就能隨心所欲地改變作物的性狀,還殘酷肅清了幾乎所有遺傳學家,造成前蘇聯大饑荒。
後基因體時代,學習如何解讀和編寫自己
穆克吉透過這些遺傳學史來讓我們對基因進行批判性思考,認識基因的複雜與多樣。《基因》這本好書值得所有關心人類的朋友來讀,對生命科學相關領域的朋友更是如此。雖說穆克吉畢竟是醫學院教授,對人類的關心大過其他物種,因此幾乎未曾提到對基因在農牧業上也有翻天覆地的影響,但,瑕不掩瑜。
基因確實造就了我們個別之間的差異,卻非我們身分的決定性因素,我們還有很多有關基因的知識要學,現在知道的可能連皮毛都算不上。在後基因體時代,我們正在學著如何解讀和編寫我們自己。
延伸閱讀:
- 生物代代相傳的基因到底是什麼?遺傳黑盒子如何被破解?──《基因:人類最親密的歷史》
- 這個會議結束之前,所有人都不准做實驗!管控生物危害的「厄西勒瑪會議」──《基因:人類最親密的歷史》
- 孟德爾如何種豌豆種出了遺傳學?──《基因:人類最親密的歷史》
泛科學八月選書《基因:人類最親密的歷史》,時報出版。
































《運動基因》立體封面72dpi.jpg)