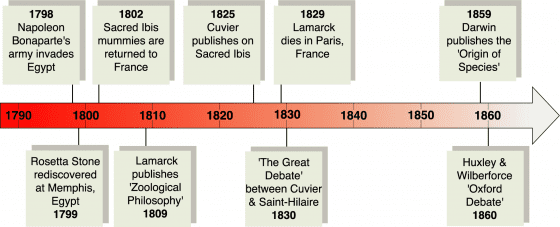
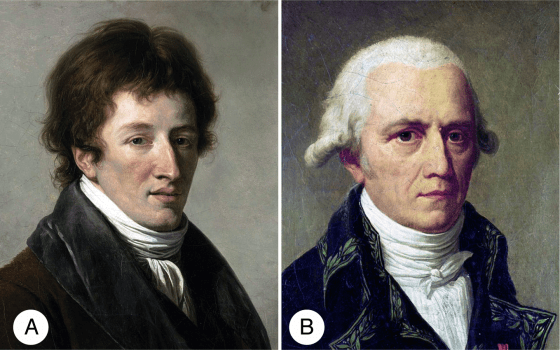從被遺忘的拉馬克開始說起

在正式進入主題之前,我必須先介紹一個人,他的理論價值在生前與死後都被其他大頭學者掩蓋(雖然生物課本有提到他但大家對他的印象可能只剩長頸鹿的長脖子),直到最近研究者才又重新回顧這位仁兄對演化生物學領域發展上的貢獻。我要講的人是拉馬克 (全名:讓-巴蒂斯特·皮埃爾·安托萬·德·莫奈·德·拉馬克, Jean-Baptiste Pierre Antoine de Monet, Chevalier de Lamarck),第一個(廣為流傳的)對生物的形態變化提出可能解釋「用進廢退說」的研究者。
出身法國小貴族家庭的拉瑪克,在現在大名鼎鼎的法國自然史博物館工作。雖然他當時是昆蟲以及蟲類學門(即現今的無脊椎動物)的負責人,但是他更熱衷於自然史的研究。
拉馬克主義:用進廢退說
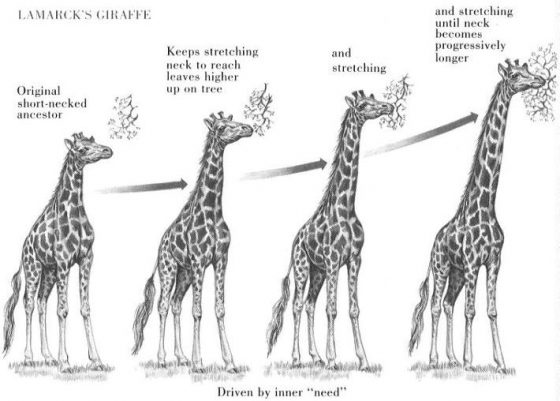
目前被稱為「拉馬克主義」(Lamarckism)的理論中,「生命力」類似於流動的液體,生物的外在環境或內在需求都能促進「生命汁」的流動,而「生命汁」聚集的部位會促成生理的變化,進一步造成生物形態的改變。頻繁的使用會讓該部位更發達,反之就會退化(他當時用的例子就是我們課本看到的長頸鹿示意圖)。
拉馬克稱這種用進廢退為他理論的「第一基本作用」,第二作用的內容則指出,這些在個體身上發生的改變可以傳給下一代的。基於這兩個定律,拉馬克認為,演化是生物為適應環境所產生緩慢、連續且漸進式改變的結果。
拉馬克系統性闡述了生物發生變化及其可能的原因,雖然他提出的理論在後世看來不能解釋許多新發現的現象;但「生物會發生變異」這樣的洞見衍生出了「演化論」的基礎。很不幸的,他的對生物如何演進的觀點並不符合當時奠基於神創論的科學氛圍,因此並未受到重視。
舉例來說,當時他還有一個名氣更響亮的後輩兼同事——古生物學之父居維葉 (喬治·利奧波德·克雷蒂安·弗列德里克·達戈貝爾·居維葉, Baron Georges Léopold Chrétien Frédéric Dagobert Cuvier. 19世紀法國人的取名藝術真是令人佩服啊)。居維葉在當時是比較解剖學的大師,他經手大批動物化石,最有機會觀察到生物型態的變化。居維葉主張動物體內的各種結構都高度相互依賴。他指出,如果動物身體部分結構發生變化,其他部位必須一同演進來適應隨之而來的生理變動,以回到結構運作的平衡。這代表物種的任何形態變異都會促成整體解剖結構的重大改變,進而影響個體的生存,所以物種的變異必然不會發生。
居維葉的理論提出了尖端的解剖學證據支持,也暗合當時的社會與宗教氣氛,所以在拉馬克與居維葉的時代,拉馬克的理論並不是主流。而後深受拉馬克啟發的達爾文與華萊士聯合闡釋了物競天擇的概念,演化學的發展也奠基在達爾文與華萊士(當然達爾文在這方面的想法更加完整)的觀念上發展,這讓拉馬克更加隱於歷史洪流之中。

表觀遺傳學:再度復出的用進退廢說?
好啦!講古時間結束,為什麼要在前面說這樣落落長一大段呢? 這是因為拉馬克「外在環境可以造成個體形態改變並傳給下一代」的概念又被挖出來啦! 近十多年來的研究發現,個體對外在環境的適應確實可以藉由某些機制傳給下一代。
雖然不管是拉馬克、居維葉、達爾文或是華萊士對此都沒有相應的理解,但隨著現代綜合理論(Modern evolutionary synthesis)的發展,我們通常認為「儲存與表達遺傳訊息」是生命的基礎。傳統認為,遺傳訊息儲存在DNA序列中,需要表現時,DNA 會先轉錄為 RNA,再由 RNA 轉譯成蛋白質。這些遺傳訊息,會經由生殖傳遞給下一代。
承載訊息的DNA代代相傳,也在代代傳承中逐漸改變,成為受天擇(natural selection)作用的原料。但是科學家卻漸漸觀察到,遺傳的全貌沒這麼簡單。在恐懼記憶也能遺傳!?、科學家表示,飲食可以影響後代的遺傳訊息中,就談到了所謂的表觀遺傳(epigenetics)。廣義上而言,在不直接改變DNA序列的前提下,通過某些機制,使生物引起可以遺傳給後代的變化,都能稱作「表觀遺傳」。
要怎麼在不改變 DNA 序列之下,還能改變最後的蛋白質成品呢?在概念上,就是要想辦法影響DNA>>RNA>>蛋白質的運作流程。
阻止「完美鋼普拉」成形的 N 種方法

想像一下,住在伽瑪星雲第 58 號行星的 Keroro 軍曹,寫了一份「如何設建造完美的鋼普拉」設計書,打算交給台灣的工廠製作。這份設計書必須先翻譯成中文,交給工廠之後,技師們再根據中文設計書,作出鋼普拉各部位的工程規劃,決定使用素材、製作的順序,以打造真正的鋼普拉。
而你,身為藍星人,為了阻止軍曹的侵略,要如何阻止鋼普拉出廠呢?製造鋼普拉的原始訊息,就是Keroro 軍曹寫的設計書。按表觀遺傳學的作法,可以讓設計書無法被翻譯(不是偷改原文設計書本身),使工廠不能接單;或是燒掉工程規劃,讓工人無法開工。
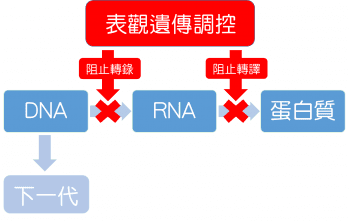
表觀遺傳學的機制中,影響 DNA 轉錄出 RNA,就和偷改軍曹的設計書,使它無法被翻譯為中文類似。這方面主要與 DNA甲基化(DNA methylation),以及組蛋白修飾(histone modification)有關,不過表觀遺傳學的調控機制,不只有降低基因表現一個方向,如組蛋白乙醯化(acetylation),反而會增加基因表現。但是這篇文章會主要著重於 DNA甲基化的介紹。
保留了「彈性」的 DNA甲基化
DNA甲基化是相當常見、調控基因表現的機制,而且其作用很早以前就發現了。它沒有改變 DNA 的序列本身,而是透過蛋白質酵素,如「DNA甲基轉移酶(DNA methyltransferase 1,簡稱為DNMT1),將甲基 (-CH3)接到DNA分子上。
大致上來說,DNA甲基化會抑制基因的表現,被貼上甲基標籤的基因,便無法繼續製造蛋白質成品,因此隨之造成生物的改變。舉例來說,某些癌症的誕生就是因為細胞本來的甲基標籤失效了,才導致原本正常的人體細胞,發展成為惡性腫瘤。
好!所以我們知道,DNA甲基化可以改變基因表現,而不必修改原本的 DNA序列。但是為何會演化出這種機制呢?要是不想要這個性狀,直接丟掉這段 DNA即可,何必在基因序列被複製出來之後,又大費周章的抑制它呢?
這也許跟生物適應的「彈性」有關。
科學家在實驗中利用化學方法,強制移除阿拉伯芥 DNA 上的所有甲基標籤,再與正常的植物個體比較,結果發現沒有甲基標籤的植株,適應外在環境變化的能力下降,換句話說,生理機制的彈性變差了。
一般來說,植物需要有能在短期內,適應環境變化的能力。例如今年春天暖的早,櫻花就會早開,如果天冷的久一點,花季就會推遲;如果種子落在土壤貧瘠的地方,植株要長得小,才能節省資源,以進行有性生殖。
但是沒有甲基標籤的阿拉伯芥,不管環境條件怎樣,都會長出類似的植株。若是在多變的野生環境中,如此會讓個體過度使用,或是無法合理使用可得的資源,而降低成功生長與繁殖的機會。由此觀之,DNA甲基化可以微調基因的表現,以利個體適應環境,增加生殖成功率。
DNA甲基化在演化上另一個優勢是,可以降低族群面對逆境時的反應時間。
基因組在一般的狀況下,本來就會有很多被甲基化抑制的基因,就像一個儲藏室一樣。當身處於逆境時,與其等待天擇花費好幾個世代、踩過一堆屍體,才好不容易篩選出能適應現在環境的個體,還不如直接拿出本來封印在儲藏室的基因,來因應短期的逆境。因此,DNA甲基化也能間接減輕天擇的的壓力,並維持族群個體數量的穩定。

這聽起來好威!但是甲基化的這個特徵,既然根本沒有出現在 DNA 序列中,而每當複製新的 DNA 時,都是全新的分子,那麼甲基化標籤又要如何傳遞,在新的 DNA 分子上重新建立?
其實科學家們也還不確定。根據觀察,DNA 序列上的甲基化標籤,可以在體細胞分裂(有絲分裂,mitosis)時傳遞給新的細胞。在 DNA 合成酶(DNA polymerase)複製出新的一股 DNA 之後,DNA甲基轉移酶會前來作用,現原有的甲基化標籤,加到全新製造的 DNA 分子上。
有性生殖時情況不一樣。過去認為,生殖細胞分裂(減數分裂,meiosis)時,基因組上原本的甲基化狀態會被清空,全部重新開始。但是近年的研究顯示,大部分甲基化標籤會在減數分裂時被「洗掉」,但是爾後隨著胚胎發育,又逐步回復甲基化。
由此可知,想要了解遺傳的奧秘,光是知道 DNA 序列顯然不夠。如果可以大規模的分析生物基因組中的甲基化分布,將有助對生物遺傳機制、甚至醫學領域的探索。
未知的領域:甲基化區域的分布與分析
探測基因組上甲基化分佈位置,目前最常見的方法是亞硫酸鹽定序(bisulfite sequencing)。亞硫酸鹽可使DNA上的胞嘧啶(C)轉變為尿嘧啶(U),不過甲基化的胞嘧啶(5-甲基胞嘧啶)則不受影響。藉由比較處理後序列的差異,實驗者就可以得知,哪些位置的DNA被甲基化。
然而,亞硫酸鹽處理的過程,要經過許多高破壞性的物理、化學手段(如長時間加熱、提高亞硫酸鹽濃度),甚至會導致多達 90% 的 DNA,會在反應過程中被降解。如果樣本一開始的 DNA 總量就不多,舉例來說,材料是古代 DNA的基因組,就可能要考慮其他的分析方法。像是近來有研究者,嘗試比對古代 DNA 和參考用的基因組序列,再利用統計模型,預測古代基因組上甲基化的位置,也是一個可行的方法。
回到拉瑪克,雖然說表觀遺傳領域的建立讓如今拉馬克又從棺材裡被拉出來,讓他稍微享有應得的榮耀,但是表觀遺傳學的詳細機制還沒有完全解讀:我們雖然觀察到現象,但像甲基化這種每個世代都有可能改變的模式(pattern)在試驗設計上本身就有相當的困難。總之,革命尚未成功,同志仍須努力,在甲基化的尋找與分析上,人類還有一段有點長的路要走。
-
- 致謝:感謝神秘友人寒波(盲眼的尼安德塔石器匠格主)對專業內容與文章結構上的建議與修改。本文為作者參與歐盟居禮夫人人才培育計畫創新訓練網絡(Innovative Training Networks, Marie Curie Actions)之子計畫 MicroWine 所撰寫。
參考資料
- Bossdorf, O., Arcuri, D., Richards, C. L., & Pigliucci, M. (2010). Experimental alteration of DNA methylation affects the phenotypic plasticity of ecologically relevant traits in Arabidopsis thaliana. Evolutionary Ecology, 24(3), 541-553.
- Bond, D. M., & Finnegan, E. J. (2007). Passing the message on: inheritance of epigenetic traits. Trends in plant science, 12(5), 211-216.
- Larson, E. J. (2006). Evolution: The remarkable history of a scientific theory (Vol. 17). Random House Digital, Inc..中文版:雀鳥, 果蠅與上帝: 演化論的歷史;台北;左岸文化
- Wiki: 表觀遺傳學
- Wiki: Transgenerational epigenetic inheritance
- 王弘毅老師的網站文章 (拉馬克的演化觀)
- 《中研院週報》外基因體學:DNA 序列外的調控新思維
- 《果殼網》表觀遺傳會不會為拉馬克“平反”?