- 作者/照護線上編輯部
- 本文轉載自 Care Online 照護線上《生殖醫學再進化,胚胎染色體篩檢,提高懷孕成功率,不孕症專家圖文解說》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接

「不孕症其實是文明病!」禾馨生殖醫學中心陳菁徽醫師指出,現在平均結婚的年紀遠比十幾、二十年前晚了七、八歲左右,隨著年紀越大,自然受孕也就越困難。根據統計,約有 15% 的夫妻會面臨不孕症,也就是每七對夫妻就有一對遭遇不孕的問題。
如果夫妻沒有避孕,卻長達一年無法自然受孕,即符合不孕症定義。究竟何時該尋求生殖醫學的協助呢?陳菁徽醫師表示,這需要依據備孕時的年齡來決定,如果是 35 歲以下,努力一年就該找醫師;如果是 35 至 39 歲之間,大概半年即可尋求協助;如果是 40 歲以上的女性,最好是一有備孕需求,就先諮詢醫師,預先進行基礎檢查,了解自身當下的生理功能狀態,再進一步擬定生育計畫。
父母染色體都正常,為何胚胎染色體會異常?
不孕的原因很多,除了功能異常與生殖系統相關疾病外,其中約有六成與染色體異常有關。陳菁徽醫師解釋,習慣性流產常發生於高齡夫妻,其中約有四成原因是因為胚胎染色體數量異常而造成流產,且流產機率隨著年齡上升。
聽到染色體異常,患者通常都會感到困惑,「為何夫妻的染色體都正常,卻會出現染色體數量異常的胚胎?」
這就要從減數分裂說起,人類在產生精子或卵子的時候,細胞會經過減數分裂的過程,從原本 46 條染色體分裂成 23 條,如此一來,當未來精子與卵子結合時,才會形成具有 46 條染色體的正常胚胎細胞。
陳菁徽醫師指出,染色體數量異常的原因,可能發生在產生精子或卵子的減數分裂時期,由於沒有正常分裂成 23 條染色體,所以受精後便會形成染色體數量異常的胚胎。這是在每個人體內都可能發生的狀況,而且隨著年齡增長,發生機率也越高。所以國健署規定,34 歲以上的孕婦,羊膜穿刺及染色體檢查是必要的檢查項目。
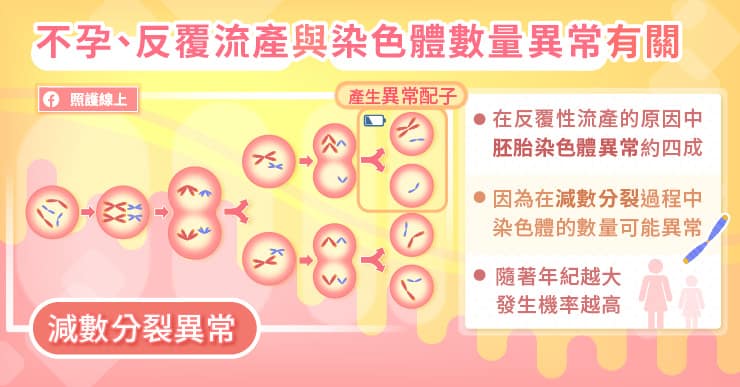
通常減數分裂異常的狀況,較常發生在女性身上,因為女生的卵子自出生之後,就已存放於卵巢中,而男性的精子則是可以不斷製造。陳菁徽醫師比喻說明,減數分裂的過程需要耗費能量,如同電池的蓄電力,當年紀越大,電池的電量越不足,而無法正確地把染色體平均分成兩半,以至於胚胎的染色體異常率,會隨著年紀節節上升。
為了預防胚胎染色體數量異常的問題,目前在生殖醫學方面,試管嬰兒已可運用胚胎著床前染色體篩檢 (PGS/PGT-A) 來提高懷孕成功的機率。
胚胎著床前染色體篩檢(PGS)有效提升懷孕率
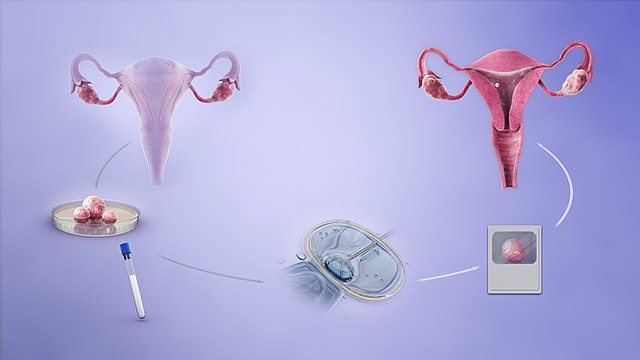
試管嬰兒的過程為分別取出女性的卵子以及男性的精子,使其在體外受精並培養成健康的胚胎,再放回女性的子宮內,增加懷孕的機率。試管嬰兒成功的關鍵在於母體狀況是否良好、是否具有正常染色體數量,以及型態良好的胚胎。
陳菁徽醫師也提及,自然懷孕的成功率約 10% 至 15%,且會隨著年齡增長而下降;若能夠成功取卵並透過試管嬰兒療程的幫助,懷孕成功率可以增加至 4 成;若試管嬰兒療程再加上胚胎著床前染色體篩檢 (PGS/PGT-A),則可以將懷孕成功率進一步提升至大約 7 成。
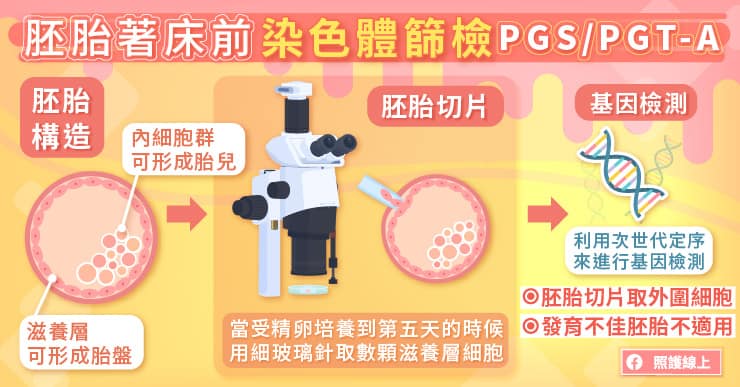
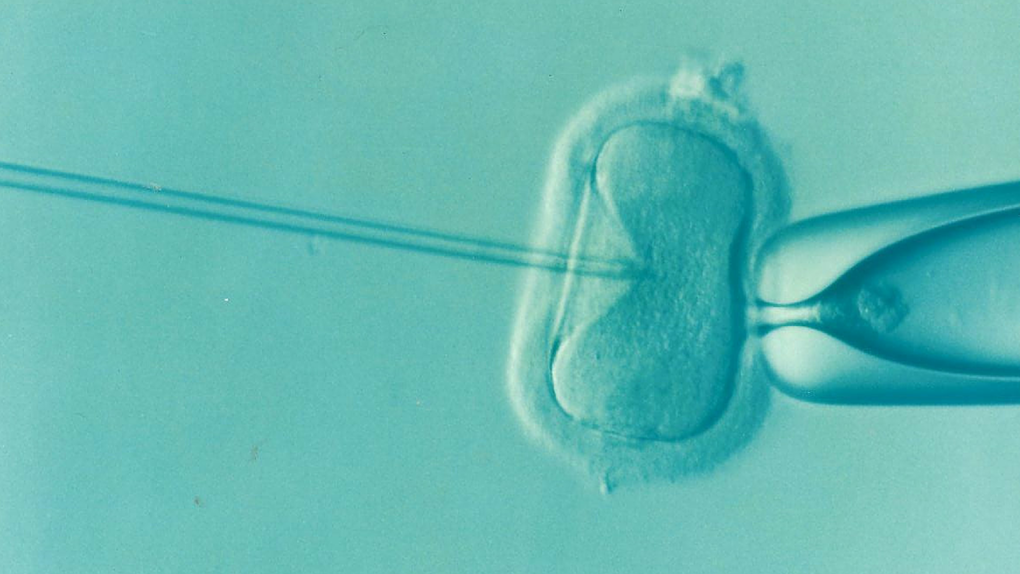
「胚胎著床前染色體篩檢(PGS/PGT-A)」的過程為在受精卵培養至第五天,大約有 200 多個細胞時進行胚胎切片,資深專業胚胎師會在顯微鏡下,使用一根極細的玻璃針,小心取出胚胎外圍的數顆細胞來進行檢測。
陳菁徽醫師表示,胚胎切片取樣的是胚胎最外層的細胞,又稱為「滋養層細胞」,也就是將會發展成胎盤的部位,因此不會影響到未來發育成寶寶的「內細胞群」。
目前胚胎切片技術的發展已經相當成熟,但侵入性的切片取樣仍有約 1% 的耗損風險,主要與胚胎的發育狀況有關。因此,發育不佳的胚胎,並不適合使用胚胎切片進行胚胎著床前染色體篩檢。
替胚胎抽羊水,非侵入性胚胎著床前染色體篩檢(niPGS)
如果想要知道胚胎的染色體狀況,但又不想動到胚胎,有沒有什麼其他的方法呢?
隨著生殖醫學科技的進步,現在已有不需要侵入胚胎的染色體檢測技術,稱為非侵入性胚胎著床前染色體篩檢(niPGS/niPGT-A)。
陳菁徽醫師也提到,因為胚胎在培養液裡生長的過程中,會不斷釋放出微量 DNA 到培養液中,所以我們只需要抽出培養液,取得微量 DNA,不需取用胚胎上任何細胞,此做法很像是在幫胚胎「抽羊水」,然而,培養液中的 DNA 量非常少,所以需要非常精密的技術來進行檢測。
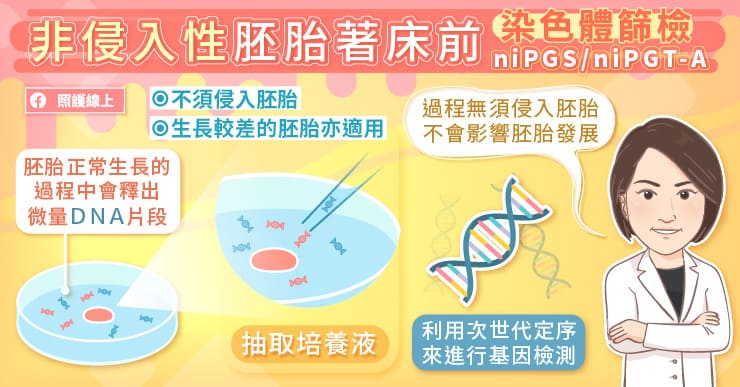
非侵入性胚胎著床前染色體篩檢(niPGS/niPGT-A)是未來的趨勢,陳菁徽醫師說,對胚胎生長狀況較差的媽媽們來說,也是一大福音,更能廣泛使用於試管嬰兒療程的胚胎染色體篩檢,幫助醫師判斷並選擇最有潛力的胚胎進行植入,提升懷孕成功率。
貼心小提醒
陳菁徽醫師同時也分享,「我自己也是病人,一路走來,我能了解在做試管嬰兒的過程中,會很需要家人與醫護人員的支持,夫妻才可以共同渡過這一關。」
不孕症、習慣性流產常與胚胎染色體數量異常有關,目前有多項科技都已隨著生殖醫學的發展而誕生,包括胚胎著床前染色體篩檢(PGS/PGT-A)、胚胎切片,以及非侵入性胚胎著床前染色體篩檢 (niPGS/niPGT-A)等,所以在進行試管嬰兒療程的同時,更能夠協助醫師診斷以及提高懷孕率。
陳菁徽醫師也鼓勵,希望大家都可以互相支持,不要灰心、也不要失望,我們都會陪伴大家一起度過,迎接寶貝的到來!