執行編輯|林婷嫻 美術編輯|張語辰
天然物研究
科學家竟能看到你看不到的?別怕,這不是恐怖故事,而是存在於大自然的「微觀世界」。中研院生物化學研究所的林曉青助研究員,拿出分子模型帶你一同想像:真菌是如何像玩樂高,組合出結構複雜的天然物。

微觀世界
「印象深刻的實驗,反而是最害怕的實驗!」林曉青一句話刺破一般對科學家的幻想泡泡。「高中同學解剖著牛蛙,我就躲在遠遠的地方看……」
要養成一名科學家,有各種途徑,而擅長「天然物(Natural product) 」生物合成研究的林曉青,並非從實驗室裡冒著泡泡的「化學物 X 」溶液中誕生,反而是「最不化學」的場域──家鄉宜蘭的田野。
在宜蘭田野中長大,更精確地說,是還沒被農舍民宿佔據的宜蘭田野中長大,讓林曉青有許多機會接觸自然環境,國小最有興趣的就是自然課。當時的《國語日報》中每天都有自然科學專欄,介紹一些動植物、昆蟲、自然現象,報紙前方林曉青睜著圓滾滾的大眼睛,興味盎然地探索這個世界。

「《人體大奇航》這部卡通是在講人體的微觀世界,把每種細胞擬人化。每一集有不同主題,像是人體被細菌攻擊後,白血球啟動防禦;或是人體吃東西後,醣類及脂肪如何代謝。」雖然觀看的時間已有些久遠,回憶起動畫內容,林曉青仍像個充滿好奇心的小孩。
林曉青小時候想像著我們看不到的微觀世界,長大後也發現很多微觀世界自成系統,例如天然物的合成途徑。
天然合成的產物
要解釋天然物(Natural product)這種有機化合物,可以像教科書搬出一幅幅如外星人秘語的化學結構圖,然而林曉青換了個方式:「避免失憶的銀杏、我們常喝的咖啡,它們對人體有一些特定作用,都是源於天然物。」
這些「特定作用」是天然物的生物或藥理活性,但會如何影響人體,是生產天然物的真菌、細菌、植物們始料未及的。因為一開始它們生產天然物是為了自己與環境,例如趕走環境中的勁敵,或是幫助共生的宿主。
天然物,是生物體互相交流的「工具」,可能是用來相親相愛,或是互相傷害。
例如 okaramine 這種天然物,是一種含氮的生物鹼,有其特殊的「交流用途」。「okara」是日文「豆渣」的意思,「amine」是含有氮原子的化合物。過往的科學家發現 Penicillium 屬的真菌會生長在豆渣上,並生產這種 okaramine 天然物。其他化學家進一步發現, okaramine 天然物具備選擇性的「殺蟲」生物活性。
用白話文來說,該真菌在豆渣上生長、生產 okaramine 天然物,意思就是跟其他會競爭生存的蟲蟲嗆聲:「這裡只有我可以生長!亂闖者格殺勿論!」
微觀世界裡這個熱鬧搶地盤的景象,看在化學家眼中饒富趣味。化學家思考著,這種天然物能否被人工合成出來呢?但至今仍未發展出完整的化學合成方法。想找出方法,首先得了解──究竟生物是運用哪些原子、透過哪些途徑,像玩樂高般蓋出這個天然物結構。
用樂高思維組出 okaramine
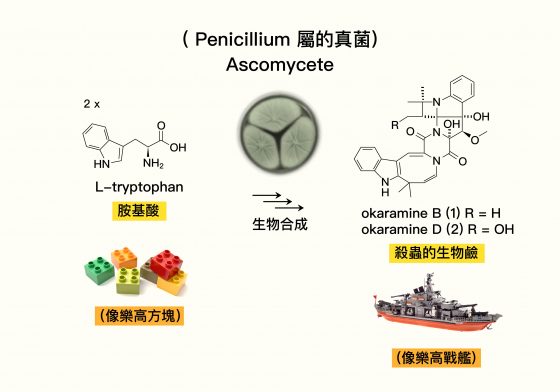
林曉青比喻,研究天然物就像在「玩樂高」。有機原子「碳、氫、氧、氮」等就像一塊塊樂高積木,一開始科學家看到真菌組好了一台樂高戰艦(天然物),可以對抗入侵生存環境的蟲蟲敵人,但卻不知道中間是透過什麼方法組裝。
於是科學家依樣逆推,用相同的「碳、氫、氧、氮」等樂高積木,在實驗室中推測中間發生了什麼事,才能組出這台樂高戰艦。
距今一百多年前開始,科學家在實驗室中試著用「化學合成」的方法,也就是用高反應性的化學物質、在高溫或高壓的反應條件中進行化學反應,嘗試組合出複雜結構的化合物。
而自然界的生物體中,存在各種功能的「酶(enzyme)」,用來催化各種化學反應。不同生物體有自己的基因序列,酶具有什麼功能都寫在 DNA 中。隨著近年來「基因體定序」技術的進步,科學家有機會知道自然界是以哪些基因、哪些酶進行生物合成反應,產生各種化合物。
除了基因組探勘,再加上基因剔除、異源性表達、化學結構解析等技術,讓林曉青團隊得以進入微觀的世界,觀察生物體內負責合成化合物的關鍵基因、關鍵酶是什麼,於合成過程中發揮什麼功能。並再於模仿自然界的常溫、一般氣壓環境下,在放了受質、輔因子的水溶液中,試驗催化生物合成反應。
「我們的生物合成方法,不同於早期的化學合成方法,不需要用到高反應性、毒性較強的化學物質。」林曉青說明。
林曉青想要了解的天然物合成方法,是自然界實際使用的方法。
林曉青拿出像樂高玩具的 okaramine 化合物模型,可以看見黑色的碳原子、藍色的氮原子、紅色的氧原子如何鍵接。如下圖黃圈處,真菌在組合 okaramine 時,透過 OkaE 這種「酶」催化合成反應,像樂高關節般「咔咔」地,將原本分離的兩個碳原子組合起來,與另一個碳原子、氮原子組合成四環。
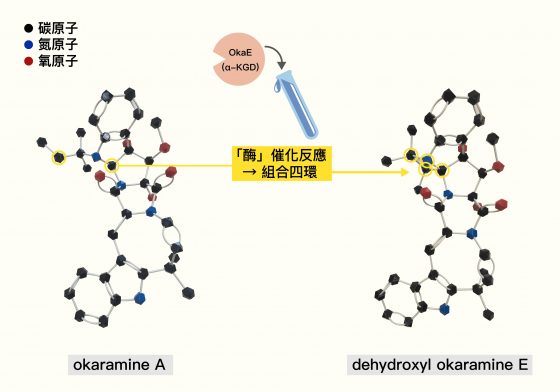
林曉青拿著 okaramine 化合物模型,徒手嘗試組裝兩個碳原子時,費了點力穩住結構才能將模型接上。「用手就需要點力氣了,在真菌體內要接上四環,也需要點能量,而自然界就派出 OkaE 酶負責催化這個過程。這是我們團隊最先發現的喔!」林曉青露出開朗的笑容。
自然真理只有一個
雖然天然物的催化酶已知仍有限,自然界的生物合成途徑也尚未被透徹了解,但林曉青認為這正是研究天然物的樂趣:還有好多未知等著被發現。
「而且研究天然物,會覺得…..真理只有一個!」眼前的林曉青,瞬間變成眼鏡反光的柯南。
某個酶的功能,用各種實驗證明結果都會是同一個,這是一個不變的定律。
團隊努力研究天然物的另一個動力,是未來的藥學潛能。以用於治療癌症的紫杉醇(Paclitaxel)為例,紫杉醇也是一種天然物,除了從太平洋紅豆杉(Taxus brevifolia)樹皮可分離取得,後來發現由另一相近樹種(Taxus baccata)的葉部可分離得到中間物,進而以半合成(semi-synthesis)方式合成紫杉醇。然而天然生產的量非常少,造成當時研發成為臨床用藥的瓶頸,並延長了藥物發展的時程。
若能了解大自然合成天然物的途徑、參與的基因與酶等知識,未來可望由合成生物學的方式進行製備、並取得藥物來源。
大量人工合成天然物,會影響自然環境嗎?林曉青慎重地思考後回覆:「不同天然物有不同的生物活性,若決定大量做出某種有機化合物,要先想清楚做的目的。」並補充道,天然物原本就合成於自然,自然必定也存在對應的生物降解機制。
即使肉眼看不到,或許現在窗外那棵樹、身邊附近的某個真菌,在微觀世界正熱鬧地玩著「樂高」,生產各種天然物。
延伸閱讀:
- 林曉青的個人網頁
- 林曉青的實驗室網頁
- 綠色化學的新途徑:新穎催化酶合成生物鹼天然物
- Lai CY, Lo IW, Hewage RT, Chen YC, Chen CT, Lee CF, Lin S, Tang MC, (Lin HC) (2017-08) Angewandte Chemie-International Edition 56(32), 9478-9482 “Biosynthesis of Complex Indole Alkaloids: Elucidation of the Concise Pathway of Okaramines.”
本著作由研之有物製作,原文為《真菌也會玩樂高?還組合出「天然物」戰艦!》以創用CC 姓名標示–非商業性–禁止改作 4.0 國際 授權條款釋出。
本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位