在生物研究中為了去了解在老鼠體內特定基因的功能或去表現變異的基因,基因編輯早就已經是家常便飯了。目前最為人所熟知的基因編輯技術分別為 TALEN(Transcription Activator-Like Effector Nuclease)[1]、ZFN(Zinc-finger nucleases)[2] 以及 CRISPR [3] ,而基因編輯其實還有著更大的潛力可以應用到人類疾病的治療上。科學家已經有過幾次在人類細胞中編輯基因的成功實驗案例,下一步便是直接應用到病患身上。
除了在基因編輯的進步之外,做為其載體的工具也需要大大的提升。病毒在基因治療的歷史中佔據極為重要的部分,然而其歷史卻是以令人惋愕的死亡案例開始。
西元 2000 年在基因治療領域中作為領頭羊的賓夕法尼亞大學(the University of Pennsylvania)的教授 James Wilson 公開嘗試了第一次人體基因治療。18 歲的 Jesse Gelsinger 當時需要治療遺傳性肝臟疾病,因此 Wilson 注射帶有基因編輯片段及工具的腺病毒(adenovirus)到他的體內。如果試驗成功,便可以將此方法用在具有更嚴重症狀的孩童身上。但事與願違, Gelsinger 在注射後身體便開始產生強烈的免疫反應,並在最後因器官衰竭及腦死而過世。這戲劇性的基因治療開端讓科學家和醫生重新檢視病毒做為載體的可行性,並更努力研究以找到人類基因治療的成功關鍵。[4]

經過多年的研究及嘗試,今年(2017)十一月有幾個案例替人類基因治療歷史增添了些許勝利的記號。
遺傳性黏多醣儲積症:用基因編輯讓肝臟細胞成為酵素工廠
黏多醣是由多醣和蛋白質所組成的大分子,學名為醣胺多醣(glycosaminoglycans)[5],是做為身體結締組織的主要成分。當身體無法表現特定的酵素時,黏多醣便會大量堆積在細胞內造成細胞死亡。這種疾病被命名為遺傳性黏多醣儲積症 (mucopolysaccharidosis),不同的黏多醣儲積症會造成相異的醣胺多醣降解產物堆積,這是由於缺乏不同的酵素所導致的,其型態可分為六型,除黏多醣儲積症第二型為X染色體連鎖之外,其餘各型為體染色體的隱性基因遺傳。黏多醣儲積症的症狀有腹股溝疝氣、脊柱變形、智能退化等,病患多在孩童時期便病逝。
目前的治療方式為舒緩病人症狀、注射合成的酵素或骨髓移植,但這些方法不是無法治標就是取得機率非常低。現年四十四歲的 Brian Madeux 帶有輕微的黏多醣儲積症二型,別稱韓特氏症候群 (Hunter’s syndrome),渴望揮別時常跑醫院的痛苦生活。因此,Brian 同意接受 Sangamo Therapeutics 生技公司提供的臨床試驗,在十一月時接受了基因改造治療。
不過 Sangamo Therapeutics 不是使用基因編輯的方式直接修復全部有瑕疵的細胞,而是利用基因編輯的方式將酵素基因重置到肝臟細胞的白蛋白(albumin)啟動子附近。這項治療的重點在於使用這些改造的肝臟細胞當作韓特氏症中缺失酵素的「製造工廠」。

Sangmamo 的執行長 Sandy Macrae 希望能夠透過一次的基因編輯治療,也就是三小時的血液輸入,來讓病患的肝臟細胞能夠在接下來的幾年中不斷的穩定製造出這些酵素。不過這仍然有個瓶頸,不論是直接注入這些酵素或是透過肝臟細胞製造這些酵素,他們仍沒有辦法通過血腦屏障(blood-brain barrier)而到達大腦中。因此,即便是新的療法,仍然沒有辦法阻止韓特氏症患者的大腦損傷。
另外,此實驗性治療中是使用腺相關病毒(Adeno-associated virus,AAV)把 ZFNs 和酵素基因的 DNA 植入肝臟細胞,因此在某些病患中有機會誘發嚴重的發炎反應。即便如此,這仍然是第一個直接在病人體內進行基因編輯的試驗,而科學家會持續追蹤 ZFN 是否有脫靶效應造成癌化的可能。未來,Sangamo 會將肝臟工廠基因治療的概念應用在 B 型血友病(Hemophlia B)以及黏多醣儲積症第一型(Hurler syndrome)上。「當你證明了這個方法是可行的,且沒有其他嚴重的副作用時,你就可以將這方法應用到其他的疾病上面,只要將插入的基因換掉就行了」病毒學家 Hammarskjold 說:「這是個相當有前景的方法,我們不需要每次針對不同的疾病都要重頭來過了。」
脊髓性肌肉萎縮症:利用病毒讓 AAV9 能突破血腦屏障
三歲的 Evelyn 開心的在家裡蹦跳和唱歌,這看似平凡的場景卻是 Villarreal 夫婦得來不易的禮物。Evelyn 其實有一個姊姊,但是在十五個月大時便因為脊髓性肌肉萎縮症(Spinal Muscular Atrophy type 1)而病逝。脊髓性肌肉萎縮症是身體缺失 SMN(Survival of motor neuron)蛋白[6]的遺傳性疾病,會造成嬰兒癱瘓並且活不過兩歲。而 Evelyn 也不幸的患有此疾病,但是 Villarreal 夫婦努力尋找治療方法要救活他們第二個的女兒。幸運的是他們找到在美國俄亥俄州有針對此疾病的基因編輯臨床試驗,並決定讓 Evelyn 在八週大時接受治療。

Evelyn 是此基因治療中一個相當成功的案例,全部有 15 個接受治療的嬰兒都能活到 20 個月以上,並且多半能夠坐立,這項結果發表在《新英格蘭醫學雜誌(NEJM )》上。雖然目前已經有認證的 SMA1 藥物,但是每四個月就要重新注射一次。因此,使用基因治療的好處便是能以一次性的療程將缺失的 SMN 重新在細胞內表現,而此療程已經通過美國食品藥品監督管理局(FDA)核准。

SMA1 的這項研究的突破是在於使用特別的病毒載體作為基因治療,而這樣的治療方式可以使要嵌入的基因能順利通過血腦屏障。研究團隊發現高劑量的 AAV9 可以進入所有的細胞中,包括肌肉、心臟,甚至是通過血腦屏障並感染神經細胞。這對造成腦神經損傷及脊椎退化的疾病是一大福音,如今科學家終於可以透過將病毒注入血管便能使基因編輯工作送達中心神經系統。
除了直接靜脈注射之外,若將此病毒直接打進脊椎裡可以減少病毒的用量並提高感染神經細胞的效率,防止其他併發症產生。此團隊現在更進一步的在找其他更容易感染神經細胞的 AAV,並且希望在下一步可以應用到黏多醣儲積症的腦神經損傷的治療。
表皮溶解水皰症:皮膚幹細胞基因治療
義大利的幹細胞學家和醫生 Michele De Luca 致力於找出治療表皮溶解水皰症(epidermolysis bullosa,台灣俗稱泡泡龍)的方法,他曾在 2006 年成功移植基因編輯過的小面積皮膚到病患身上。表皮溶解水皰症源自於 lamin 基因突變,使得負責連接表皮和真皮的蛋白質異常而使表皮容易脫落而產生長期的傷口甚至感染。有些會導致嬰兒時期的早夭,有些病患則會得到嚴重的皮膚癌。目前唯一的治療就只是每天清理傷口以防細菌感染,而且這過程相當的痛苦。
但是更大的挑戰在 2015 年時來臨, De Luca 收到來自德國急切的請求,有一名表皮溶解水皰症的小男孩幾乎失去他所有的皮膚,並且處於多重感染及敗血症的狀況下。於是 De Luca 團隊便迅速的展開首次大面積皮膚的幹細胞治療。他們先取得了相當於郵票大小的病患皮膚,並且使用反轉錄病毒(retrovirus)感染裡頭的皮膚幹細胞進而置換 LAMB3 基因。然後將這些細胞培養到 50-150 cm2 大時,再將這些皮膚細胞重新移植到病患身上。
令人高興的是一個月後,病患身上八成的皮膚都能夠產生出強韌且有彈性的表皮層,並且移植的區域在手術後兩年都沒有水皰產生;這項結果在今年十一月時被發表於 Nature。此後 De Luca 團隊的持續追蹤基因編輯過的皮膚,他們發現大部分的移植皮膚細胞都漸漸消失,但是有一小群細胞(holoclones)仍然長存並產生新的表皮出來。
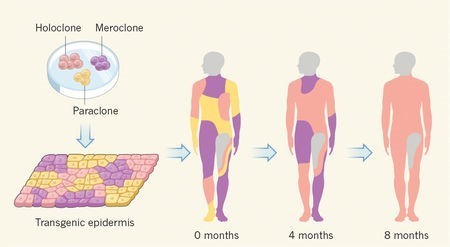
但是移植的做法也有限制,像是食道等區域就沒辦法進行此項治療,而此案例的男孩幸運的沒有食道上的問題。另外,大部分科學家實際上不敢使用反轉錄病毒,因為有可能導致癌症的風險,但是現在的研究並沒有發現基因編輯影響到致癌基因。因此,這項研究說明未來可以把治療皮膚遺傳疾病的重點放在滋養這些幹細胞之上。
新的潛在道德問題:未來該如何定義「正常人」?
隨著基因治療的技術漸漸的成熟,帶有致命性遺傳疾病的病患皆獲得治癒的可能性。但誰可以使用基因治療?標準要怎麼訂定?基因治療目前定價相當的昂貴,最後是否只有富有的人才能取得治療?另外,現在的基因治療皆針對體細胞(somatic cell)做基因編輯,若將此技術應用在生殖細胞上便會改變後代的基因,其改變的可能為致命的遺傳疾病或是身高外表特徵等。
如果未來基因編輯變成人人觸手可得的醫療方法,那基因編輯過的「完美人類」會成為新的「正常人」標準嗎?
注解
- 注 1:全名「Transcription Activator-Like Effector Nuclease」,是一種人工改造的限制性內切酶,將 TALE(Transcription Activator-Like Effector),由植物致病細菌 Xanthomonas 所分泌具有轉錄激活功能的蛋白的 DNA 結合區與限制性內切酶(Fok I)的 DNA 切割區融合而得到。經由設計並組裝好的 TALEN 質體在細胞中表達,可專一的與基因靶位點結合,形成二聚體切割 spacer 區域雙股 DNA,並藉此達到基因剔除的目的。
- 注 2:鋅指核酸酶(Zinc-finger nucleases,ZFN)同樣是一種人造基因編輯工具。
- 注 3:全名為 clustered regularly interspaced short palindromic repeats/CRISPR-associated proteins
- 注 4:「基因療法的悲劇──從基因療法首次引起的死亡案例中,科學家學到了什麼?」,科學人雜誌。
- 注 5:構成骨骼、血管、皮膚等人體重要器官的主要成份之一。另外,它也支撐細胞結構的完整性及提供細胞移動的孔道。
- 注 6:SMN蛋白在調節基因表現及運動神經元的發育上佔有相當重要的地位。
參考資料
- Jocelyn Kaiser, A human has been injected with gene-editing tools to cure his disabling disease. Here’s what you need to know, Scicence Nov. 15, 2017
- Jocelyn Kaiser, Gene therapy’s new hope: A neuron-targeting virus is saving infant lives, Scicence Nov. 1, 2017
- Kelly Servick, A boy with a rare disease gets new skin, thanks to gene-corrected stem cells, Scicence Nov. 8, 2017