這裡有必要檢視一下,這種壯闊的物理理論構思,在生物實務作用中如何施展。地球此處的生命,以一種稱為腺苷三磷酸(adenosine triphosphate)的分子(縮寫為 ATP),做為基本的動力電池。這裡我們所說的「電池」從廣義來看,意指某種能儲存自由能量供後續使用的事物。
設想 ATP 是種受壓擠的彈簧,那麼它可以在壓力釋開時彈開,使用它的能量來做有用的運用。結果也確實有用:儲存在 ATP 裡的自由能量,用來收縮肌肉、運輸分子和細胞到全身各處、合成 DNA 和 RNA 與蛋白質,經由神經細胞發送信號,還有其他不可或缺的生化機能。生物體能四處移動並且自我存續,ATP 扮演了關鍵角色。薛丁格也點出,這兩項能力就是生命的定義特徵。
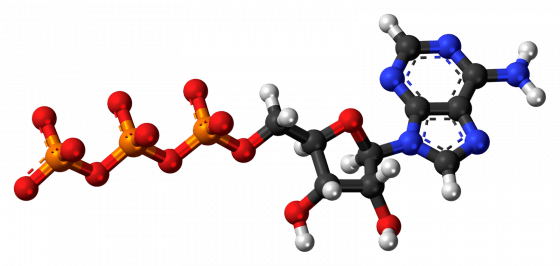
能量從 ATP 釋出,通常發生在有水(H2O)的情況下。ATP 的三磷酸各含一顆磷原子(P),周圍是氧原子(O),見下頁圖左側——當中一個磷酸從 ATP 分離出來,我們就剩下腺苷二磷酸(adenosine diphosphate, ADP)。接著該磷酸鹽便與附近水分子的一顆氧原子連接,而剩下的 OH 便會與 ADP 結合。
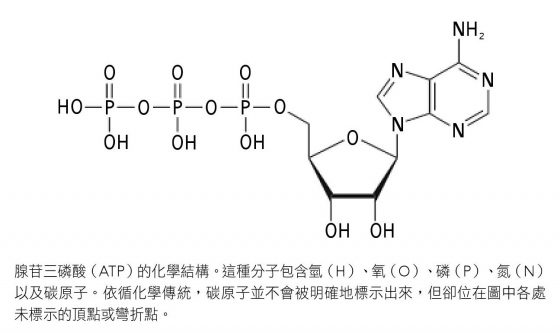
最後這些產物的總能量,低於原始的 ATP 分子;因此該歷程同時釋出自由能量(用來進行某種有用的生化功能)以及無序的能量(熱)。所幸,ATP 是種可充電的電池,透過身體接著使用外來能源,好比陽光或糖,把磷酸鹽和 ADP 轉換回水和 ATP,ATP 又可以再次投入做功。
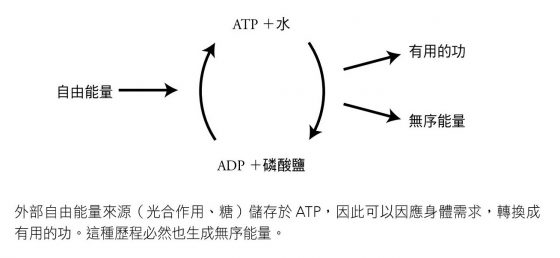
發生在你體內的所有能量活動,都會消耗龐大數額的 ATP;普通人每天運轉消耗的 ATP 數量,等於他的身體質量。當你屈曲二頭肌來舉起啞鈴或一杯酒,來自 ATP 而用來收縮你肌肉的能量就會猛然釋開,促使你肌肉纖維所含的蛋白質相互滑動。構成 ATP 的個別原子並不會耗盡;各分子只會分裂然後又重組,每天發生數百次。
ATP 從何而來?
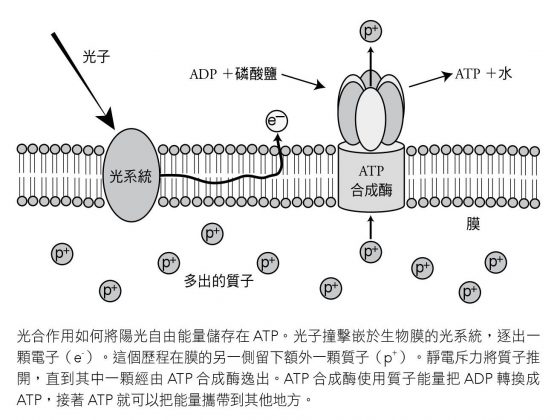
從低熵 ADP 製造出 ATP 的自由能量是從哪裡來的?它的最終源頭是太陽。當某個植物或某微生物的葉綠素分子吸收可見光的光子,它的能量會鬆動一顆電子,這時就會發生光合作用歷程。高能量電子經由名叫電子傳遞鏈(electron transport chain)的連串分子穿過一道膜,導致膜的一側所含的電子數大於質子數,形成一種電荷梯度(electrical gradient),且一側帶淨負電,另一側則帶淨正電。
這就是生命灌注能量的基本做法;膜的一側所含質子彼此互推分開,有些經由一種稱為 ATP 合成酶(ATP synthase)的酵素逸出。試圖逸出的質子最終進入了合成酶,為它供應能量,而讓 ADP 合成為 ATP,這種歷程稱為化學滲透作用(chemiosmosis)。其中有些能量免不了要化為無序能量,並以低能量光子形式還有周遭原子的熱量顫動(熱)的方式釋出。

你我都不親自進行光合作用。我們的自由能量並不直接取自太陽,而是得自葡萄糖和其他糖類以及脂肪酸。我們有種微小胞器稱為粒線體,這就是細胞的動力機房,它使用固鎖在這些分子中的自由能量,把 ADP 轉換成 ATP。不過,我們取食的這些糖類和脂肪酸所含的自由能量,追根究底仍是經由光合作用得自於太陽。
這種基本配置對於地球此處的生命似乎一體適用。目前已擬出一個專有名詞,專門描述 ATP 合成酶透過流經其中的質子來驅動的作用,稱為「質子驅動力」(proton-motive force)。這機制在 1960 年代由彼得.米切爾(Peter Mitchell)和珍妮芙.莫伊爾(Jennifer Moyle)兩位英國生化學家發現。米切爾是個有趣的人物;他因為工作壓力釀成嚴重健康問題,只能辭去學術崗位的職務,最後在一處叫做格林之家(Glynn House)的地方,建立了一個私營實驗室。他獲頒 1978 年諾貝爾化學獎,嘉許他提出質子驅動力經由化學滲透作用促成 ATP 合成的理論。
布朗氏力的驅動
細胞是生命的基本單元;那是一批具功能性的子單元和胞器,漂懸在一種黏性液體裡面,整個由一層細胞膜包覆。沉浸於技術性工業社會的我們,往往會把細胞想像成微小的「機器」。不過真實的生物系統和我們習慣應付的人造機器之間的差異性,與雙方的類似性同樣都很重要。
這些差異有很大部分根源於一項事實,那就是機器一般都是針對某個特定目的而製造。基於這事實,機器往往只擅長處理它們的派定目的,此外就別無長處。設計往往是針對特定目標,不具有彈性,一旦事情出了差錯——你汽車的一個輪胎爆胎,或者你的手機電池用光——機器就完全不靈了。有機生物體則是歷經歲月發展成形的,心中沒有特定目的,一般較具彈性,能因應多重目的,還能自行修復。
細胞不只能耐受混沌,它們還駕馭混沌。它們沒有選擇餘地,這只要看看微生物學的發生環境就知道了。
我們的人類尺度世界比較寧靜祥和又可預測。在好天氣的日子拋球,你可以很有自信地估算球會飛多遠。相較而言,細胞是在幾十億分之一公尺的奈米尺度運作,那個世界的狀況是由隨機運動和噪音所支配——生物物理學家彼得.霍夫曼(Peter Hoffmann)稱這種現象為「分子風暴」(molecular storm)。單憑一次大混亂中的普通熱量顫動,我們體內的分子每秒互撞數兆次,就可讓尋常的暴風雨自慚形穢。放大到人類尺度想像一下,這就像是住在能與細胞分子風暴相提並論的氣候環境中,嘗試在不斷被其他球體轟擊的情況下拋球,而那些球體攜帶的能量,數億倍於你的手臂所能傳送的能量。

這樣的環境,看來並不適合舉辦任何微觀的運動賽事,或是從事細胞生態系的任何細密作業。細胞怎麼有辦法在這種情況下進行這樣的有組織活動?
這種大混亂之中有許許多多能量,不過全都是無序能量;並不能直接用來從事諸如拉動肌肉或發送養分到全身各處等工作。周遭分子處於一種近似平衡態,彼此隨機碰撞彈開。不過,細胞能利用匯集在 ATP 裡的低熵自由能量——不只直接投入工作,還能凝聚周遭介質裡的無序能量。

考量一個棘輪—齒偏向一側的齒輪。讓該棘輪承受往復的隨機顫動——布朗氏力(Brownian force),名稱得自植物學家羅伯特.布朗(Robert Brown)。他在 19 世紀早期,指出細小灰塵顆粒漂懸水中時,往往依循不可預測的方式四處移動,這種現象如今我們歸因於其他個別原子和分子對它們的持續轟擊。布朗棘輪本身一般不會偏向任一方向運動;它以不可預測的方式往復漂移。
不過,想像我們棘輪的齒並不固定,而且我們可以從外部予以控制。當棘輪朝向我們希望的方向運動,我們就把角度壓低,讓它容易移轉過去;當它朝另一方向移動,我們就放大角度,讓它較難移轉。這樣我們就得以將隨機的不定向布朗運動,變換成有定向的有用運輸作業。當然了,這需要某種外力介入,而且那種外力本身必須是低熵且遠離平衡的。
這種布朗棘輪是生物細胞內部眾多分子馬達的一種簡單模型。沒有任何外部觀察者會為了因應特定目的而改變分子形狀,而是有自由能量由 ATP 攜帶四處移動。ATP 分子能與細胞機具的移動束縛在一起,在恰當時機釋出能量,從而容許朝一個方向的變動,同時抑制朝向另一方向變動。在奈米尺度完成工作,完全關乎如何駕馭你周遭的混沌。
熱力學第二定律萬歲
薛丁格關於生命有機體消耗自由能量來維持其結構完整性的寫照,精彩顯現於真實世界的生物學。太陽為我們送來自由能量,那是相當高能量的可見光光子。那些光子由植物和單細胞生物體捕獲,用來進行光合作用,並製造 ATP 供自己使用,此外還有糖與其他可食化合物,這些都能儲存自由能量,並供動物運用。這種自由能量能用來保持生物體的內部秩序,同時讓它運動、思考並做出反應,也就是讓生物有別於無生命事物的所有事項。我們一開始從太陽能入手,現在它一路逐漸劣化,轉變成熱形式的無序能量。那項能量化為較低能量的紅外線光子,最終輻射回歸宇宙,熱力學第二定律萬歲。
這段故事的基本成分,我們討論核心理論時已見過了:光子、電子和原子核。有鑑於我們的日常生活和現代物理學似乎相隔遙遠,因此瞭解我們如何進食、呼吸和生活,我們才有辦法和它底層的粒子與力面對面接觸。
- 本篇選自本書第 30 章
本文摘自泛科學2017年11月選書《詩性的宇宙:一位物理學家尋找生命起源、宇宙與意義的旅程》,八旗文化出版。