文/何翰蓁|慈濟大學醫學系解剖學科副教授。熱愛形態學,以研究精子細胞內各胞器變化開啟研究生涯,目前觀察對象小至細菌,大至人體。著有《我的十堂大體解剖課》。
電子顯微鏡的世界只有黑白?
顯微鏡的發明,讓我們得以觀察人眼難以分辨的微小世界。光學顯微鏡以可見光成像,好處是可以利用不同顏色的染劑讓組織不同結構呈現不同顏色,人眼容易判別;缺點則是解像力有限,小於 0.2 微米的構造,細節難以清楚在顯微鏡下呈現。電子顯微鏡以電子成像,好處是解像力至少比光學顯微鏡好上 1000 倍,奈米等級的構造能清晰辨識;缺點則是電子顯微鏡下的世界只有黑白。
因為利用電子成像,偏偏人眼無法接收電子訊號,於是電子顯微鏡的設計中,需要將電子訊號轉換成人眼可接收的光訊號,我們才能觀察到樣本在電子束照射下呈現出來的影像。只是,電子訊號轉換成光訊號時,單純以光強度顯示差異:較多電子訊號的地方較亮,較少電子訊號的地方較暗,也因此,影像通常以灰階、也就是黑白的方式呈現。
黑白與彩色影像在細胞或胞器形態的研究上或許沒有太大的差別,例如:雙凹圓盤狀的紅血球不會因為顏色不同而呈現不同形狀。然而,光學顯微鏡的一大利器是可以配合不同顏色染劑的使用,藉由色彩的輔助使得不同構造間的區別變得容易許多,同時也使得光學顯微鏡下的世界繽紛多彩。
近年來螢光蛋白的發現與改良,更增添了光學顯微鏡應用的廣度與深度。例如:利用免疫螢光技術標定細胞內特定的分子,或將特定蛋白質基因序列前加上螢光蛋白的序列,不止能觀察蛋白質在細胞內分佈的情形,甚至還能以螢光追蹤該蛋白質的動態。尤其螢光染劑有多種不同顏色,使我們得以在同一切片下同時標定,並觀察多種帶有不同色彩訊號的蛋白質。

魚與熊掌能否兼得?
然而,光學顯微鏡的解像力有限,即使有了螢光的輔助,很多時候還是必須借助電子顯微鏡,才能釐清發出螢光的區域到底有什麼細微結構,或發生什麼變化。「如果電子顯微鏡能像光學顯微鏡那樣,可以同時觀察、分別出不同的螢光,那該有多好!」這是許多研究人員都曾有的願望,雖然大家也都清楚電子顯微鏡下看不到可見光的顏色,切片雖然也可透過染色增加對比,但染的是重金屬染劑,藉由蛋白質或核酸等物質與重金屬結合後,產生深染黑灰色的電子緻密區(electron-dense),以便和背景等淡染灰白色的電子透明區(electron-lucent)做區隔。
2016 年去世的錢永健博士以他在螢光蛋白的研發及對相關領域的重要貢獻,於 2008 年獲得了諾貝爾化學獎,他的研究團隊除了擴增螢光在不同技術的應用上,也試圖找出能在電子顯微鏡下觀察螢光的方式,目的除了希望以高解像力的電子顯微鏡進一步確認光學顯微鏡下的發現,更希望能使電子顯微鏡下的影像也呈現不同顏色,使研究人員能更加清楚的辨識不同結構。
馬蘭托(Robert Maranto)是第一個成功在電子顯微鏡下觀察到螢光分子的科學家。早在 1982 年,他率先在光學顯微鏡下觀察注射了螢光黃(Lucifer yellow)染劑的神經細胞,接著將切片浸泡在含二氨基聯苯胺(diaminobenzidine, DAB)的溶液中,並以藍光照射切片,被激發的螢光黃分子釋出自由基促使 DAB 氧化,由於氧化的 DAB 形成的沉澱物可以與重金屬鋨酸結合,因此成功在電子顯微鏡下看到原本螢光黃所在區域出現許多電子緻密的沉澱物。
依據此原理,包含錢永健博士在內的許多研究團隊在接下來的數年間不斷改良此技術,於是有了分子更小、更容易注射到細胞內的螢光染劑;也開發出光氧化後能產生更多沉澱物的螢光染劑等,使螢光轉換成電子緻密沉澱物的效率更好,間接達成在電子顯微鏡下觀察螢光的願望。
新技術遇上的困難
可是,不同顏色的螢光在轉換成電子緻密沉澱物後,基本上全變成黑色,無法區別。前面提過,光學顯微鏡的一大優勢是能在同一切片上,以不同螢光顏色區別不同分子或構造,這在電子顯微鏡下相對困難。雖然在電子顯微鏡下也有辦法標定及觀察特定分子,利用免疫標定,使帶有黃金顆粒的抗體與標定分子結合上,因為黃金顆粒電子密度高,容易在電子顯微鏡下觀察到,加上可以選擇特定不同大小的黃金顆粒,所以要同時在一片切片上標定兩種以上分子,技術上也是可行的。
然而,攜帶黃金顆粒的抗體分子較大,在已固定的細胞或組織間滲透效果不好,限制了使用的範圍。雖然這問題可以改用上述氧化 DAB 產生電子緻密產物的方式解決,也就是讓抗體帶有可氧化 DAB 的染劑或酵素,或是直接以基因轉殖方式,使欲觀察的蛋白質與螢光蛋白結合,這些方法解決了大分子不易滲透的問題,但是原來電子顯微鏡下的影像就是黑白,沉積的產物也是黑色,反而增加了辨識的難度。
替細胞「染色」的新解答— 鑭系元素
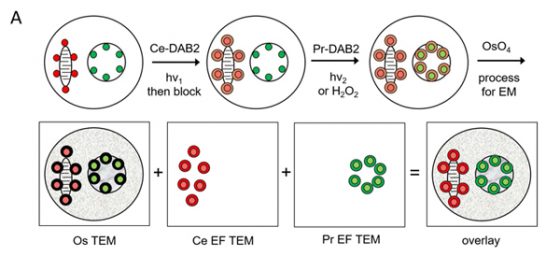
去(2016)年 11 月由錢永健博士研究團隊發表在 Cell Chemical Biology 的文章,則提供了解決方式。研究團隊合成了帶有特定鑭系元素的 DAB,如鑭–DAB、鈰–DAB、鐠–DAB 等,以專一性螢光染劑滲透或基因轉殖方式,讓欲觀察的細胞內結構或蛋白質帶有不同的螢光,接著在螢光顯微鏡下,先激發第一種螢光,加入第一種帶鑭系元素的 DAB,使沉澱產物中有第一種鑭系元素;適當的去除未反應物後,再激發第二種螢光,加入第二種帶鑭系元素的 DAB,使沉澱物中有第二種鑭系元素沉積。
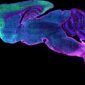
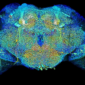
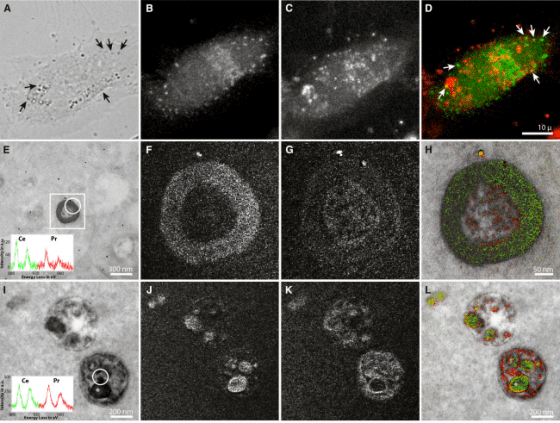
反應後的切片依電子顯微鏡樣本製備方式處理後,在一般穿透式電子顯微鏡下,可以觀察細胞內細微的各式結構,但此時不管何種帶鑭系元素的 DAB 產物,在顯微鏡下還是不容易和其他深染構造區分。作者接著以加裝了「電子能量損失能譜儀(Electron energy loss spectroscopy, EELS)」的電子顯微鏡觀察樣本,分析切片中兩種鑭系元素訊號分別出自何處,得到兩種元素的分佈圖,最後將傳統電子顯微鏡影像與兩種鑭系元素分佈圖於繪圖軟體中重疊在一起,並為元素分佈圖套色,使各自帶有不同顏色,如綠色代表鑭,紅色代表鈰,於是得到黑白的電子顯微鏡照片上有綠色和紅色等色彩的呈現。
作者選擇鑭系元素有幾個原因,一是他們都是重金屬,在 EELS 元素分析下訊號容易辨識,另一個則是在 DAB 氧化時易一起形成沉澱且不易流失。嚴格說來,作者並非直接在電子顯微鏡下看到彩色的影像,畢竟成像的還是電子,不是光子。不過本篇文章採用的技術,讓我們可以先利用光學顯微鏡及螢光蛋白科技等優勢,觀察大範圍組織獲得較整體的概念,再藉由電子顯微鏡的高解析度了解奈米層級的結構,同時對標定的分子在細胞內的分佈狀況或交互作用,能藉由顏色的呈現更清楚的與背景影像區別,這對未來細胞顯微結構及分子分佈與功能的研究開啟了另一種可能性。
〈本文選自《科學月刊》2017年3月號〉
什麼?!你還不知道《科學月刊》,我們47歲囉!
入不惑之年還是可以當個科青
___________
你是國中生或家有國中生或正在教國中生?
科學生跟著課程進度每週更新科學文章並搭配測驗。來科學生陪你一起唸科學!