人類在 1979 年發現 p53 這個基因,這個基因是癌症這件大事最重要的因子之一,也就是人類細胞中的總開關,主要功用在於細胞 DNA 受損時防止腫瘤形成。1985 年至 1986 年間,科學家仍將 p53 視為致癌基因,但它不依循致癌基因規則的清況也讓人相當費解。
昆蟲病毒是外源蛋白的工廠
在學術假期間,普利斯(Carol Prives,紐約哥倫比亞大學生化學家)除了明白要在自認不足的領域中與人競爭是徒勞無功之事,也意識到,要了解一種蛋白,就必須想辦法取得足夠進行實驗的材料。
她有幸認識了桿狀病毒專家洛伊絲.米勒(Lois Miller)。桿狀病毒是種專門感染昆蟲、蜘蛛與甲殼動物等節肢動物的病毒。從歷史上來看,這些小小的生命體首度出現在描述蠶生病的中國古籍裡,而這些病毒藏身在蠶皮膚內的惡臭爛肉中。桿狀病毒不僅對十九世紀末期歐洲絲織工業的沒落有著舉足輕重的影響,至今對養蝦業也是一大威脅。
不過從 1980 年代起,桿狀病毒已有助於農業蟲害的生物控制。它們具有能夠製成友善環境的殺蟲劑的潛力,並促使人們進行大量相關的分子生物實驗。這些實驗顯示出桿狀病毒另一個同樣價值非凡的特性——它能夠大量生產蛋白,包括人工嵌入其 DNA 中之外源基因(foreign proteins)所編碼的蛋白。
「洛伊絲似乎是在跟我討論過之後,覺得應該以桿狀病毒同時來表現 SV40(猿猴空泡病毒 40,simian vacuolating virus 40) 大 T 抗原(large T antigen,SV40 DNA中的致癌基因,會在受感染的宿主細胞中產生腫瘤)及 p53 蛋白。她也好心地給了我們這些病毒,」普利斯說。
她以兩種蛋白一起進行實驗,很快就有了重大發現——p53 會抑制猿猴病毒蛋白,防止它啟動細胞中的複製機制。她發表了自己的發現,時間就在 p53 被發現具有抑癌基因的正常功能後不久。
「接著,我接到一通來自貝爾特.沃格斯坦(Bert Vogelstein)的電話,而我當時從沒聽說過這個人。他說:『妳可以寄些蛋白給我嗎?我們有些有趣的想法。』我就回說:『沒問題。』我對這個人完全不了解,但他似乎很友善。」
不久之後,沃格斯坦請求普利斯可否為他製造一些桿狀病毒,他要以此從各式癌症腫瘤中的 p53 突變基因來獲取蛋白。他想將這些蛋白的活性與正常 p53 的活性進行比對。
揭開 p53 功能的足跡
當沃格斯坦在巴爾的摩的實驗室中忙碌時,往北 270 公里的紐約,普利斯恰巧有了 p53 活動上的重大發現。一位名為喬.巴格那堤(Jo Bargonetti)的年輕博士後研究員,在實驗中有了新發現。巴格那堤那時剛加入普利斯的實驗室,她對 p53 究竟是如何避免大 T 抗原開啟猿猴病毒感染細胞中的 DNA 複製機制,表現出想要深入了解的興趣。「我們跟她嚴正聲明:別做那個,那很無趣,我們已經知道結果,去做其他的研究,」普利斯笑著說。但巴格那堤卻堅持說,她要做個「足跡」(footprint)實驗。
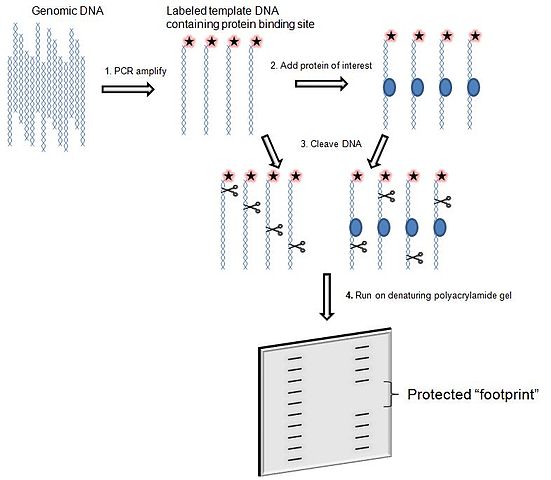
「足跡實驗是一種非常講究的實驗,一般不常做。」普利斯解釋道。這種實驗必須在監控下在試管中混合純化蛋白與 DNA,並在其中加入酶。酶的作用就如同化學剪刀,將 DNA 剪成小段。不過,如果蛋白與 DNA 結合,「剪刀」就無法剪斷此點的條狀遺傳物質。混合物最後會在凝膠中進行電泳,將 DNA 的片段排入「階梯」之中。若是蛋白與 DNA 沒有結合,階梯就跟原來一樣,若是蛋白與 DNA 結合了,階梯裡就會有空隙。「如果你知道要怎麼讀取序列,觀察凝膠就可以知道蛋白確切嵌在 DNA 的哪個位置上。」普利斯說。
這裡必須解釋一下,才能了解巴格那堤發現的東西具有何種重要性。一般而言,與 DNA 結合的蛋白(蛋白將自己附著在基因雙股螺旋的某個點上)的功能就是控制該區域的基因表現,適時開啟及關閉基因。具有此種功能的蛋白稱為「轉錄因子」(transcription factors),事實上也就是細胞內活動的總指揮。當時已經知道大 T 抗原是種轉錄因子,因為它會在感染 SV40 病毒的細胞內啟動 DNA 複製機制。巴格那堤混合大 T 抗原及 p53 蛋白進行足跡實驗,就是想實際從中了解 p53 如何阻礙大 T 抗原與 DNA 結合,讓它們無法開啟機制。「我們跟她說:『好吧!如果妳堅持的話,那就去做吧!』」普利斯說,她什麼也沒多想,留下這位年輕科學家跟她自己的器材就離開了。
但巴格那堤發現的比普利斯預期的還要多。「有一天她來找我說:『我成功了,但有個大問題……p53 在凝膠上出現了這些模式。』」知道這是科學上罕見的大發現時刻,普利斯回應道:「這不成問題——妳是世界上最幸運的人了!」
p53在 DNA 階梯出現清楚且意料之外的足跡,這即是抑癌基因如何運作的第一個線索,因為它也是個轉錄因子。我們現在知道它是個非常強大的轉錄因子,坐鎮在我們身體內每個細胞中、掌管生死訊號的網絡中心。
沃格斯坦也透過另外一個途徑發現到 p53 是個轉錄因子。他的實驗室觀察到 p53 蛋白是在細胞核中活動,而非在細胞質中——細胞核是細胞儲存 DNA 的發電廠。轉錄只發生在細胞核中,而許多在此活動的蛋白都與基因表現的控制有直接或間接的關係。因此,沃格斯坦團隊開始進行實驗,以了解 p53 是否會與 DNA 結合(這是轉錄因子的特性),也發現確實是這樣。

「這件事另外有個同樣重要的部分,」沃格斯坦解釋,「我們不只看到它結合的 DNA 序列,也發現它除了結合到這些序列外,還活化了『下游』基因——也比較所有情況下的野生型(也就是正常基因,可發揮天生的功用)與突變型(行為異常的基因) p53。」讓我們覺得滿意且認定自己是朝正確方向邁進的是,我們觀察到每個突變型 p53 都缺乏與 DNA 結合的能力。我們已經能夠複製它們了,記得吧?這讓我們可以明確測試突變是否會干擾這項功能——結果無一例外,每個突變型 p53 都無法與 DNA 結合。這讓我們相信結果是正確的—我認為世界上其他人也會這麼認為。」
巴格那堤也使用沃格斯坦的突變型 p53 蛋白,做為自己野生型 p53 實驗的對照組來進行足跡實驗。「巴格那堤說:『你知道嗎?只有野生型有這樣的模式,突變型並沒有,』」普利斯接著說,並將手放在胸口表現出對此發現興奮到無法呼吸的模樣。「我簡直是,啊啊啊……像死了上天堂那樣!我的意思是,這真是完美啊!……巴格那堤的足跡實驗並不完美,結果不是非常明顯,但它的確明白顯示野生型辨識 DNA 的模式,而突變型則無法辨識。這是絕對清楚明白的。」普利斯停下來思索一會,然後說:「你知道嗎?我從事科學這麼多年,從不認為自己有做出什麼,直到出現些有意義的東西為止。」
普利斯實驗室也經由檢測放置在實驗室培養皿中的細胞,來驗證足跡實驗的發現。他們發現野生型 p53 確實如同轉錄因子般作用,而突變型不會。同時,沃格斯坦實驗室也顯示他們在生物體內也有同樣的發現。這兩間實驗室在那時經常交流,並於 1991 年以共同作者的身分,在深具影響力的期刊《科學與致癌基因》(Science and Oncogene)中發表論文。
但 p53 身為總開關的活動情況,與它保護我們免於癌症侵擾之間的關聯是什麼?抑癌基因本身如何啟動?當這一切發生時,p53 確切又做了什麼?這些是接下來要思考的部分。
本文摘自《 p53:破解癌症密碼的基因》,商周出版。