文/何翰蓁|慈濟大學醫學系解剖學科副教授。熱愛形態學,以研究精子細胞內各胞器變化開啟研究生涯,目前觀察對象小至細菌,大至人體。著有《我的十堂大體解剖課》。
1970 年, 柳町隆造(Ryuzo yanagimachi) 在交配後母倉鼠(hamster) 的輸卵管中, 發現精子表現出一種極度激烈活潑的游泳方式,一種具有大振幅、不對稱的鞭毛擺動的運動方式,並將之命名為超活化運動(hyperactivated motility),此發現就此開啟了近半世紀相關領域的研究。
精子的「超活化運動」
為什麼會命名為超活化運動呢?原來睪丸製造的精子,雖然具有典型的蝌蚪狀形態,但此時精子並不具有游動的能力,即便是儲存在副睪中逐漸成熟的精子,大部分也不具有游動能力,直到經由射精進入雌性生殖管道或被置於適當的培養液中,精子才會像開關被啟動一樣,表現出所謂的活化運動(activated motility):一種小振幅且對稱的鞭毛擺動,造成精子以直線軌跡前進。
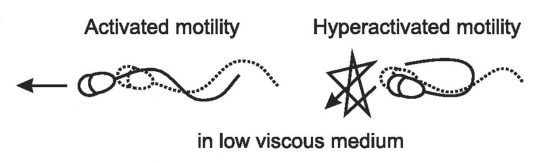
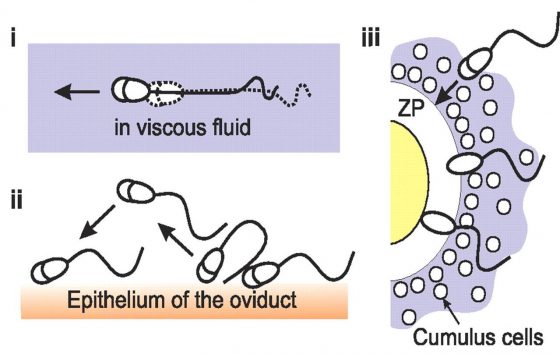
剛開始,表現超活化運動的精子並不被看好,因為夾在載玻片與蓋玻片中的精子,那不對稱的鞭毛擺動讓他們只在原地打轉,看起來那裡都去不了,不似表現出活化運動的精子,像是有目標的前進。然而,逐漸累積的研究結果顯示,雌性生殖管道和玻片中的環境完全不同,在充滿黏液、阻力較大的輸卵管中,表現活化運動的精子會被黏液困住,反而是表現出超活化運動的精子,藉由大振幅不對稱的鞭毛擺動,反而能在黏稠的環境中有效向卵子方向移動,且這種運動方式有助於精子穿過卵子外圍的卵丘細胞(cumulus cells)及透明帶(zona pellucida)等,均暗示其具有使卵子受精的優勢。
於是,不論是為了提高受孕率,或是開發新的避孕藥,投入精子運動模式調控相關研究的人越來越多。不同實驗室採用不同的實驗動物,發現多種哺乳動物的精子都會在受精前表現出這類特別的運動方式,也了解該運動是受到鈣離子的調控。
由於小白鼠是模式生物,且已有多種基因剔除小鼠出現精子運動缺陷或雄性不孕等現象,因此越來越多研究採用小白鼠精子來探討運動調控機制。因為小白鼠較小,不容易像豬或牛等大動物,可以利用人工陰道採集射精後的精子(ejaculated sperm)進行實驗;且早期以電刺激方式使小白鼠射精而採集到的精子,品質不佳、死亡率高,因此絕大部分的實驗是將公鼠的副睪取出,放在精子的培養液中,在副睪上以無菌針頭刺幾個洞,收集由副睪中游出的精子來進行實驗。如此採集到的小白鼠精子稱為副睪精子(epididymal sperm),因為接觸到培養液,這些副睪精子會表現出活化運動方式,但與射精後的精子相比,則少了與攝護腺、儲精囊分泌物接觸的機會。
我們已經知道精液中的果糖是精子重要的能量來源,其中許多蛋白質也具有促進精子成熟或調控精子活性的功能,如儲精囊的分泌物 SVS2 會抑制副睪精子在體外 (in vitro) 進行獲能反應(capacitation)。所謂獲能反應指的是精子進入雌性生殖管道後,細胞膜上脂質及蛋白質等改變,最終使精子具有進行頂體反應(acrosome reaction)的能力。精子必須進行頂體反應才能通過透明帶並與卵結合,因此,無法順利完成獲能反應的精子通常也無法使卵受精。不過,太早進行獲能反應的精子卻也有早衰、提早喪失游動能力等狀況,因此獲能反應受到精密的調控。
射精前後的精子有所差異?
研究人員藉由基因剔除小鼠的研究,找到了多個參與精子運動調控的重要分子。然而,藉由副睪精子進行的研究, 是否適合直接用以解釋正常生理狀況下,射精後精子的狀況?它們之間有沒有差異?
2015 年,蘇亞雷斯(Susan S. Suarez)實驗室發表在 PLoS ONE 期刊的研究報告解答了我們的疑惑。研究人員犧牲剛交配的母鼠,打開子宮收集射精後的精子進行實驗, 採集過程在交配後 30 分鐘內完成。而交配過的公鼠則在 2~7 天之後犧牲,採集副睪精子,如此便可比較同一公鼠副睪精子與射精後精子的活性差別。
研究人員有什麼發現呢?首先,他們觀察到射精後的精子較容易黏在玻片上 (射精後:74.8%;副睪精子:6.9%), 若在促進獲能反應的培養液中培養 2 小時後,射精後的精子黏在玻片上的比例則降至 40.9%,且大部分不再黏附在玻片上的精子,表現出超活化的運動方式。研究人員認為射精後的精子與副睪精子在黏附玻片上不同的表現,顯示他們細胞膜表面特性或電荷在有無接觸精液分泌物下有顯著差別。
利用電腦輔助程式分析精子各項運動參數後,發現射精後的精子活動性、游動速度及多項運動參數均優於副睪精子。更有趣的發現是,兩種精子在促進獲能反應的培養液中培養 2 小時後,均表現出超活化運動,但是形式卻不盡相同: 射精後精子超過 90% 表現出順鈎式(pro-hook)超活化運動,副睪精子卻有 50% 呈順鈎式、50% 呈現反鈎式(anti-hook)超活化運動模式。早期利用副睪精子為實驗材料時,蘇亞雷斯實驗室即提出小白鼠精子超活化運動可分為順鈎式及反鈎式兩種模式。小白鼠精子頭部呈鐮刀狀,他們發現副睪精子表現超活化運動時,有些精子鞭毛的大振幅擺動彎曲弧度與頭部鐮刀鈎同向,稱為順鈎式; 相反的則稱為反鈎式,當時的研究也清楚說明:兩種不同超活化運動模式具有不同的鈣離子調控機制。

研究人員接著利用螢光染劑,讓兩種不同的精子分別帶著綠色或紅色螢光。混合後的兩種精子再放到卵丘– 卵複合體(cumulus-oocyte complex)周圍,觀察精子與卵及卵丘細胞間之互動。螢光染劑讓研究人員可以清楚區別副睪精子和射精後的精子,不過為了避免染劑本身的影響, 重覆的幾次實驗會交換螢光與精子的配對使用。實驗結果發現射精後的精子比副睪精子更容易進到卵丘– 卵複合體中,顯示可能有更高的受孕率。
這篇研究以簡單卻清楚的實驗分析了副睪精子與射精後精子的多項差異。實驗結果本身除了提醒我們不要忽略精液中分泌物的重要性外,也不禁讓人重新思考:有時受限於實驗材料的取得,或為了有效控制變因、方便釐清各個重要的因素分別扮演什麼角色時,難免簡化了複雜的生理現象。然而,當結果要套用到複雜的生物個體上時,我們需要更小心,收集更多的資料,以勾勒出更接近真實的面貌。
本文選自《科學月刊》2016年7月號
延伸閱讀:
什麼?!你還不知道《科學月刊》,我們 46 歲囉!
入不惑之年還是可以當個科青