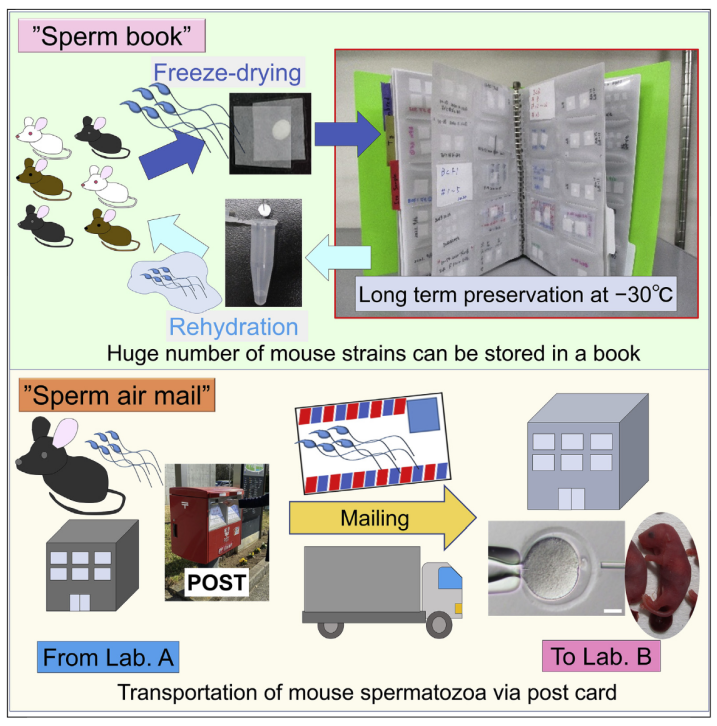
在古代有飛鴿傳書,在霍格華茲裡更有貓頭鷹負責寄送會發出聲響的信件。信件不僅是文字、訊息往來的方式,現今更可直接作為生物材料的寄送媒介。研究團隊發現,經冷凍乾燥處理的小鼠精子,可於沒有液態氮的環境中妥善保存,並且在室溫下帶於普通郵件中寄送。

傳統保存方式:充滿液態氮的超低溫環境
典型保存精子的方式,是將精子保存於液態氮或乾冰中,極低溫的環境可讓精子處於冷凍的狀態下進行運送。待解凍之後,會再透過人工授精或是試管外(in vitro)授精來繁衍後代[2][3] 。然而,使用液態氮仍可能會產生一些問題,例如,在 196℃ 超低溫度下,進行樣本處理需要非常小心,因為液態氮可能會造成凍傷或是並且因飽和氣體造成窒息等問題,並且在部分國家及地區也可能有難以取得液態氮的問題。
除此之外,為了要讓小鼠精子一直維持在極低溫的環境,需不斷地補充液態氮,這也會造成昂貴的花費。因此,對於部分國家的研究機構來說,這樣難以保存小鼠基因來源。更不用說,若遇到停電、大災難等突發狀況可能會導致的極低溫的環境受到影響,小鼠精子解融、退冰,並導致精子無法使用。

玻璃安瓿保存法很讚,但仍不適合長期保存
為了解決低溫環境難以控制的問題,日本山梨大學(University of Yamanashi)生殖生物學家 Daiyu Ito 的研究團隊發展出一項技術,將小鼠精子放入細頸瓶或玻璃安瓿(Ampoules,一種形狀類似保齡球瓶的小型玻璃瓶,常用於盛裝藥品等溶液。)並置於 4℃ 的環境中三個月,然後再放置於室溫中 1 個月。經過冷凍乾燥處理,可放置於室溫環境中一年。雖然經過處理後的小鼠精子已死亡,無法移動,但精子中的 DNA 仍然維持完整性[4]。
爾後,再將這些冷凍乾燥後的小鼠精子在注射入卵子時,一樣能繁衍出正常的後代。這項冷凍乾燥的技術已運用與許多物種,例如實驗小鼠、倉鼠、兔子、馬以及綿羊等物種[5]。然而,使用玻璃安瓿仍有一些缺點。Daiyu Ito 說:「雖然玻璃安瓿的體積小,但它們相當笨重且易碎,容易影響小鼠後代的繁衍。所以將小鼠精子儲存在玻璃安瓿並不適合用來長期保存。因此,我們希望發展新的保存技術。」
紙類保存凍乾精子有搞頭,但哪種材質最適合?
為了找出最適合用於保存冷凍乾燥的小鼠精子(mouse FD spermatozoa)的材料,研究團隊檢測了六種材質,分別是:日式傳統和紙(Washi)、包裝紙(Wrap)、乙烯基板(Vinyl sheet)、秤量紙(Weighing paper)、過濾紙(Filter paper)、日式糖果紙(Oblate)。
首先,過濾紙(Filter paper)是不可以使用的,因為小鼠精子容易卡在紙上,並且在解凍時無法順利取出精子。日式糖果紙(Oblate)也被認為無法作為保存材料,原先認為當日式糖果紙全部溶解於水中,就可以輕易地將冷凍乾燥的精子取出。然而,實際試驗後才發現,日式糖果紙溶解時仍會有部分殘餘物,導致難以收集小鼠精子。此外,其餘的四種材料雖然可用於收集小鼠精子,但仍有一些小缺點,例如:包裝紙太容易撕破,乙烯基板則在乾燥的過程中容易損失精子。
相對來說,日式傳統和紙是個較好的材料,但是在於脫水後的恢復過程中容易汙染,使得收集小鼠精子會遇到困難。秤量紙相較於乙烯基板較薄,但比包裝紙還要硬,是可作為小鼠精子乾燥過程的材料。因此,在此六種材料中,秤量紙是最適合用來處理小鼠精子的。
且經實驗發現,無倫是保存在玻璃安瓿或四種材料(傳統和紙、包裝紙、乙烯基板及秤量紙)的冷凍乾燥小鼠精子,其精子受精率(fertilization rates)沒有顯著差異。然而,在胚胎的發展成桑葚胚(morulae)或囊胚(blastocyst)的比率,最高的是以秤量紙(Weighing paper)包裝的小鼠精子。
使胚胎妥善的發育的比率,是作為小鼠精子是否有成功保存最重要指標,而在四種材料中,使用秤量紙(Weighing paper)包裝的小鼠精子其後代存活率數值為 21%,後代存活比率數值最高。考量到精子發育的程度,以及材料操作容易程度,最後採用秤量紙包裝冷凍乾燥精子,並用塑膠片作為分隔是最適合的選項。
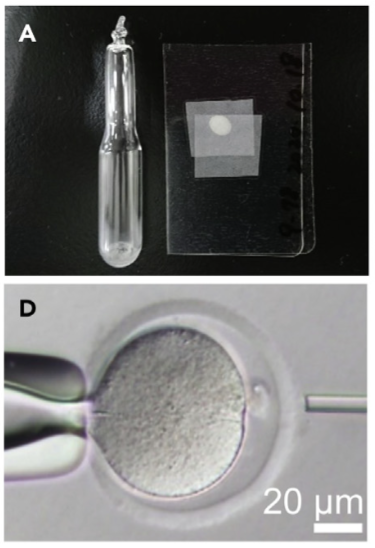
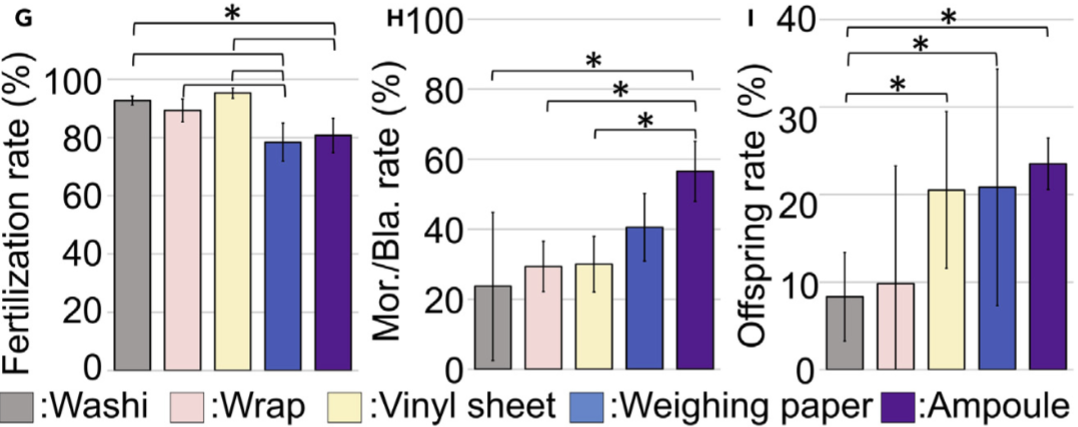
圖 H,受精卵發育成桑葚胚(Morula)或囊胚(Blastocyst)的比率[註1]。圖/Daiyu Ito,山梨大學[1]
塑膠片會影響精子的DNA完整度嗎?
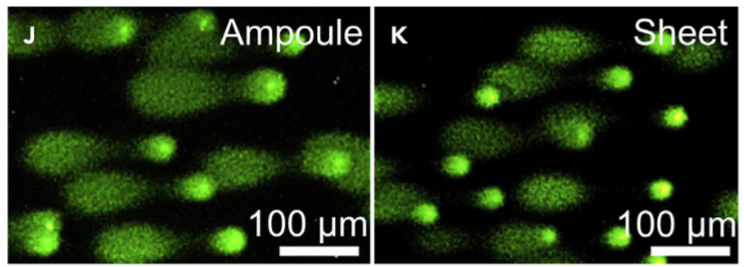
為進一步了解使用塑膠片保存精子是否會影響精子內的 DNA,研究團隊藉由彗星分析法(comet assay),來比較玻璃安瓿和塑膠片的精子中 DNA 的完整性。彗星分析法可用來檢測單細胞中 DNA 的損害程度,若 DNA 有損害,其結構會較為鬆散,斷裂或破碎的 DNA 片段會在進行電泳(gel)時被拖出細胞,在顯微鏡之下會呈現出一個類似彗星的形狀。不同程度的 DNA 損傷則會造成拖尾程度的差異,至於未損傷的 DNA 則會保持球狀。
從觀察結果得知,保存於玻璃安瓿的小鼠精子 DNA,其彗星尾相較保存於塑膠片的小鼠精子 DNA 慧星尾長度稍短一些,不過,就統計結果而言,兩者之間有顯著差異。
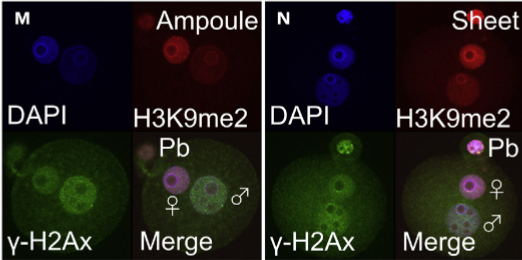
但另方面,在小鼠精子進行細胞質內精子注射(ICSI)之後,藉由使用 γ-H2Ax 染色來比較玻璃安瓿和塑膠片的雄原核(male pronucleus)中 DNA 損壞程度,結果卻發現,相較於保存在塑膠片的小鼠精子,保存於玻璃安瓿的小鼠精子經 γ-H2Ax 染色後,其雄原核[註2]有較高的亮度,顯示此細胞核內的雙股 DNA 損壞較為嚴重。
綜合上述,保存於塑膠片中的小鼠精子 DNA 完整度,與保存於玻璃安瓿的小鼠精子 DNA 完整度,是可以相比擬的。
如何製備冷凍乾燥的小鼠精子?
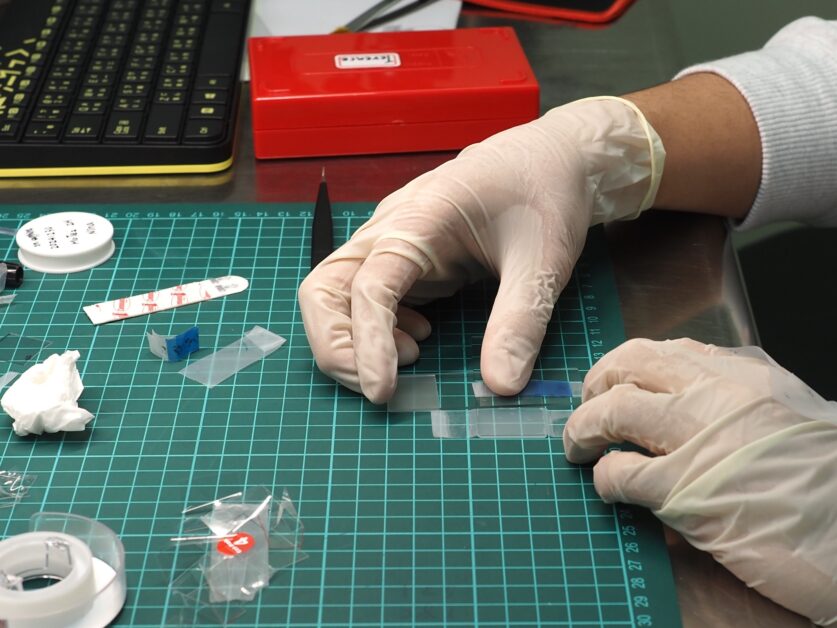
小鼠精子經過預先培養之後,會秤量紙作為載體,將含有精子的溶液滴定於秤量紙上。將鋁箔紙摺出一個凹槽,依序放入裁切好的塑膠片及帶有小鼠精子的秤量紙,然後將整包鋁箔包放入保麗龍盒,最後在保麗龍盒內加入液態氮。
接下來,將冷凍的精子溶液乾燥,乾燥之後的冷凍小鼠精子會呈現粉末的狀態。然後,將冷凍乾燥後的小鼠精子取出,並用兩張秤量紙包裝,最後放在塑膠片上並用膠水將其密封起來。待需要使用時,再用剪刀將塑膠片剪出一個缺口,並用鑷子取出小鼠精子,最後再用水回溶精子。
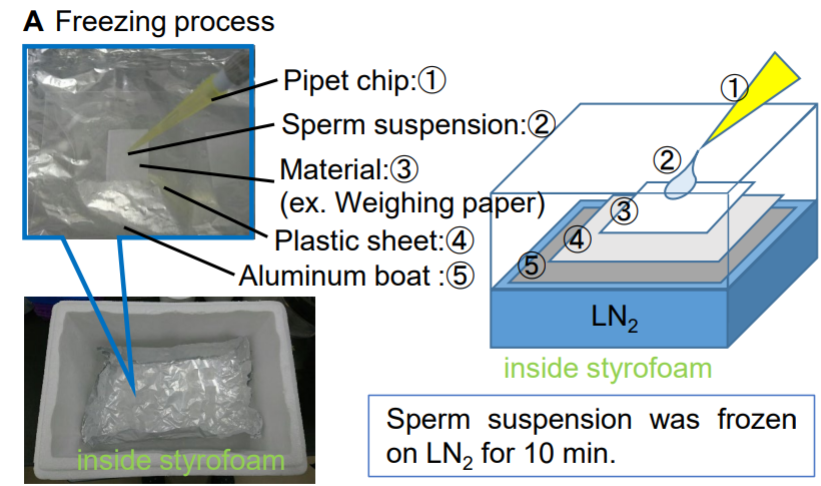
(①Pipet chip,定量吸管,用來吸取小鼠精子溶液。②Sperm suspension,小鼠精子的懸浮液。③Material,用來作為小鼠精子溶液載體的各種材質,此處為秤量紙。④Plastic sheet,塑膠片。⑤Aluminum boat,鋁箔紙船)。圖/Daiyu Ito,山梨大學[1]

凍乾的小鼠精子,可在室溫下藉由明信片運輸
雖然相較於保存在 -30℃ 的環境,冷凍乾燥(freeze-dried,FD)的小鼠精子保存在室溫環境下三天,其後代存活率較差,但仍可繁衍出後代。利用塑膠片保存的小鼠精子可以夾帶在明信片中,並放置於 -30℃ 的環境。待到要寄信的那天,可直接利用普通郵件的方式寄送,不需額外的保護措施。而收到郵件後,只需再將小鼠精子放回 -30℃ 的環境即可。
研究團隊曾使用此方式,將冷凍乾燥後的小鼠精子從東京大學寄至山梨大學,兩校之間的距離約為 200 km,並且郵件會在 2 天之內寄達。而這些冷凍乾燥的小鼠精子也能順利進行胚胎發育。因此,冷凍乾燥的小鼠精子,是可在沒有其他保護措施之下,在室溫下藉由明信片寄送。


使用信件運輸小鼠精子的優缺點
Daiyu Ito 說:「遺傳資源對於人類未來而言,是個重要資產。即使有許多遺傳特徵可能已不適用於生存,但這些遺傳資源可能有利於某些物種在環境變遷或未知疾病擴散時存活下來。」哺乳類動精子保存,有利於不孕、維持品系中修飾過的基因序列。這個使用塑膠片夾帶小鼠精子的方式,可以方便保存數千種的小鼠品系(strain),除了有利於實驗室及研究機構間的合作往來,更可以促進生殖技術及科技的發展。
然而,使用如此方便及簡易的運送方式,可能會造成許多不合法的運輸過程發生,因此需有更完善的法規制度來審查及保護動物精子的運輸。
註解
- 受精卵會在 24 小時分裂成 2 細胞,約 48 小時分裂成 4 細胞,約 72 小時分裂成 6~8 細胞,並在約 96 小時分裂成桑葚胚(Morula);之後才會形成囊胚(Blastocyst)。
- 雄原核,指的是在受精之後,精核進入卵子內,但尚未於雌原核(female pronucleus)融合。
參考資料
- Ito, D., Wakayama, S., Emura, R., Ooga, M., & Wakayama, T. (2021). Mailing viable mouse freeze-dried spermatozoa on postcards. iScience, 102815.
- Benson, J. D., Woods, E. J., Walters, E. M., & Critser, J. K. (2012). The cryobiology of spermatozoa. Theriogenology, 78(8), 1682-1699.
- Sztein, J. M., Takeo, T., & Nakagata, N. (2018). History of cryobiology, with special emphasis in evolution of mouse sperm cryopreservation. Cryobiology, 82, 57-63.
- Wakayama, S., Kamada, Y., Yamanaka, K., Kohda, T., Suzuki, H., Shimazu, T., … & Wakayama, T. (2017). Healthy offspring from freeze-dried mouse spermatozoa held on the International Space Station for 9 months. Proceedings of the National Academy of Sciences, 114(23), 5988-5993.
- Choi, Y. H., Varner, D. D., Love, C. C., Hartman, D. L., & Hinrichs, K. (2011). Production of live foals via intracytoplasmic injection of lyophilized sperm and sperm extract in the horse. Reproduction, 142(4), 529.