- 抵抗漸凍症50年的霍金於2018年病逝。圖/wikipedia
還記得 2014 年盛行的「水桶挑戰」嗎?這項主要是為美國肌萎縮性脊髓側索硬化症協會募款而發起的活動,引起不少人的對漸凍症(ALS)的注意。
中央研究院分子生物研究所陳俊安副研究員與研究團隊發現,一組微型核糖核酸(microRNA),稱之為 mir-17~921,在四肢運動神經元的表現量特別高,卻在漸凍症小鼠發病前顯著減少。
此為全球首次發現 mir-17~92具有作為預測漸凍症發病的生物標記,可改善漸凍症小鼠病徵,此實驗結果已申請專利,有助於未來以基因治療漸凍症標靶藥物的研發。研究成果已於108年5月30日刊登於國際期刊《細胞:幹細胞》(Cell:Stem Cell)。
漸凍症的症狀
罕見疾病「漸凍症」(學名為肌萎縮性脊髓側索硬化症)至今還有許多未解之謎,除了約一成病患為家族遺傳,有九成患者的致病原因仍然不明。
漸凍症是一種運動神經元退化導致的疾病,從控制四肢的運動神經元開始發病。患者初期因為感到手腳無力而就醫,但此時體內的運動神經元已開始出問題並迅速退化,短期內便無法行走或靈活使用雙手,最後只能漸漸躺臥在輪椅中,大多死於呼吸衰竭。
mir-17~92 和 PTEN2:影響運動神經元退化的關鍵

本次發現的漸凍症致病機轉,奠基於陳俊安先前的基礎研究成果,他發現小鼠胚胎裡的 mir-17~92大量表現於中樞神經系統裡控制四肢肌肉的運動神經元。
由於 PTEN蛋白質累積在運動神經元細胞核,導致細胞退化死亡;mir-17~92可抑制PTEN蛋白質的表現量,阻擋蛋白質進入細胞核中,進而保護運動神經元存活,阻止控制四肢的運動神經細胞凋零。
陳俊安研究團隊透過實驗發現,當小鼠胚胎的運動神經元失去 mir-17~92時,因無法抑制 PTEN的表現量,導致 PTEN增高並進入細胞核裡,造成控制四肢肌肉的運動神經元死亡。
本篇研究為驗證 mir-17~92是否也在漸凍症的運動神經元退化上扮演關鍵角色,採用多種生物模式系統做病理驗證,包括小雞胚胎、 SOD1G93A 3漸凍症小鼠以及其幹細胞分化之運動神經元、漸凍症患者的誘導性多功能幹細胞所衍生之運動神經元(iPSC~MNs4)等,觀察 mir-17~92的作用與表現後,均得到一致的結果。
mir-17~92可望應用於「漸凍症」的預測與治療
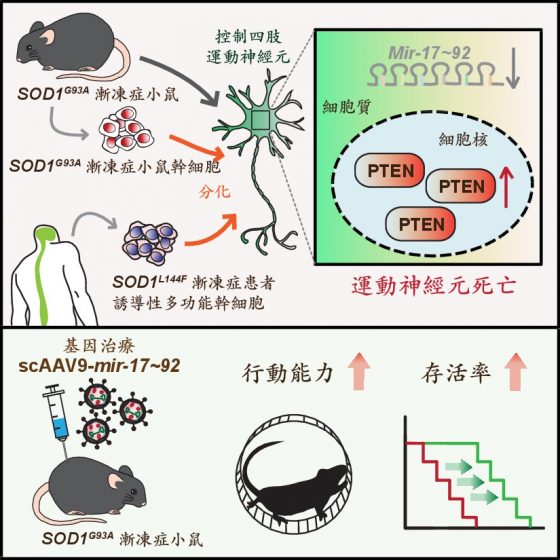
陳俊安解釋,原本應該大量表現於四肢運動神經元的 mir-17~92,在漸凍症小鼠發病(四肢運動神經元死亡)前會顯著減少,導致PTEN逐漸累積在細胞核中,最後細胞退化死亡。
令人振奮的是,研究團隊將 SOD1G93A漸凍症小鼠體內的 mir-17~92表現量提高,發現可以延緩小鼠癱瘓的時間,顯著增進其運動能力,小鼠壽命也平均延長14%。
由於目前漸凍症患者發病後平均壽命僅二至五年,若將 mir-17~92的基因治療應用於人體上,可望為漸凍症治療帶來一道曙光。本研究發現 mir-17~92與漸凍症發病的關聯性,也為「解凍」漸凍症的致病機制往前推進了一步。
註解:
- RNA 有兩種:一種是負責製造蛋白質的 mRNA(messenger RNA),另一種是ncRNA(non-coding RNA),不負責製造蛋白質。mir-17~92是一種小分子的 ncRNA,亦即 microRNA,幫忙「踩剎車」,辨認基因序列相對應的標靶mRNA ,並與之結合,進而抑制標靶 mRNA 製造蛋白質。本研究發現的mir-17~92,其一作用為抑制PTEN 蛋白質、與控制PTEN進核蛋白質的量。
- PTEN 是一個有生長抑制作用的抑癌基因,可促進癌細胞的死亡;本文則研究PTEN 對於神經細胞的影響。
- 此為SOD1基因缺陷漸凍鼠,已知有許多基因突變會造成漸凍症,SOD1是最早被發現,研究最為透徹的一員。
- 一般人的體細胞已定型,不像受精卵或胚胎幹細胞具有分化出各式細胞種類的能力。誘導性多功能幹細胞(iPSC),是利用導入特定轉錄因子,將體細胞轉變成類似胚胎幹細胞的多功能幹細胞。運用這個方法,可以直接將患者的血球細胞,變成iPSC,再分化成運動神經元(iPS~MN),讓科學家不需要侵入性地將患者神經元取出來做研究。
- 本文改寫自中研院新聞稿,原標題為〈「解凍」新突破! 微型核糖核酸可評估「漸凍症」發病風險有潛力作為新治療藥物〉
- 此研究由中研院、國衛院以及科技部支持。共同第一作者為本院分生所董盈岑博士和彭冠智;通訊作者為中研院分生所董盈岑博士和陳俊安副研究員。研究團隊成員包含:陳彥中醫師、張綿、顏雅萍博士和瑞典卡羅琳大學醫院的Sebastian Thams博士。
- 論文:Tung, Y. T., Peng, K. C., Chen, Y. C., Yen, Y. P., Chang, M., Thams, S., & Chen, J. A. (2019). Mir-17∼ 92 Confers Motor Neuron Subtype Differential Resistance to ALS-Associated Degeneration. Cell stem cell.