- 文/蝦喵@熊熊冷知識
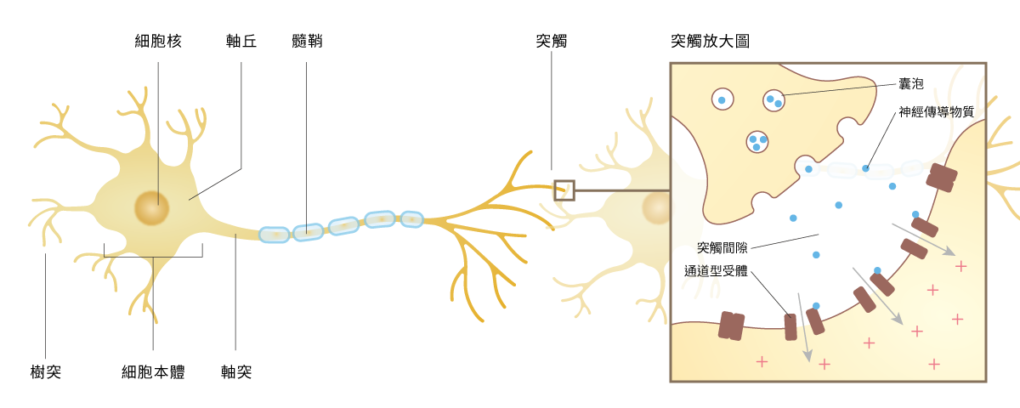
今天要和大家聊另一個和光遺傳學並列前二名的神經科學重要技術──透視大法:神經細胞活動即時影像技術。也就是,讓科學家們能直接用眼睛看出神經細胞在避沙ㄇㄤˋ(=變什麼把戲、耍什麼心機),看出每個各懷鬼胎的人的大腦到底是怎麼運作。反正就是一眼看穿心思之術!
什麼?!可以看穿心思聽起來好嚇人啊!別急別急,科學距離真正讀心還遠著呢!不然歐巴馬就不需要還撥錢搞什麼 BRAIN Initiative 的偉大計劃啦。先來看個影片壓壓驚吧,影片裡面的一閃的就是神經細胞在傳送訊息的瞬間。是的,其實這個技術看穿的就是這樣一閃一閃的訊息傳遞。
為什麼看得到神經訊號很厲害?
Anyway,神經細胞活動即時影像技術讓原本是電訊號的動作電位變成視覺訊號,確實讓我們往了解大腦更接近了一大步。為什麼呢?

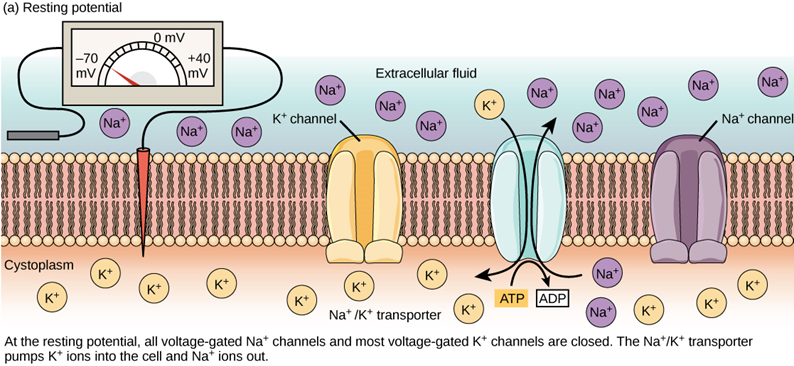
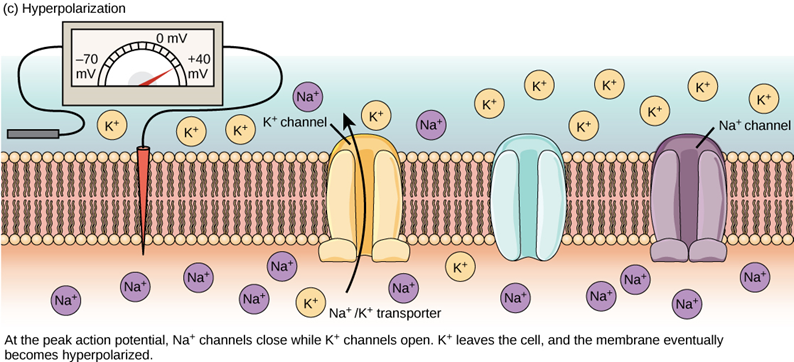
神經訊號在細胞裡靠電訊號傳遞,因此以往要瞭解一個單獨的神經細胞對於外界刺激的反應(有沒有產生電位變化),我們只能插一個電極進到神經細胞裡(而且很難插,不得不用很大很大的烏賊巨大軸突細胞做實驗不然插不進去),用許多複雜的儀器,努力屏蔽所有的電磁雜訊,進行各種濾波才能量到。(非常艱難,相信我,蝦喵姊姊正是苦主本人。)
後來,雖然發展到可以不用直接插進細胞只要插在附近也能量到(量測細胞外電位變化),但一根電極能量到的細胞數目畢竟還是很有限。如果要同時看到很多個神經細胞的反應,就必須一次插超多電極把大腦插成刺蝟才行。(而且電極還要夠小根呦!)
但光訊號就不一樣了。如果神經細胞產生反應我們能直接看到,那我們只要用夠好的鏡頭,就能同時偵測鏡頭內每一個神經細胞對於不同刺激的反應。

在以往還在用電極的年代(其實這個年代還沒有過去),科學家常常會有觀測上的偏差,往往只會秀出有頻繁變化的神經細胞,那些安靜內斂的內向者神經細胞容易被忽視(哭哭)[1]。太安靜、只有一兩次電位變化的神經細胞,量測時不太能確定真的是神經訊號或是雜訊,或者其實只是隔壁神經細胞有點燒聲(沙啞)的訊號。
新技術以影像呈現,可以直接看到每一個單獨的神經細胞亮或不亮,所以即使只發聲一兩次,仍然會被記錄下來。
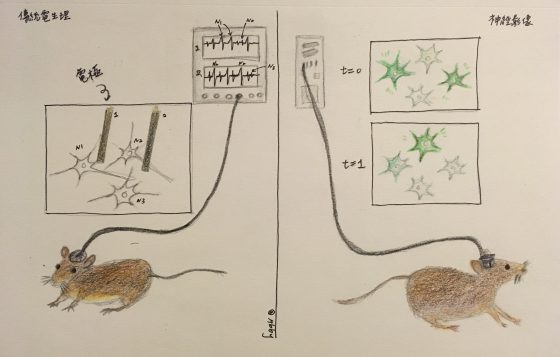
到這裡我們總結一下:光訊號很棒!(掌聲下)量測容易,且能同時記錄到很多神經細胞的訊號,也不會偏袒只記錄多話、頻繁產生訊號的神經細胞。
光訊號的缺點

那光訊號有沒有缺點呢?其實也有。
缺點就是,光訊號雖然在空間解析度很好,在時間上的解析度卻沒有電訊號來得好。就是如果兩個以上電訊號發生在很相近的時間中,光訊號會變成一個訊號。所以當科學家看到神經細胞閃一次,很難知道到底神經細胞是產生一個動作電位,或是兩個甚至是多個。
如何從電訊號轉成光訊號?
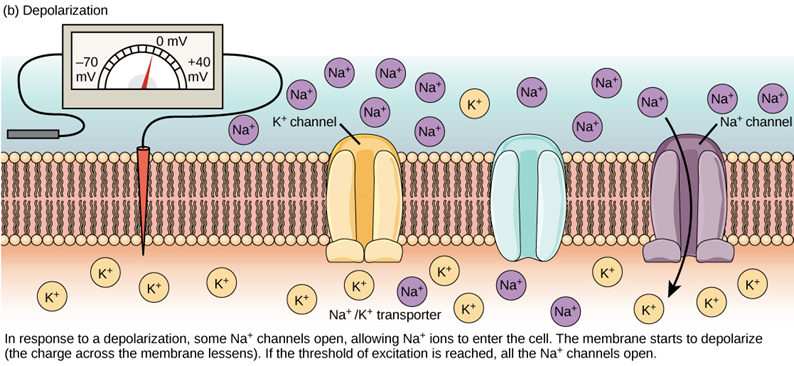
目前我們並不是直接看到動作電位,其實是看到鈣離子的變化。
那看到鈣離子變化是怎麼做到的呢?科學家左手綠螢光蛋白(Green fluroscent protein, GFP),右手細胞內建的鈣離子接收器(鈣調蛋白,Calmodulin),兩手奮力一碰,啊──綠螢光鈣離子接收器!
和其他會發光的鈣離子接收器統稱「基因內嵌鈣離子顯示器」(Genetically encoded calcium Indicator)[2]。

從此,這種融合蛋白碰到很多鈣離子就會發出綠色螢光。而剛好細胞產生動作電位時,很多鈣離子會從細胞外流入細胞,流入的鈣離子正好碰到這種融合蛋白就會發出螢光啦!
因為這種融合蛋白並不是天生的,所以科學家就可以進一步決定到底要在什麼細胞裡面放這種融合蛋白。也就是可以只看到我們有興趣的那種神經細胞的變化。能直接把動作電位轉成光訊號的蛋白因為技術限制,發展得比較晚,目前正在發展改進之中。
應用一 頭戴式迷你顯微鏡,找出輪班的位置細胞
我當初接觸到這個技術時,最讓我大開眼界的文章就是頭戴式小顯微鏡在自由活動的小鼠上的應用。鈣離子影像最早是用在體外的細胞樣本。之後應用在動物身上時,多半也需要固定動物在巨大的顯微鏡下方才能看到漂亮的影像。

雖然被固定在顯微鏡下方的小鼠也能跑球、喝水、也能用虛擬實境讓小鼠以為自己在空間中移動,但相對於能自由活動的小鼠還是有許多限制。而 Mark Schnitzer 組發展出僅有 1.9 克重的小顯微鏡(miniature integrated fluorescence microscope)[3],這個乘載重量在小鼠的負擔範圍內,讓小鼠即使戴著顯微鏡仍然能以接近自然形態的方式活動。
這個技術最大的突破是在自由活動的小鼠上同時觀測五百到一千顆神經細胞 45 天[4]。用電極量測細胞時,一來不容易確認不同時間點量到的是否仍為同一個細胞。其次,即使從電極位置和波形推斷為同細胞,能夠持續量測一個細胞維持一週兩週以上並不容易,更別提一個半月。

這些優勢,讓作者 Yaniv Ziv 等人發現位置細胞其實是會輪班執勤的[4]。位置細胞(place cells)是一群只在小鼠在特定空間時產生訊號的細胞。不同的細胞有它自己職守的位置(又稱場域,place field),當小鼠走到 A 細胞負責的位置時,A 細胞會產生訊號,其他的細胞則保持安靜;而當小鼠走到 B 細胞負責的位置,則換成 B 細胞產生訊號。
每個細胞只在小鼠經過自己負責的位置時產生訊號。然而,長時間量測同一腦區,卻發現在特定區域產生訊號的細胞每天都會有些不同。
雖然每天小鼠走過特定區域都有特定的細胞產生訊號,但昨天負責 A 區域的是 A 細胞,今天卻換成了 A’ 細胞,而 A 細胞則非常安靜。(如下圖圖二)作者發現,雖然當 A 細胞有執勤的時候,A 一直都是負責 A 區域,但每天負責 A 區域的細胞不一定相同,而是會輪班。
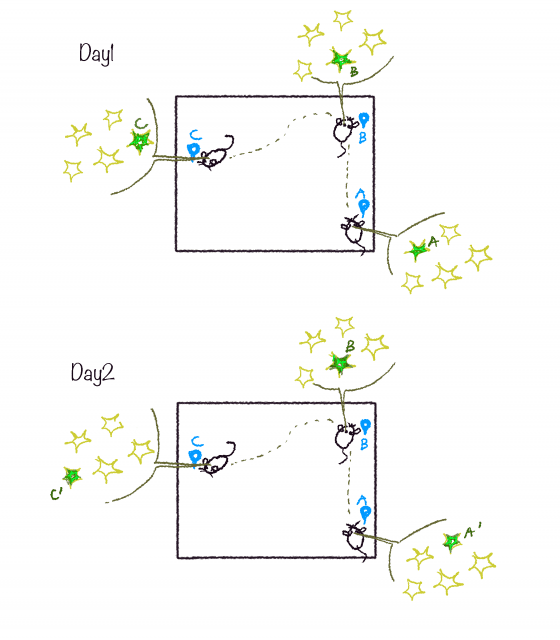
任兩天負責所有小鼠走過區域的位置細胞只有 15-25% 的重合,也就是有 75%-85% 的區域有別人頂替。(像是圖片中範例,第一天分別是 A、B、C 三個細胞負責 A、B、C 三區,但第二天只有 B 細胞固守崗位,A 和 C 區則改由 A’ 和 C’ 細胞負責。)這種位置細胞的輪班現象可能代表位置細胞不僅只記錄空間,也能記錄時間資訊。
應用二 光纖光度測定:訊號如何由腦區傳遞到另一個腦區?
另外一個應用光訊號的研究則是光纖光度測定(Fiber photometry):中腦腹側被蓋區(ventral tegmental area ,VTA))到伏隔核(nucleus accumbens,NAc)的投射與社交行為相關。
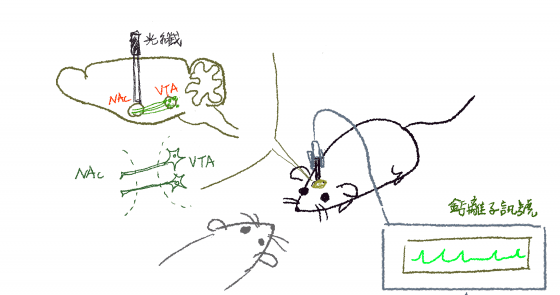
上面的技術讓我們能同時觀測到很多神經細胞的細胞本體的訊號,但要觀測細胞突觸上的電位變化,就是一件充滿挑戰的事。如果觀察到細胞突觸上的電位變化有影響解析上的困難,那要怎麼知道兩個腦區之間彼此是怎麼溝通的呢?Lisa Gunaydin 等人不直接觀察單一一個突觸,而是將所有從一個腦區投射到另一個腦區的所有突觸訊號搜集成一個訊號觀察。[5]
如此一來,就不需要解析一個突觸的微小訊號,而可以直接觀察一個較大的訊號。她們的做法是:
將所有腹側背蓋區(VTA)的多巴胺細胞都植入基因內嵌鈣離子顯示器(Genetically encoded calcium Indicator, GECI),將光纖放到 VTA 的下游區域伏隔核(NAc)去搜集所有從 VTA 的多巴胺細胞投射到 NAc 的突觸鈣離子訊號。此方法被稱為光纖光度測定(Fiber photometry)。
利用這個方法,他們觀察到這些突觸在小鼠進行社交行為的時候,會有許多訊號產生。這個技術雖然不能解析單一細胞,卻能讓研究者以簡單的方式研究從一個腦區到另一個腦區的所有突觸的整體訊號和行為間的關係。
這個技術的優點在於能以簡單的操作(埋光纖畢竟比埋顯微鏡容易)、相對低的經費(光纖比顯微鏡便宜)、對小鼠行為的影響較小的情況下(光纖的重量比起迷你顯微鏡仍然輕上許多),研究動物行為和大腦活動的關聯。雖然犧牲了單一細胞的解析度,卻讓小鼠有更多行為的可能性,讓研究者能研究更自然也更多元行為下的神經訊號。
註釋
- 動作電位是當神經或肌肉細胞內電位變化超過閾值時產生的超大電位變化,這種程度的電位變化產生後能迅速的向下傳遞,並透過釋放化學物質影響下游細胞。除了天生沒有動作電位的線蟲,動作電位大概就是研究非線蟲神經生物學家最在意的事。點我看植物的動作電位
參考資料
- Scanziani, M., & Häusser, M. (2009). Electrophysiology in the age of light. Nature, 461(7266), 930-939.
- Kotlikoff, M. I. (2007). Genetically encoded Ca2+ indicators: using genetics and molecular design to understand complex physiology. The Journal of physiology, 578(1), 55-67.
- Ghosh, K. K., Burns, L. D., Cocker, E. D., Nimmerjahn, A., Ziv, Y., El Gamal, A., & Schnitzer, M. J. (2011). Miniaturized integration of a fluorescence microscope. Nature methods, 8(10), 871.
- Ziv, Y., Burns, L. D., Cocker, E. D., Hamel, E. O., Ghosh, K. K., Kitch, L. J., … & Schnitzer, M. J. (2013). Long-term dynamics of CA1 hippocampal place codes. Nature neuroscience, 16(3), 264.
- Gunaydin, L. A., Grosenick, L., Finkelstein, J. C., Kauvar, I. V., Fenno, L. E., Adhikari, A., … & Deisseroth, K. (2014). Natural neural projection dynamics underlying social behavior. Cell, 157(7), 1535-1551.




































 ——本文摘自《
——本文摘自《



