本文轉載自顯微觀點
 曾擔任 2023 Taiwan 顯微攝影的評審、成大生醫光學影像核心平台主持人邱文泰,被選為 2024 IOTY 的亞太區評審代表,是台灣第一人!
曾擔任 2023 Taiwan 顯微攝影的評審、成大生醫光學影像核心平台主持人邱文泰,被選為 2024 IOTY 的亞太區評審代表,是台灣第一人!
細胞狗仔隊 專拍細胞不為人知的一面
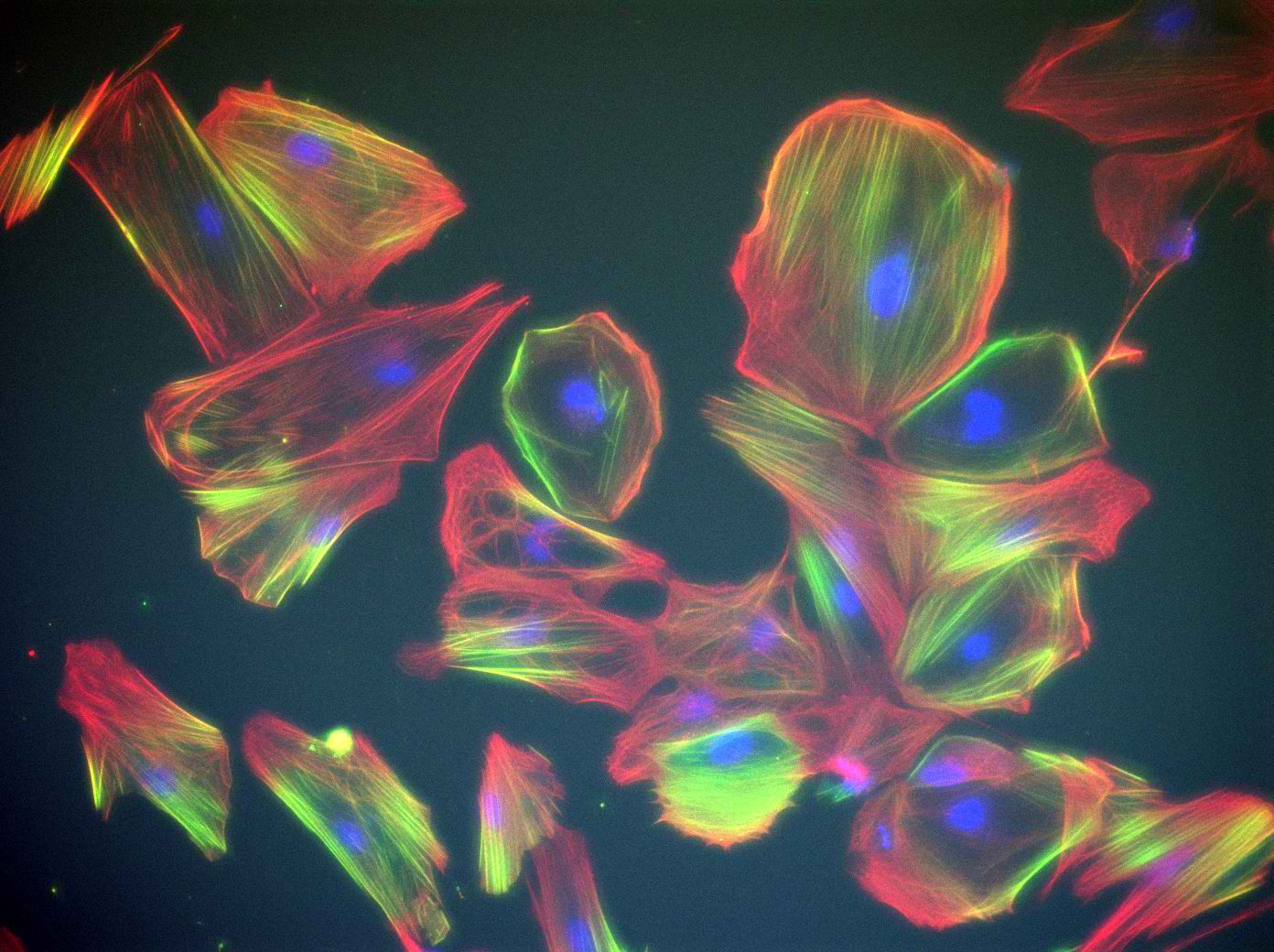
「我是細胞生物學的愛好者,我們實驗室團隊是細胞生物學的狗仔隊,專拍細胞不為人知的一面。」成大生醫工程系主任邱文泰,帶著笑容自我介紹。
邱文泰專精於活細胞分子造影、光遺傳學以及變化多端的細胞內信使:鈣離子對細胞生理機能的調控。他與團隊近年的重要研究之一,是以光遺傳學精密調控細胞內鈣離子濃度波動,觀察鈣離子如何影響細胞遷移(cell migration)。
20 世紀後半葉,生醫學界逐漸發現鈣離子是功能繁複的細胞訊息傳遞者,可調控授精、細胞增生與死亡、學習與分化,也參與細胞遷移、活化特定轉錄因子。
傳統生化科技如藥理、化學、物理方法,無法在時間、空間上精準調控與觀測活細胞內的鈣離子變化。細胞如何讀取鈣離子濃度波動(calcium oscillation)訊號,如頻率、幅度等,還是一個待解的謎題。
以光操縱鈣離子通道 解碼鈣離子波動訊號
邱文泰團隊運用光遺傳學(Optogenetics)技術,將人為編輯過的光敏感鈣離子通道蛋白 CatCH(calcium translocating channelrhodopsin)基因轉染(transfect)進入人類骨肉瘤細胞(U2SO)。位在細胞膜的 CatCh 蛋白一旦吸收藍光,就會開啟鈣離子通道,讓胞內的鈣離子濃度快速提升。
光線停止照射,CatCh 就不再輸入鈣離子,細胞原本的平衡機制開始作用,將鈣離子排至胞外(或內質網中),造成細胞質的鈣離子濃度起伏。因此實驗團隊能精密調整骨肉瘤細胞的鈣離子波動,並結合螢光顯微術觀測細胞狀態。
他們以大量表現 Catch 的骨肉瘤細胞(U2OS-CatCh)作為鈣離子波動的主要實驗對象,以藍光照射細胞,調整細胞內鈣離子濃度波動的幅度、週期、頻率、時間等參數。
在模擬傷口癒合的實驗中,培養皿中間表面被留下一道未被細胞覆蓋的空地,兩側細胞會逐漸往中間遷移、會合,直到將空地填滿。此細胞遷移的過程與人體傷口癒合相似,也與癌細胞在人體擴散的機制有關。
細胞遷移需要細胞骨架與細胞內諸多蛋白質分子聯合運作,參與的分子間還會彼此調控、影響。不同的細胞內訊息分子(即第二信使,second messenger)分別調控不同的蛋白分子路徑。鈣離子在其中的角色眾說紛紜,科學界對詳細機制的認識猶如管中窺豹。
邱文泰團隊發現,對 U2SO-CatCh,0.01 赫茲的藍光照射可帶來顯著高於對照組的細胞遷移量。在 0.1 赫茲的光照下,細胞遷移量卻比沒有照光的對照組更低。
參與細胞遷移的重要轉錄因子 CREB, NFAT, NF‐κB 也由不同強度的鈣離子波動活化,NF‐κB 由較低的鈣離子濃度活化;NFAT 由較高的鈣離子濃度活化;而高或低的鈣離子濃度波動都可以活化 CREB。
他們的研究不僅印證鈣離子波動可調節癌細胞增生、遷移的理論,也發現鈣離子波動頻率、幅度並非愈高就愈有效。若以 10 赫茲的藍光照射 U2SO 培養皿一個小時,90% 的細胞會死亡,死亡率遠高於波動頻率較低的組別。
透過光遺傳學技術對細胞進行時間、頻率的精準刺激,邱文泰團隊發現鈣離子作為細胞第二信使,能攜帶的訊息比過往的想像更加龐大。也推進了鈣離子訊息的解碼技術,在癌症研究、轉錄因子活化機制研究上,都可能帶來幫助。
堅持研究活細胞,以影像探索未知
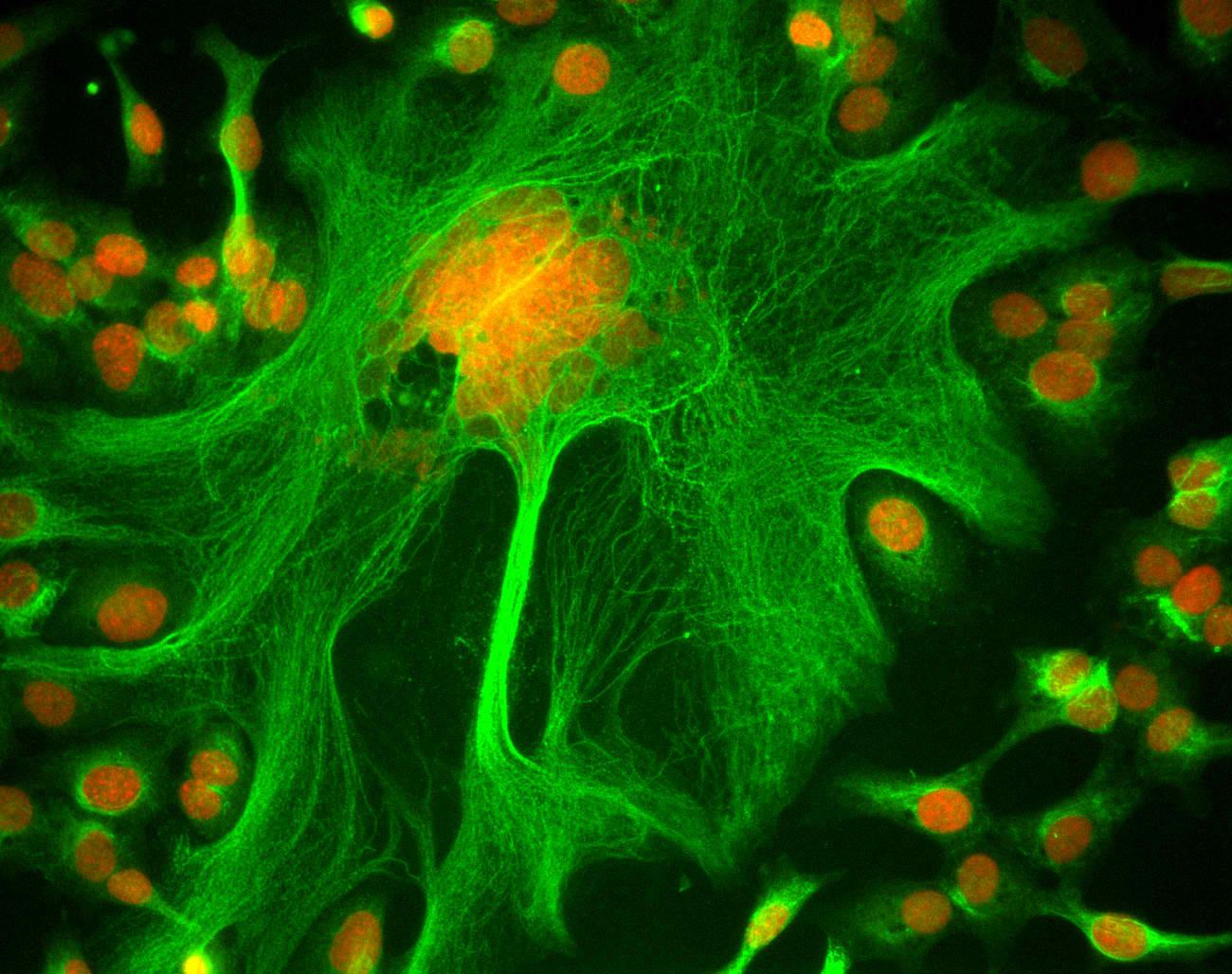
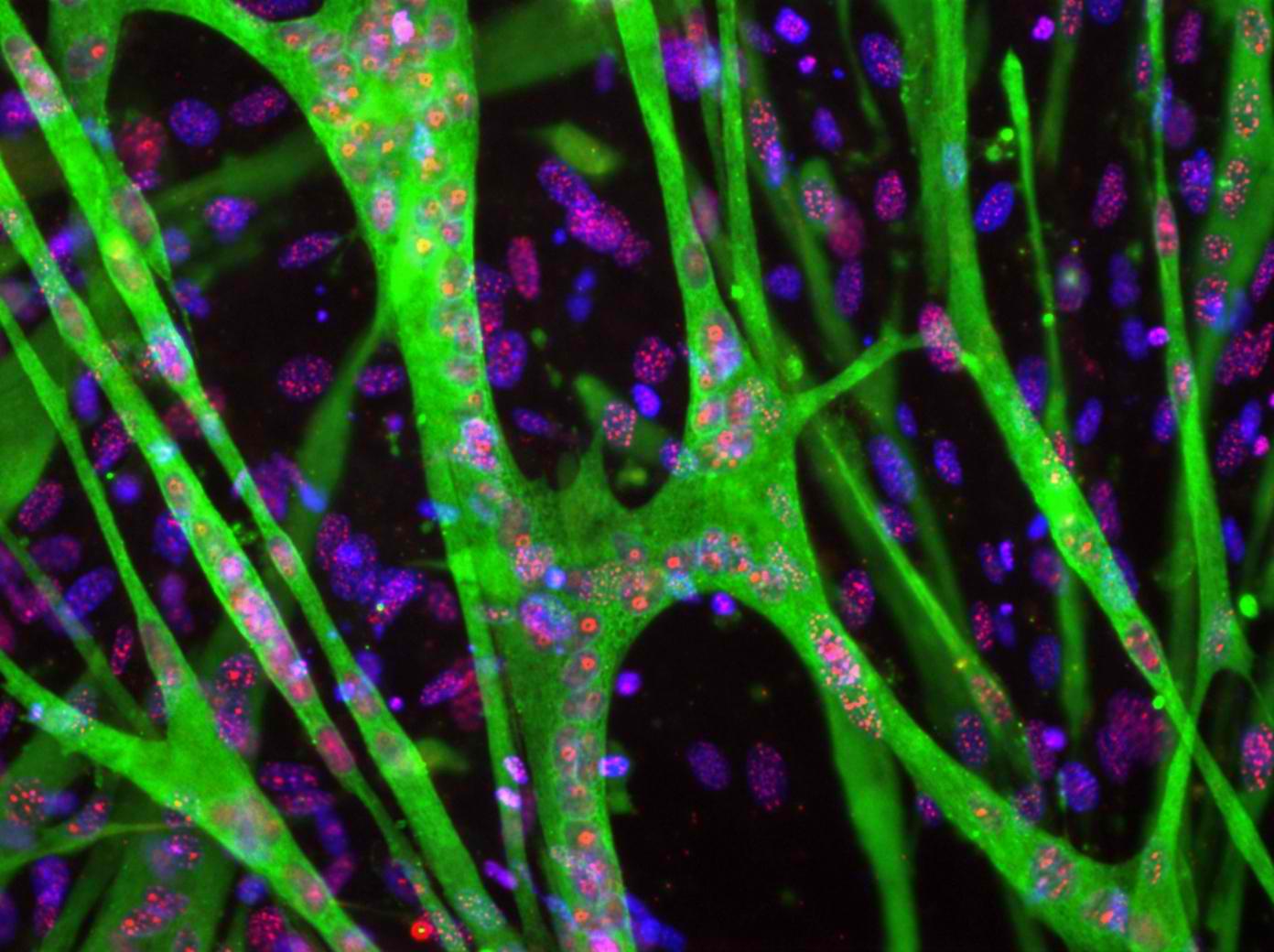
熱衷細胞生物學的邱文泰說,「要當細胞狗仔隊,就要有好的相機大砲,才拍得到細胞生活的秘密。」他認為,現代細胞生物學必須要以活細胞為研究材料,才能深入了解細胞生理機制。而拍攝細胞生理活動的顯微設備,是細胞生物學家依賴的重要工具。
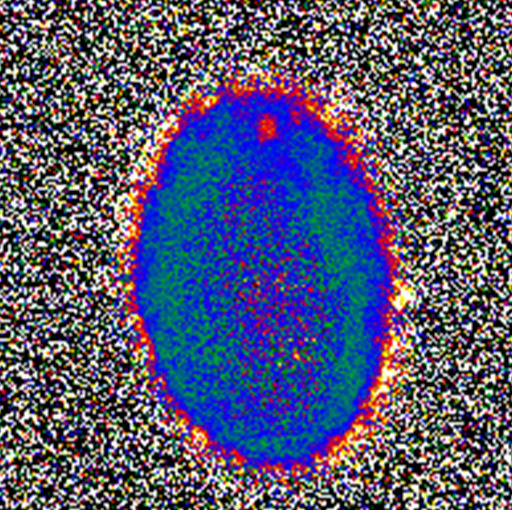
 邱文泰早期拍攝的「藍眼」:以 FRET(Fluorescence resonance energy transfer)技術拍攝 STIM1 分子和細胞膜上 Orai1 分子結合,帶螢光蛋白的目標分子結合時發生能量轉移,STIM1 會將螢光能量轉移給 Orai1,使其發出橘色螢光。
邱文泰早期拍攝的「藍眼」:以 FRET(Fluorescence resonance energy transfer)技術拍攝 STIM1 分子和細胞膜上 Orai1 分子結合,帶螢光蛋白的目標分子結合時發生能量轉移,STIM1 會將螢光能量轉移給 Orai1,使其發出橘色螢光。
邱文泰認為,現代的細胞與分子生物學不同過往,需要以影像證據說服科學家同儕。研究發表的依據不再是間接量化的座標點、折線圖、柱狀圖,他說「現在顯微影像是不可或缺的,甚至立體影像才是學術發表的標準。」
邱文泰分析,隨著類器官(organoid)、層光顯微術(light sheet)、生物組織澄清化(tissue permeabilization)等顯微技術逐漸成熟,精密顯微影像會在生醫研究領域被視為理所然的科學依據。
回想早期接觸的生物學技術,邱文泰笑說,「我那時的研究生都有一件實驗用『戰袍』,上面遍佈黑色斑點,是在暗房被顯影劑沾到的工作痕跡。現在的實驗都用數位影像,研究生恐怕連底片長什麼樣子都不知道。」
邱文泰回憶,數位顯微影像甫推出的時候,學術圈同儕普遍擔心著名期刊不接受新式的數位影像。「誰知道兩三年後,再也沒有人在暗房洗底片!接下來的細胞生物學家,實驗衣都很潔白。」
邱文泰說明,生物學研究會隨著技術演進,愈必要的技術,帶來的改變愈快。他舉例道「傳統的顯微影像以 2D 形式為主,對生物體的模擬有限。3D 影像將是未來生物學研究不可避免的趨勢。」
不僅植入螢光蛋白、使螢光蛋白遺傳、分子標定等技術成為細胞生物學研究的基本配備,科學家還需要精密的顯微設備才能拍好實驗成果。
生醫光學影像核心平台 共享儀器降低門檻,帶來交流
邱文泰說,儀器的成本與操作的確會形成實驗門檻,因此成大醫學院營運生醫光學影像核心平台,聚集校內學者的貴重光學儀器,由專門經理、技術員負責保養、補充、操作事宜。每個實驗室的成員,甚至附近學校的師生、生技廠商都可以申請使用,僅需負擔相當低廉的費用。
 研究生在生醫影像核心平台合作使用倒立雷射共軛焦顯微鏡。
研究生在生醫影像核心平台合作使用倒立雷射共軛焦顯微鏡。
平台內許多貴重儀器都是沈孟儒(成大藥理所特聘教授,現任成大校長)、邱文泰等學者主動提供,他們也樂意無償提供使用教學。擔任平台主持人的邱文泰說,共用貴重儀器可以提升學術圈的整體利益,不但儀器的價值得以充分發揮,研究者們也可以透過平台交流彼此的技術專長。
他舉例道,「最直接的方法,就是看誰最常登記使用特定儀器,就表示他很擅長那項技術,需要的時候可以直接請求合作。」若儀器都留在各自的實驗室裡,這種交流學習的機會無法出現。研究者也不容易嘗試不同儀器的功能,討論不同儀器的優劣長短。
最嚴格的細胞生物學,點燃學術興趣
邱文泰說,自己出身苗栗鄉間,選填大學志願時沒有明確志向,只想離家遠一點。他覺得自然與生物是成長過程中熟悉的一部分,就選填了大多數的生物學科系。就讀成大生物學系,是分發之下的偶然。
在成大生物學系,周遭同學紛紛進入實驗室做專題,邱文泰卻直到大三還沒建立學術志向。直到的必修課「細胞生物學」結束後,他對實驗的興趣才被點燃。那門課由甫從美國歸來的陳虹樺老師任教,教學與考試都相當嚴格緊湊。
邱文泰回憶當年的細胞生物學課說,「期中考和期末考要寫滿四個小時,而且幾乎全部是申論題。考前壓力很大。」但也因為如此嚴格的學習要求,他踏實地讀完課本上每一個字。通過期末考後,心中充滿成就感,決定加入細胞生理相關的實驗室進行專題研究。
融合美式獨立與日式嚴謹,潛移默化的學術人格培養
求學階段多在成大吸收養分,現在也致力培育成大學生的邱文泰,認為對自己影響最深刻的,是湯銘哲(現任成大生理所特聘教授)和沈孟儒兩位學者的風範。
邱文泰說,「湯銘哲老師的心胸開闊,重視自由探索與獨立研究,可說是典型美式風格的學者。碩士班學生的題目要自己發想、設計方法,老師負責引導大方向。」而且湯銘哲對學術同儕非常慷慨大方,隔壁實驗室來借任何耗材與設備,或是需要技術協助,他總是樂意援助。
邱文泰笑說,正因為這種慷慨大方,湯銘哲實驗室的成員經常處於「幫助鄰人」的狀態。他回憶說,「當時覺得很忙碌,但成為實驗室主持人之後,發現自己已經被這種風格潛移默化了。」
邱文泰也以樂於分享、協助的風格領導實驗室。他說,「我的學生也經常幫助其他實驗室的同學,我希望他們在互助、分享的氣氛中成長,成為心胸開闊的人。」
自博士班第二年開始,邱文泰加入新成立的沈孟儒實驗室,接受共同指導。他說,「沈孟儒校長是日式風格的學者,對研究與學術寫作追求完美的高標準。他如果看你的論文草稿寫錯超過三個字,就會請你拿回去重寫。」
邱文泰讚賞說,沈孟儒對科學研究的嚴謹要求,是他的職業楷模。他打開會議室的鐵櫃,數十本厚實日誌整齊排列其中。他說「因為沈老師的指導,我直到今天持續寫著實驗日誌,確實記錄每一天的實驗內容。對學生,我也要求交出完整的實驗日誌,才能從我的實驗室畢業。」
嚴謹治學的風格,呈現在邱文泰的實驗室管理,他們的藥品、抗體集合收納且全體共用,每個人都使用相同規格的研究材料。不會出現各用一套藥品,劑量、藥效不同,實驗結果難以重複的狀況。
他說,「材料的品質控制與共享,對實驗成果的精準化和均一化就是一件好事,也是科學研究的必要。」
邱文泰嚴格要求實驗室各種藥品、器材的擺放秩序,收納之後要編寫目錄和標示,任何人都能一目了然。他打趣說,「小偷闖進我們實驗室,根本不需要翻箱倒櫃,他可以按圖索驥找到所有東西。」
這種嚴謹的管理風格深刻地影響邱文泰的學生。他舉例說,一位博士班畢業生回到廈門大學擔任實驗室經理,按照邱文泰一致化與秩序化的風格整理實驗室,不但讓同事感到驚喜,連周遭實驗室的經理也紛紛來學習這種實驗室管理。
融會了兩位迥然不同的成大傑出學者風範,邱文泰長年投入引導成大學生對知識產生興趣,潛移默化對物嚴謹、對人開闊的高尚人格。因此數次獲得輔導、教學方面的優良教師獎。
鮮為人知的是,他其實差點成為高中教師,遠離成大的學術環境。
探索未知,比收入和安穩的生涯更重要
回憶起職涯轉捩點,邱文泰說,「那是人生最困難的決定。我剛退伍就在台南女中得到正式教師職位。眼看有個穩定、待遇不差的職業選擇,卻又被邀請回去讀博士班。」
邱文泰的考慮相當務實:高中教師的薪資高於社會平均、有退休保障,上下班時間穩定還有寒暑假。而博士班學生薪資不如高中教師,更不容易保持生活與工作的平衡。
收入和閒暇時間考量之外,邱文泰更重視學生對知識的態度,他回憶說,「我喜歡對高中生分享最新科學消息,例如當年諾貝爾獎得主與研究內容。」學生們的反應卻是「這些會考嗎?」
高中生在升學制度訓練下,認為只有考試相關的科學知識才是重要的,而高中教師也必須精熟解題技巧。邱文泰坦承,「我體會到,自己並不想走上鑽研教科書上既定知識與解題技巧的職涯。對我來說,更想要的是親手研究、接觸未知。」
邱文泰說,「跟我同屆考上高中老師的同學已經準備退休,而我還在規劃新的研究計畫、主持與眾人研究息息相關的生醫影像核心平台,但是我覺得這樣很充實。」
主持儀器共享平台,減少科學社群的資本差距;傳授學生知識與潛移默化的人格教育,對邱文泰來說毫無義務感,而是讓生醫領域更加蓬勃明朗的充沛機會。
查看原始文章