文 / 陳壁(蛋雞場現場工作者) 與 Chao-Ping Tung
近日來,由於禽流感的爆發,使得禽流感成為熱門的話題。但是話題鼎沸之際,似乎沒有人出面說明,禽流感,究竟是怎麼樣的一個疾病。
從病毒學理看禽流感
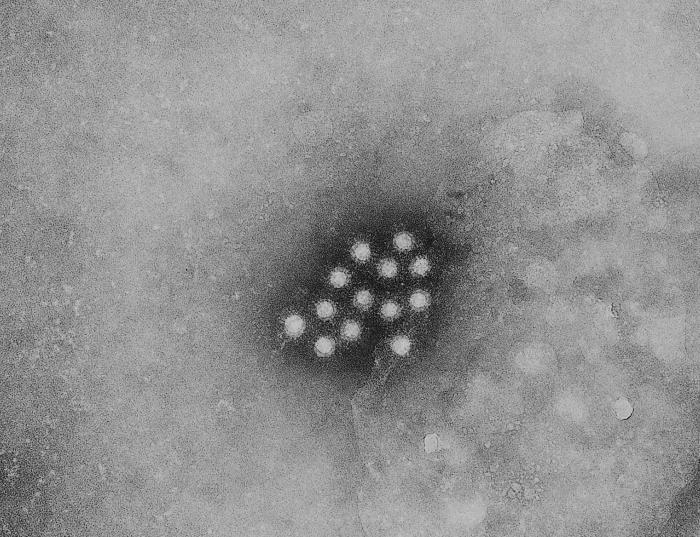
不管人流感、豬流感或禽流感都是流感病毒,目前較為廣泛出現的是A型流感,其基因組是八段負股RNA。流感病毒結構最外面一層是雙層膜,這個膜是病毒離開宿主細胞時,從宿主細胞得來的。在這個膜上面分布有一些蛋白質,其中最重要的就是hemagglutinin (血凝素,簡稱HA) and neuraminidase (神經胺酸水解酶,簡稱NA),也是我們拿來分類流感病毒的依據之一。利用血清學的方式可以將HA分成16類、NA分成9類,而這兩者的血清型組合就是我們一般聽到的H1N1、H3N2、H5N1、H5N2等流感病毒的名稱。流感病毒要進入宿主細胞必須要利用HA先辨認特定的受體,才可進入宿主細胞,接著病毒才可以在宿主體內大量複製,然後離開宿主細胞,再感染附近的細胞。每種HA都只會認特定的受體,H5主要都是認禽類細胞的表面受體,所以H5N1和H5N2都是禽流感,僅會造成禽類的傷亡。但是人類很深層的呼吸道內還是有一些細胞表面受體和禽類類似,所以當人類接觸大量的禽流感病毒時,如果再加上免疫力低下,就很有可能感染禽流感。
禽流感的潛在危險
目前世界上僅有發現H5N1可以經由禽類傳染給人類,但是並沒有發現人傳人的案例,而目前台灣流行的H5N2,世界上並沒有傳染給人類的現象發生,所以一般民眾並不用擔心,經由適當的防範,人類感染到禽流感的機會並不高。禽流感病毒很脆弱,加熱或用酒精消毒就可以殺死病毒。台灣人的飲食習慣並不會吃生蛋生肉,洗選蛋都消毒過,傳統市場的雞隻拔毛前會用熱水燙過,超市的電宰雞肉也都經過檢驗,一般民眾真的不需要太擔心禽流感會危害人體。吃到病死雞肉那又是另一回事,但是並不是吃到禽流感病死雞就會感染到禽流感。
另外,病毒的突變也是人類健康的隱憂之一,就是病毒的變異。每本教生物的書,講到突變這個章節,第一件事情都會說,自然突變發生的機率很低(約莫是10萬分之1),第二件就會說絕大多數的突變對生物都是有害的,最明顯的例子,癌症就是細胞突變所引起的不正常增生。但是如果問我,禽流感會不會有可能發生突變出感染人的型態,我會說,論機會,一定是有的。但是我也要說,這世界有流感的,不是只有禽類,不是只有豬和人,你家裡養的寵物如貓、狗、兔和大部分尤其生活在陸地的脊椎生物,都有流感。如果要論突變出感染人的型態,這世界上目前不會感染人的所有疾病,都有機會。如果你會害怕禽流感病毒,那為什麼就不會害怕目前沒藥可殺且死亡率高的犬瘟熱(狗瘟)病毒?另外一點是,就算是同一種病原引起的疾病,在不同的物種上也不會有同樣的症狀,畢竟最少人類沒有雞冠可以發紺。
另外一個部分,豬的基因因為跟人類有許多相似的部分,會不會有病毒在豬身上交互感染導致發生變異致使產生人傳人的變種的可能?以最近的2009墨西哥流感為例,最後歸類於人的H1N1,但是演化上是從典型豬流感、人流感H3N2和禽流感基因重組後變成北美豬流感H3N2 and H1N2,之後再和歐亞豬流感基因重組才變成墨西哥豬流感傳給人,這中間至少經過20年,而禽流感的基因組佔的比例並不高。從這角度看,禽流感的確有機會經過中間的豬宿主進而變成對人類較具危險性的人流感,但是主要還是豬傳給人而不是禽傳給人。而以現今畜牧業極具分工的特性來說,豬和禽類養在一起的機會不多,要互相傳染機會很少,而豬與人同樣為哺乳類,要被禽流感感染的機率不高。因此就現階段而言,禽流感病沒有立即性對人體的影響。
政府對這次禽流感的處理
以本人從畜牧業的角度來看,政府因為先錯失了對國內發布的時機,雖然禽流感為現階段對人類不具危險性的動物傳染疾病,然而因為可能伴隨著高度的動物死亡率會使國內消費者恐慌,又因為李惠仁導演的記錄片《不能戳的秘密》在網路公開已久,使得這次的禽流感消息只能在「具有擴散之嫌」的時機公布,因此更使此事在社會輿論上難以相容。但是就防疫的觀點上,由於禽流感傳染性強,雖然加工過程中都有經過清洗、殺菌的過程,但仍可能因為出口的禽產品造成他國防疫上的漏洞,因此,在這次的事件中政府沒有通報國際組織,確實是有欠遠慮。
對養雞產業的衝擊
這次的疫情對國內的禽畜業者衝擊相當大,首當其衝的正是養雞產業。畜產業本身由於本身屬於傳統產業,社會階層在一般人的觀念中屬於較低的階層,又因為現在專科學校及大學具有畜產系的學校不多,而從事畜產的農民大多又保守,使得大眾對畜產的觀念,依舊停在一、二十年前的飼養方式。這次禽流感事件,又給了養雞產業重重的一拳。也因此,此次疫情中,雞農其實才是最大的受害者,因為目前禽流感定位上是動物傳染性疾病,該謹慎注意防疫的應該是這些禽畜戶,而非一般消費者。然現在卻因為禽類產品消費意願降低,有些中小型的農場已經離開市場,可預見約莫半年後,會因為市場供需失衡導致禽肉和蛋品的價格大幅上漲。
現今的養雞產業
國內外的畜產行之有年,近年以科學方法研究,在種雞、肉雞、蛋雞三方面,已不可同日而語。台灣因為本土雞種的改良已落後歐洲已經經過數十年的選育改良,因此國內的白肉雞及蛋雞的種禽,多代理國外品種。而這些供應商,多會提供飼養手冊,將該品系經研究的最大飼養效益登錄其中,例如飼養密度(每面積飼養隻數)、飼料營養成分建議、流程、建議體重曲線等。
大眾熟知的白肉雞,以育種改良的方式,在現在若是飼養管理得相當好,曾在業界聽過一般約35日的飼養時間,在32日即達到可屠宰的1.8Kg體重。網路上曾有過傳言,一隻小雞從蛋開孵化到上市只需要20天,是絕對不可能的,因為即使孵化設備再好再先進,胚胎的成長仍有其限制,是不可能再快的──因為光是孵化就需要19日的時間。而自從歐洲推行動物福利至畜牧方面後,台灣亦有一些較具規模的業者先於法令已經開始使用動物福利籠,來豢養種雞或是蛋雞。
畜產講明白一點,就是以動物為主的商業。農民畜養動物的理由,就跟所有上班族一樣,為了獲利養家餬口。而從事商業想要獲利,無非是使用最低的成本獲得最高的利益。但以畜產來說,因為成本出自動物身上,變數就變得相當多。而過度使用藥品,肯定會提高相當成本,例如生長激素就是相當昂貴不符經濟效益的藥品。此外,每個禽畜場依照規定必須聘請駐場的獸醫師,負責用藥以及畜禽的健康管制,必須投藥(例如抗生素)時,需要依照藥品的停藥期(經過身體代謝的時間)調整用藥時間,特別是肉品上市前。而在蛋雞的部分,農政單位有規定蛋中不可有抗生物質檢出,蛋雞在用藥時不可將蛋輸出,因此大部分蛋農都會著重在現場的飼養管理,並以營養輔助避免染疾致使需要使用藥物。藥物有法規的限制,若抽檢時被驗出不合格,可能有被銷毀的風險。一般來說農民都會樂於依照飼養手冊及法令來飼養以避免心血白費。
現在政壇的政治人物,真正具有農業背景的很少,而畜產的從業人員以及政治利益,相對少得可憐。文章前面也說過,大部分的畜產從業人員個性都相對保守,以畜牧現在的社會狀況來看,大多只能依靠財團法人組織如中央畜產會以及中華民國養雞協會等來為其發聲,因此畜牧業多只能配合政府法令或政策,在社會上的力量相當有限。
畜牧現正逢人才旱災,大多的禽牧場正求才若渴,前一代的將退,卻缺乏新一代的新血加入。期許現有的新一代和未來願意加入的新血,能掀起新的畜牧風潮,引領畜產業走向新的時代,讓所有的人都了解,畜產,是什麼樣的產業。
延伸閱讀:
行政院衛生署公告動物用藥殘留標準
中華民國養雞協會 養雞產業簡介