- 乳管原位癌組織切片,圖/wikipedia commons。
近代的癌症研究,已從單純癌細胞的研究擴展到癌細胞所處環境影響的探討,即「腫瘤微環境」研究,包括癌細胞周邊的纖維母細胞、免疫細胞、脂肪細胞等。中央研究院基因體研究中心特聘研究員兼中國醫藥大學校長李文華院士所帶領的團隊,分別針對微環境內兩種免疫細胞及脂肪細胞進行深入研究,找出助長乳癌細胞壯大的機制,為乳癌治療提供更充分的資訊。
首先,在乳癌模式小鼠的淋巴結中,若剃除腫瘤引流淋巴結的免疫細胞 Tregs,便可抑制該淋巴結內癌細胞 IL-17RB 基因的活化情形,並降低癌細胞的毒性。若將乳癌模式小鼠的腫瘤引流淋巴結以手術移除,乳癌細胞擴散的機率就會大幅降低。此研究結果對於在診治上不確定是否要切除淋巴結的醫師而言,提供了明確的指標,同時也確認發展 IL-17RB 抗體是治療乳癌可行的方向之一。研究成果已於 10 月 9 日發表於《EMBO 分子醫學》 (EMBO Molecular Medicine)期刊。
當乳癌細胞轉移到「腫瘤引流淋巴結(tumor-draining lymph nodes, TDLN)」時,醫師即可藉此瞭解腫瘤惡化的程度,但究竟是否有必要進行手術治療?論文第一作者,本院基因體中心博士後研究人員黃世嘉博士表示,在黑色素瘤的診療上,目前已有數據證明,切除腫瘤附近的淋巴結,對之後有正向關聯,但在乳癌治療卻尚未有定論。甚至有些人認為,乳癌細胞在淋巴結內,並無特別的影響力,而這個轉移的資訊,目前僅用於判定癌症的期別為主。
淋巴結有好多免疫細胞,為何癌細胞還敢擅闖?
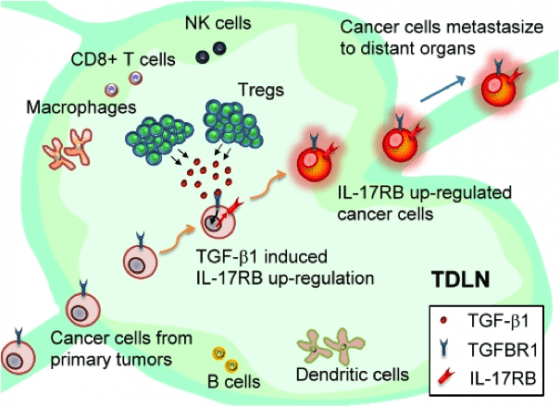
在淋巴結這個微環境內,其實充滿了各種免疫細胞,對於癌細胞似乎並不是一個能安身立命的地方,但為什麼癌細胞仍會選擇移動至此呢?
研究團隊為一探究竟,與臺大醫學院多位醫師合作展開研究後發現,在各式各樣的免疫細胞裡,有一種「調節性免疫 T 細胞 (Regulatory T cells 簡稱 Tregs)」,作為一個矯正型的角色,當其他免疫細胞過度活化時,Tregs 則會分泌 TGF-β1 分子進行控制與調節。然而,當乳癌細胞進到淋巴結時,Tregs 所分泌的 TGF-β1 分子將反而助長乳癌細胞內 IL-17RB 基因的活化,進而增強乳癌細胞的毒性。
人體全身除了負責輸送血液的血管之外,淋巴管也是一個遍布全身且整體連通的系統,而淋巴管因為不像血管有來自心臟的壓力,所以流速較慢,更適合細胞通過。這對於蠢蠢欲動於開疆闢土、持續擴散的癌細胞,是個絕佳的通道;在淋巴管內,癌細胞可以穩定流動,更可在這個休息站休息,而這個休息點即為淋巴結。在醫學上,連通腫瘤的淋巴結,便是「腫瘤引流淋巴結」。研究團隊已證實,腫瘤引流淋巴結內的免疫細胞會分泌 TGF-β1 分子,該分子會促使腫瘤引流淋巴結內的乳癌細胞增加 IL-17RB 基因的表現,進而增加了乳癌細胞擴散的能力。
乳房較大罹患乳癌的風險較高?脂肪細胞與乳癌細胞的關係
另一方面,團隊的研究也指出,除了免疫細胞外,乳癌患者的脂肪細胞亦是助長乳癌細胞壯大的利器。乳癌細胞和其鄰近脂肪細胞的互動,是一個尚有許多未知數的研究領域,臨床觀察指出,乳房較大的女性,罹患乳癌的風險較高,顯示脂肪細胞在乳癌細胞微環境的重要性。本研究團隊透過取得乳癌患者的脂肪組織,針對乳癌細胞與脂肪細胞的關係進行研究並發現,脂肪細胞透過分泌 β-HB,促進 MCT2 高表現的乳癌腫瘤增生,該研究並於 106 年 3 月發表於《自然通訊》 (Nature Communications)期刊。
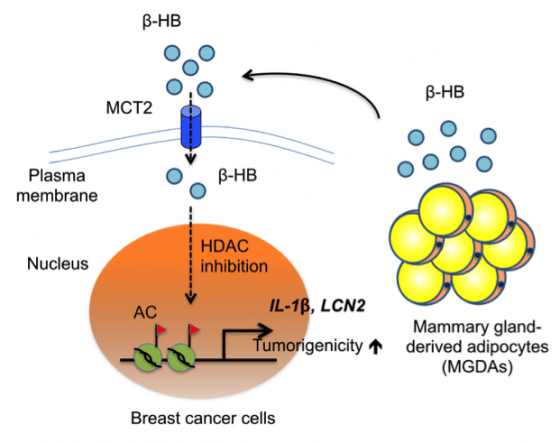
根據該文章第一作者黃俊凱博士敘述,他們的研究與先前研究不同點在於,直接從乳癌患者的脂肪細胞角度切入。針對乳癌細胞株全基因圖譜分析並搭配文獻瀏覽,找出一個表現於乳癌細胞膜上,同時在脂肪細胞互動上扮演重要角色的基因 MCT2。而在臨床中,MCT2 的高表現量伴隨著較差的預後。
MCT2 的主要功能在於傳遞,且位於乳癌細胞膜上的閘口,在功能上可以讓 β-羥基丁酸 (β-HB)分子進出。研究發現,脂肪細胞分泌的 β-HB,可促進 MCT2 高表現的乳癌腫瘤增生。因此,脂肪組織在 MCT2 高表現的乳癌患者,反倒成為幫助乳癌壯大的角色,以 MCT2 做為標的進行治療或許可成為乳癌治療的另一道曙光!
參與上述研究者,除本院基因體中心的研究團隊外,還包括臺灣大學醫學院附設醫院外科部的張金堅醫師、黃俊升醫師、郭文宏醫師,及病理部的鄭永銘醫師等人。另外要感謝基因體中心蕭宏昇研究員提供動物實驗的協助。
- 本文改寫自中央研究院新聞稿。
參考資料
- TGF-β1 secreted by Tregs in lymph nodes promotes breast cancer malignancy via up-regulation of IL-17RB
- Adipocytes promote malignant growth of breast tumours with monocarboxylate transporter 2 expression via β-hydroxybutyrate
































