- 編譯/李紀潔、羅鴻|陽明大學基因體科學研究所畢業生
蔣維倫|喜歡虎斑、橘子、白底虎斑、三花貓。曾意外地先後收集到台、清、交三間學校的畢業證書。泛科學PanSci專欄作家、上下游新聞市集公民寫手、故事專欄作家。

陽光不僅是許多生命體的能量來源,也是影響不同時刻溫度、濕度等條件的因子。因此,地球上各個層級的生物體內演化出的生理時鐘(Biological clock),就扮演著協助生物感知時間流逝、日夜交替以做出特定行為的重要角色。但這套神奇的生理時鐘到底是如何運作呢?
今年的諾貝爾生理醫學獎得主 Jeffrey C. Hall、Michael Rosbash 和 Michael W. Young 的研究即打開了這扇窗,讓我們可以一探到底植物、動物和人是如何調適體內的生物時間,讓其與地球的運行同步。
他們在果蠅身上找出一個能控制生物每日生活節律的基因。此基因生產出的蛋白質會在夜間累積,並且在白天降解。他們進一步的研究發現這套調控機制的其他蛋白質,由此揭示了生理時鐘的分子機制。現在我們已知其他多細胞生物,包括人類都是透過相同的原理來調控生理時鐘。
這套精準的生理時鐘協助我們管理了生物行為、荷爾蒙濃度、睡眠、體溫、新陳代謝等。當我們的外部環境和體內生理時鐘有差異時(如:搭乘飛機跨越時區生活),我們的身體會受到影響。而近來也有證據推測,如果我們的生活作息和生理時鐘長期地無法一致,那麼將會增加許多疾病的風險。
生物體內看不見的時鐘,正在滴答滴答
絕大多數的生物體能夠感測並適應生活環境中的變化。18世紀時,天文學家 Jean Jacques d’Ortous de Mairan 研究了含羞草,他觀察到了含羞草的葉子在白天時向著陽光,並在晚上時關閉。當他將含羞草放在永遠黑暗的環境時,發現葉子仍依照著原來的時間打開、關閉,因此他猜測含羞草體內有著自己的生理時鐘。
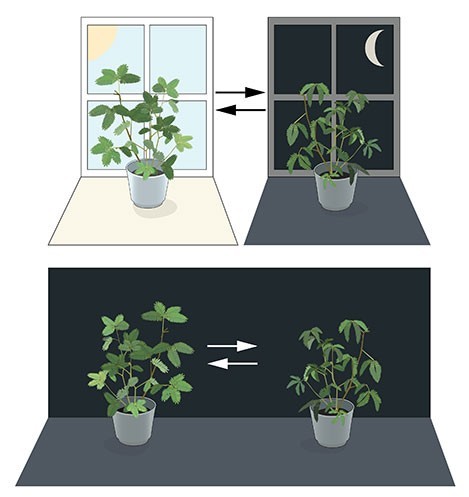
後續的研究學者發現不只是植物,其他的動物甚至於人類也都有類似的生理時鐘。科學家命名這種生理節律現象為晝夜節律(Circadian rhythm;又稱日夜節律、概日節律、日變週期),但生物體內的生理時鐘如何運行仍舊是個謎題。
從果蠅身上發現的「週期」基因開啟生理時鐘研究之路
上個世紀的70年代,Seymour Benzer 和 Ronald Konopka 利用基因突變的方法發現調控果蠅生理時鐘的基因,他們將此基因命名為「週期(period)」。但是這個基因是如何調整這些小昆蟲的生理時鐘呢?
為了回答這個問題,Brandeis 大學的 Michael Jeffrey Hall、Michael Rosbash 以及 Rockefeller 大學的Michael Young 分別成功的分離和分析了「週期」基因。Hall 和 Rosbash 更進一步發現了「週期」基因轉錄而成的 PER 蛋白質會隨著日夜週期改變其表現量;PER 蛋白質會在夜晚時累積在細胞內、白天時被降解,以 24 小時為週期,隨日夜同步持續變化。
環環相扣的基因調控
接下來的問題是,生物體如何建立及維持生理時鐘的波動?Jeffrey Hall 和 Michael Rosbash 的假設是 PER 蛋白質對於自身有負回饋機制。換言之,PER蛋白質會抑制 「週期」基因的轉錄和轉譯,當 PER 蛋白質的濃度高於一定程度時,會回過頭來抑制自己的生產。而這樣的負回饋機制造就了穩定的生理時鐘循環。
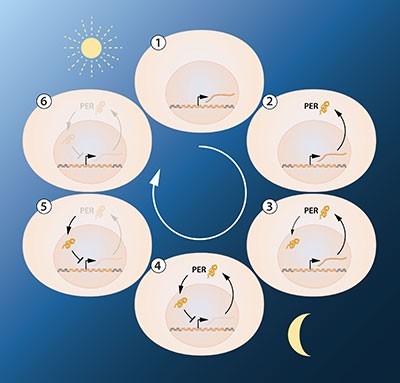
這個理論很吸引人,但留下了幾個延伸的問題未解,其中之一就是──在細胞質產生的的 PER蛋白質,要如何在夜晚時進入細胞核去抑制「週期」基因呢?1994 年,Michael Young 發現了另一段關鍵的基因──「永恆(timeless)」。「永恆」基因產出的蛋白質-TIM 蛋白質能和 PER 蛋白質結合並進入細胞核,完成上述學者所假設的負回饋機制。
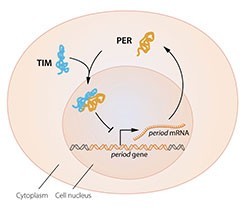
晝夜節律中, PER蛋白質隨日夜循環的機制已經有了清楚的解釋,那循環的週期又是透過何者調控呢?Michael Young 在 1998 年發表於期刊《細胞》(Cell)期刊之研究,發現另一個基因「雙倍時間(doubletime)」。其所生產的 DBT 蛋白質會延緩 PER 蛋白質的累積,以協助細胞調節生理時鐘能更接近一天24小時的週期。
得獎者們突破性的研究替生理時鐘領域打下了重要的基礎。後續的研究也陸續地發現其他參與生理時鐘的基因,並更進一步闡明生理時鐘的功用和穩定性。像是科學家也在人類上找到了某些生理時鐘基因的突變,會造成人整體生理時鐘提早4小時的「家族性睡眠象限提前綜合症」(FASPS)。
好好遵守時間啊,我們的生理狀態
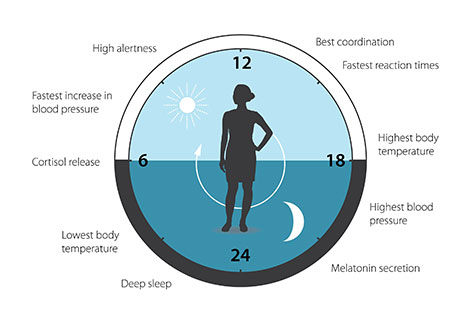
從過去到現在的研究都證實生理時鐘深深地影響我們的生理狀態。我們現在已知人類和多細胞生物都用類似的機制來調節體內的生理時鐘。我們體內大多數的基因都受到生理時鐘的調控,調節精準的晝夜節律機制協助我們的生理與每天的作息同步。奠基於三位獲獎者的不凡研究,研究生理時鐘的領域已經發展成一個重要和活躍的範疇,並持續影響著我們的健康。
如果你生活在「日不落」的國度……
住在高緯度的人在冬夏時會經歷永晝、永夜等現象,而長時間看不到太陽/天黑都可能造成憂鬱傾向,甚至導致失眠和誘發自殺。
那長年居住在冰雪中的其他生物怎麼辦呢?研究指出馴鹿的細胞雖然也有表現 Per2 和 Bmal1 基因這兩個生理時鐘的基因,但是他們卻沒有明顯的24小時的週期變化。科學家推測因為在長晝長夜的環境中,擁有穩定的生理時鐘反而會拖累身體適應周遭的環境。況且比起擁有每天準時起床的能力,馴鹿更在意不要錯過繁殖季的到來,不然錯過又要再等一年啦。

參考文獻:
- 諾貝爾獎官方新聞稿
- LeGates, T. A., Fernandez, D. C., & Hattar, S. (2014). Light as a central modulator of circadian rhythms, sleep and affect. Nature Reviews. Neuroscience, 15(7), 443.
- Paul, M. J., & Schwartz, W. J. (2010). Circadian rhythms: how does a reindeer tell time?. Current Biology, 20(6), R280-R282.