編按:CRISPR技術的誕生,讓人類有機會隨心所欲編輯基因體,這項技術將替我們帶來怎樣的未來?在這樣的未來中,又有哪些挑戰與爭議等著我們去克服?泛科學本月選書《基因編輯革命》除了簡介 CRISPR 技術的前因後果,作者珍妮佛・道納更嘗試借本書揭開關於此項重大技術的爭端與討論。
人類從未如今日主宰了生物世界
數十億年來,生命的發展基本上依循達爾文的演化論:
生物體透過一連串的隨機遺傳變異而發展,當中有些變異賦予生物生存、競爭和繁殖上的優勢。
到目前為止,人類這個物種也受到這種過程的塑造。一萬年前農業活動出現時,人類開始對動植物進行選擇育種,產生一股推動演化的力量,不過演化的初始材料,也就是構成遺傳變異的隨機 DNA 突變,仍然來自於自發的隨機過程。人類這個物種改變自然的力量僅止與此,只取得有限的成功。
今日的世界則徹底改觀,不能再與過去同日而語。科學家成功掌握上述原始過程,完全將其轉化成由人類來控制的局面。利用強大的生物技術工具來修復活細胞內的 DNA,科學家現在可以操縱並合理修改定義地球上每個物種的遺傳密碼,包括我們自己的在內。
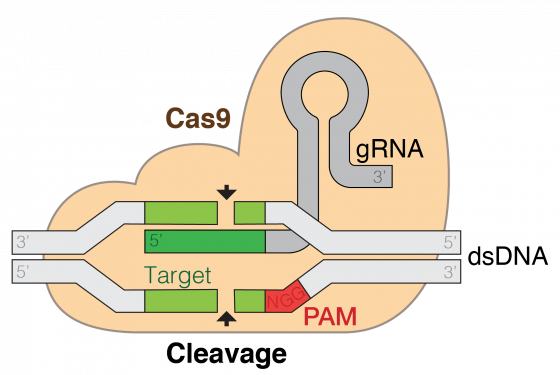
在種種基因工程工具中,最新且堪稱最有效的,便是 CRISPR-Cas9(簡稱 CRISPR)。生物包含的所有DNA,包括所有基因,稱為基因體,CRISPR 這項技術幾乎可以編輯生物體的整個基因體,而且就像編輯文章的一個小段落那樣容易。
只要知道特定表徵的遺傳密碼,科學家就可以利用 CRISPR 技術,在幾乎任何動植物的基因體中,進行插入、編輯或刪除相關基因的操作。這個過程比現有的其他基因操作技術要簡單得多,而且更為有效。這是一個革命性的時代,其可能性只受到我們集體想像力的限制。
改造動物與植物
動物界是這項基因編輯新工具最早大展身手的地方,也可說是迄今為止這項技術最大的實證場域。比方說,科學家利用 CRISPR 編輯山羊的基因體,使其生長出更多的肌肉(也就是產生更多的肉)和更長的毛(意味著產生更多的喀什米爾羊絨纖維)。甚至有遺傳學家使用 CRISPR,讓亞洲象的 DNA 變成接近長毛猛象的 DNA,希望有一天能使這種滅絕的巨獸死而復生。
與此同時,CRISPR 也進入植物界,廣泛應用在作物基因體的編輯上,為農業進展開創一條新路,可望大幅改善世人的飲食營養,確保世界糧食安全。基因編輯實驗已經產生了抗病稻米、成熟速度緩慢的番茄、具有更多健康的多元不飽和脂肪酸的大豆,以及神經毒素(含量較低)的馬鈴薯。食品科學家目前正在直接改變生物體自身 DNA 密碼中的幾個字母,微調其遺傳特徵,達到改良的目的;而不是以基因轉殖技術,將一物種的 DNA 剪接到另一物種的基因體中。
消滅人類的疾病
儘管在全球動植物上的這些應用令人興奮不已,然而基因編輯技術對我們這個物種的影響,才是真正備受矚目的焦點。

在最近的實驗中,已經利用CRISPR 來將豬的 DNA「人源化」(也就是讓豬的 DNA 更接近人類的 DNA),未來可望將這些動物轉變成人體器官的捐贈者。CRISPR 也進入到新的蚊子品系中,在一項將新表徵快速傳到野生蚊子族群的計畫理,動用到這項技術來處理蚊子的基因體。科學家希望最終能夠消除蚊子傳播的疾病,如瘧疾和茲卡病毒感染症等,甚至是消滅那些攜帶病原的病媒蚊。
在許多疾病的治療上,CRISPR 有直接在人類患者身上編輯和修復突變基因的潛力。在實驗室培養的人類細胞中,已可用這種基因編輯新技術來修正由基因突變造成的種種疾病,如囊腫纖維症、鐮形血球貧血症、和嚴重複合型免疫缺乏症等。CRISPR 得以讓科學家在構成人類基因體的三十二億個DNA密碼中,尋找並修復不正確的單一密碼,而且還可以用於進行更複雜的修改。研究人員可以只移除突變基因的受損區域,完全沒有碰觸到基因其他部分,就能治療因為 DNA 錯誤而引起的杜顯肌肉萎縮症。

基因編輯的治療用途,正在不斷擴充。由於CRISPR技術能夠精確,並且相對直接的編輯DNA,這無異是將過去無法治療的每種遺傳疾病轉化成可治療的目標,至少在那些我們確知是由基因突變造成的疾病可以如此應用。
編輯下一代的DNA?
此外,一旦我們具備有能夠將胚胎的突變基因轉化為「正常」基因的技術,肯定會有人想要將正常基因再升級為所謂的「超級」基因。我們應該要編輯未出世的孩子的基因,來降低他們日後罹患阿茲海默症、糖尿病或癌症的機率嗎?那麼加強未出世的孩子的有益特質,例如更有力量、增強認知能力,或是改變身體特徵,好比說眼睛和頭髮的顏色呢?在人類基因的操縱上,要在哪裡定出底線,這是基因編輯技術讓我們不得不面對的棘手議題。

最大的癥結點是,現代人類存在的近十萬年來,智人的基因體一直僅受到隨機突變和天擇這兩股力量所塑造。如今,人類首次擁有編輯每一個個體的DNA的能力,不僅是現存的族群,還可以編輯下一代的DNA,基本上可說是達到控制我們這個物種演化的程度。
這麼重大的技術,必須開啟各方討論
2012 年,我和其他科學家一起發表了一篇奠定 CRISPR 基因編輯技術的研究報告,從此控制人類物種演化的想法,就在我腦海中徘徊不去。

當科學家把 CRISPR 技術運用在靈長類動物胚胎上,來創造第一隻基因編輯猴時,我自問,距離那些離經叛道的科學家嘗試人體試驗的時日還會有多遠。
過去,我傾向將這些討論留給真正具備生物倫理學背景的人,自己專心留在有趣的 CRISPR 生化研究上。但身為開發此一領域的一份子,我深覺有責任協助引導關於這些技術應用的對談,討論其應用的可能性與限制。
最重要的是,我想要確保這些討論不僅是在研究人員和生物倫理學家進行,還得擴及到社會科學家、政策決策者、宗教領袖,監督機構和公眾等種種利益相關者。鑑於此項科學發展足以影響到全人類,似乎有必要廣納社會各界的聲音。更重要的是,我覺得在進一步應用這項技術前,應當即刻展開對話。

因此,在 2015 年,當我一邊在柏克萊運作自己的實驗室,並且在世界各地參加學術界的各項討論會和研討會時,也開始花更多的時間回覆對我來說全然陌生的主題。我回答了記者的種種提問,從設計嬰兒、人豬雜交,到以基因工程打造「超人」的想法。我向加州州長、白宮科技政策辦公室,乃至於中央情報局簡介紹何謂 CRISPR,甚至到美國國會的會議廳中講解這一切。
我籌劃了首次針對基因編輯技術,特別是 CRISPR 的倫理議題會議,討論這項在生殖生物學、人類遺傳學,到農業、環境和保健各領域愈來愈活躍的技術。那時我希望這場針對這項議題的首次會議能夠拋磚引玉,由此激發出更大型的國際高峰會,集結美國、英國、中國和世界各地的科學家,與其他領域的人士,一起來討論人類基因編輯的議題。
本文摘自《基因編輯大革命:CRISPR如何改寫基因密碼、掌控演化、影響生命的未來》,遠見天下文化出版股份有限公司,2018 年 5 月出版。