作者:蕭艾琳|台灣大學微生物學研究所
試想一桶摻冰的冷水當頭澆下,沁涼得讓人直打哆嗦,毛孔自然全縮了起來, 渾身僵直,處在原地無法動彈──這種短暫引起的不適,宛如被禁錮在己身的感覺,竟是長期伴隨著肌萎縮性脊髓側索硬化症(Amyotrophic Lateral Sclerosis, ALS)患者,俗稱漸凍人,或者眾人耳熟的是另個更加響亮的名稱「路‧蓋里格氏病」,得名於曾在大聯盟紐約洋基隊效力的棒球明星,卻因病被迫提前結束大好職業生涯的路‧蓋里格(Lou Gehrig)。
今年夏天藉由社交網路平台,主要是推特和臉書的群起響應,如病毒般傳播開來的冰桶挑戰(Ice Bucket Challenge)發起者彼得‧福瑞特(Peter Frate),前波士頓大學的外野手,和路‧蓋里格有著相似的命運,皆在巔峰的青壯年時期發病,終其一生得和目前醫界仍束手無策的神經退化性疾病搏鬥。之所以發起這個 看似八竿子打不著一氣的活動,無非是希望透過簡單的親身體驗,可以喚起世人對罕見疾病的重視,並慷慨解囊捐獻給肌萎縮性脊髓側索硬化症協會(ALS Association,ALSA),爭取病友的福利和資助新興療法的研究。

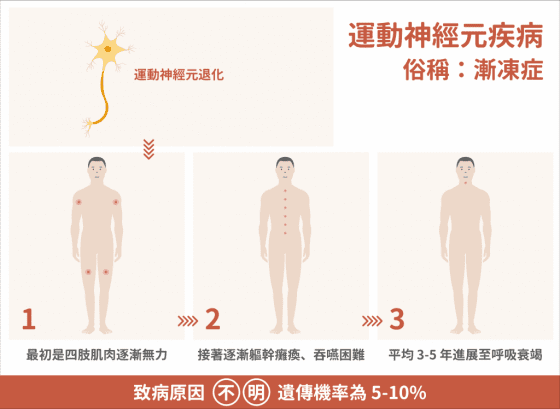
ALS 是成人最常見的運動神經元疾病(Motor Neuron Diseases,MND),距 今約一百六十年前由法國現代神經學之父讓-馬汀‧沙可(Jean-Martin Charcot, 1825-1893)醫師發現首例病患的臨床病徵,其名 Amyotrophic 源自於希臘字根, 意義為「無肌肉滋養(no muscle nourishment)」。
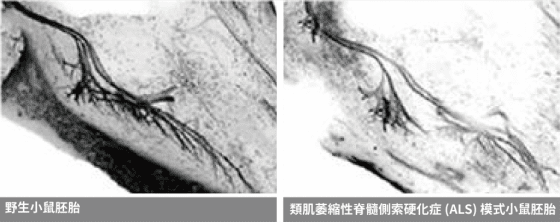
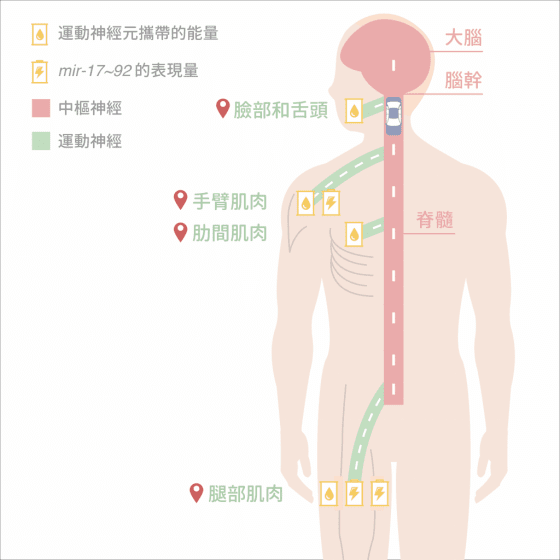
顧名思義,正常人身上負責傳遞收縮訊息給肌肉的運動神經元 (motor neuron)選擇性死亡,由於無法接收到上或下游運動神經元傳訊,其調控的肌肉會逐漸地萎縮,且因病程迅速,常侵犯腦部或脊髓,發病後兩到五年內患者將失去對隨意肌的控制能力,起先是出現無力、口齒不清、流口水等症狀,嚴重者則造成全身癱瘓、呼吸衰竭,甚至死亡。
如此可怖的疾病,並不影響接收外界刺激的感覺神經元(sensory neuron), 故患者儘管意識清醒,知曉周遭發生的事物,卻動彈不得的困在病榻上,飽受病魔煎熬,實是心靈層面的牢獄。

ALS 屬於全球普及率十萬分之五的罕見疾病,縱然科技日新月異,美國食品藥物管理局(Food and Drug Administration,FDA)唯一核可的藥物銳利得 (Riluzole)卻也只能做到趨緩病程,降低一半以上的死亡風險,但患者最終仍會因呼吸肌無力而死亡。
正因目前仍未出現有效治療 ALS 的方式,與其繼續坐等國際大藥廠評估孤兒藥成本與利潤的拿捏,ALS 病患與其家屬挺身成立的互助組織 ALSA,主動發起轉譯研究進階治療 ALS 計畫 (Translational Research Advancing Therapy for ALS,TREAT ALS),因有鑑於許多機構包含美國國家衛生研究院(The National Institutes of Health,NIH)在內,皆有 ALS 的致病機轉背景研究,故該計畫轉而將目標放在建立起頂尖科學團隊和商業投資之間的橋樑,並非只是短期的治療策略,其旨在於結合現有與新開發的藥物,支持實驗性療法加速進入美國食品藥物管理局(Food and Drug Administration,FDA)核准的臨床試驗,通過後再具體應用在病人的治療上。
根據今年 ALSA 旗下發行的刊物《今日 ALS 研究》(Research ALS Today,簡稱 RAT)春季號報導,介紹了現今極具發展潛力的反義寡核苷酸(Antisense oligonucleotides,ASOs)療法。
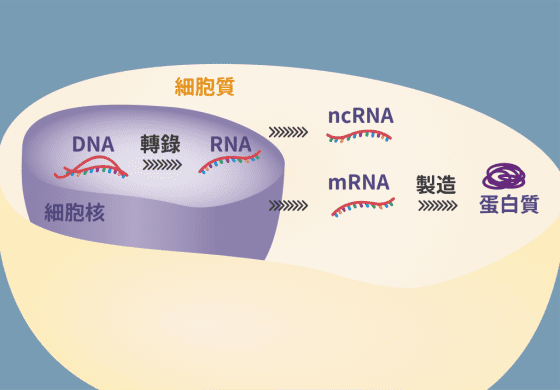
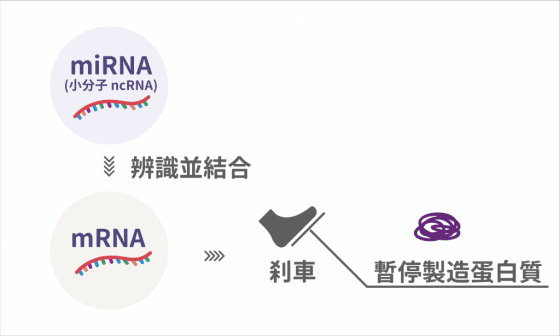
所謂的反義寡核苷酸為短單股去氧核醣核酸分子,可想像是條成串的圓珠,一旦被神經細胞內吞進去,可以選擇性鎖定分子機制作用,像是超氧化物歧化酶 (superoxide dismutase, SOD1)的蛋白質製造,其作用方式並非修正突變的基因,而大多設計成減少獲得功能(gain-of-function)突變帶來的傷害。然而,在特定情況下,它亦可增加基因產物來克服剪接(splicing)所致的缺陷。目前此治療策略的發展是針對脊髓肌萎患者,尤其是運動神經元存活(survival of motor neuron,SMN)蛋白質的功能缺失所致的小兒運動神經元疾病,同時也有潛力運用在治療亨丁頓氏症、阿茲海默氏症和強直性肌肉失養症。
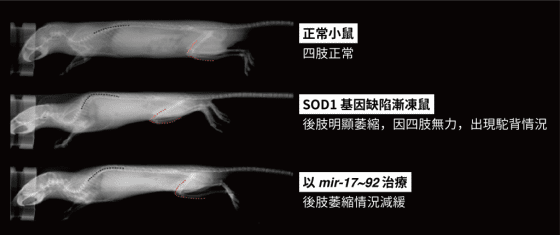
舉例來說,目前已知 SOD1 的主要功能為分解人體內的自由基,避免細胞遭受損害,而 SOD1 基因突變會造成百分之二十的家族性 ALS,以及約百分之二 的其他型 ALS。
以 ASOs 治療 SOD1-ALS 的先驅研究團隊,來自 ALSA 贊助的科學家克里夫蘭醫師(Dr. Cleveland)和神經研究中心的理查‧史密斯博士(Richard Smith, M.D),與加州卡爾斯巴德(Carlsbad, CA)的 ASOs 發展者伊希斯製藥(Isis Pharmaceuticals)合作,先是實驗SOD1-ALS 老鼠模型,結果發現此治療可以延緩百分之三十七的疾病進程速度,相較預期症狀出現的時間點延後。
再進一步按比例應用至第一期人體試驗階段,其設計如下:隨機分配病患至四組,每組八位,以脊髓注射藥物的方式施用百憂解或抗 SOD1 ASO 超過十一個半小時(六位採主動治療,另兩位則服用百憂解),並於安全的情況下提高藥物劑量,經過二十八天的周期後再進行新的調整。
經過實驗組和控制組的結果比較,科學家發現,兩種藥物的不良副作用發生頻率相近,且主要和試驗步驟有關,故可初步排除劑量限制性毒性(dose-limiting toxic effects)、安全性或耐受性上的疑慮。另外,由於最初臨床階段尚未評估 ASO 藥效,目前該團隊正在著手使用新的寡核苷酸骨架和核醣核酸目標物,來修正治療策略。
在 SOD1 ASO 治療層面得到突破性的進展,科學團隊將目標放眼到對 ALS 影響甚鉅的標靶基因 C9ORF72,其造成百分之四十的家族性 ALS,以及百分之六的零星疾病。
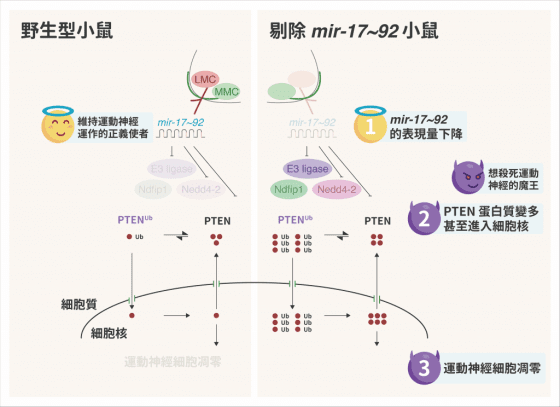
目前 C9ORF72 致病機轉的主流假說為六個核苷酸 GGGGCC 為一單位的重複性擴增,使得核醣核酸轉錄出數百或數千個產物,如此一來,當核醣核酸摺疊成立體結構時,會困住轉錄因子,進而改變細胞的代謝機制,甚至會轉譯出錯誤摺疊型態的蛋白 repeat-associated non ATG(RAN),此類突變同時也會造成正常 C9ORF72 蛋白數量的衰減。

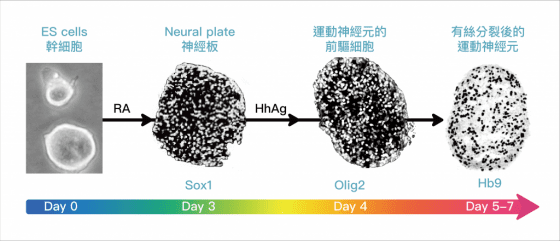
然而,透過源自於病患的誘導性多功能幹細胞(induced pluripotent stem cells, iPSC)轉化成運動神經元後進行實驗,幾個不同的團隊研究顯示 ASOs 的確可減少 C9ORF72 病理現象,包含核醣核酸的聚集、轉錄因子的異常結合、無法調節其他基因的表達、對於穀氨酸(glutamate)興奮毒性(excitoxicity)的感受性, 和神經元性放電異常──但非所有異常皆對治療有反應,像是 RAN 轉譯產物、由去氧核醣核酸對應股的 CCCCGG 重複引起的核醣核酸聚集等,ASOs 是為無效治療,仍需更多研究上的突破。
著名的英國物理學家史蒂芬‧霍金(Stephen Hawking,1942-),自二十一歲確診為 ALS 開始,已超出當時醫生認定只能再多存活兩年的預測,目前與疾病共存已超過五十載,他以自身努力證實生理方面的殘疾無法腐壞堅強的心靈,曾幽默的如是說道:「我察覺到即使很多人主張一切都是命中註定的,而且我們無 法改變任何事情,他們在過馬路前還是一樣會停下來左右張望。」
現階段雖有許多未知的謎團靜待解開,前方的研究之路依然漫漫,如何克服接踵而來的挑戰,尋獲緩解 ALS 病友們不適和家屬煎熬的良方,這是一桶桶冰水也無法澆熄的熱情,更是科學家們堅持不懈、獻身研究的最大動力。
資料來源
- Research ALS Today (The ALS Association, Volume 14, Spring 2014)
- Pete Frates: A profile in ALS courage. ESPN MLB [July 04, 2014]
- Pete Frates
- 冰桶挑戰:痛苦的失真。苦勞網[2014/08/19]
- 衛教資料-運動神經元病變篇。台大醫院
- Facts About Amyotrophic Lateral Sclerosis (ALS or Lou Gehrig’s Disease)
- 中華民國運動神經元疾病病友協會
- Northeast ALS Consortium
- ALS Association
參考文獻
- Smith RA, Miller TM, Yamanaka K, Monia BP, Condon TP, Hung G, et al. Antisense oligonucleotide therapy for neurodegenerative disease. J Clin Invest. Aug 2006;116(8):2290-6. Epub 2006 Jul 27.
- Miller TM, Pestronk A, David W, Rothstein J, Simpson E, Appel SH, et al. An antisense oligonucleotide against SOD1 delivered intrathecally for patients with SOD1 familial amyotrophic lateral sclerosis: a phase 1, randomized, first-in-man study. Lancet Neurol. May 2013;12(5):435-42.
- Sareen D, O’Rourke JG, Meera P, Muhammad AK, Grant S, Simpkinson M, et al. Targeting RNA Foci in iPSC-Derived Motor Neurons from ALS Patients with a C9ORF72 Repeat Expansion. Sci Transl Med. Oct 23, 2013;5(208):208ra149.
- Donnelly CJ, Zhang PW, Pham JT, Heusler AR, Mistry NA, Vidensky S, et al. RNA Toxicity from the ALS/FTD C9ORF72 Expansion Is Mitigated by Antisense Intervention. Neuron. Oct 16, 2013;80(2):415-28.
- Lagier-Tourenne C, Baughn M, Rigo F, Sun S, Liu P, Li HR, et al. Targeted degradation of sense and antisense C9ORF72 RNA foci as therapy for amyotrophic lateral sclerosis and frontotemporal dementia. Proc Nat Acad Sci USA. Nov 19, 2013;110(47):E4530-9.