想必你一定有在新聞媒體上看過這樣的標題:「癌症病患新曙光,XX 抗癌藥在動物實驗上表現亮麗!」。但大部分的藥物進入臨床試驗後,卻常常出現藥效不佳的結果,動物實驗和人體試驗之間,似乎有一道難以跨越的鴻溝。
針對這個問題,近期發表在 Nature Communications 上的研究提出一種可能的解釋1。
動物模式?癌症動物模式?
動物實驗是藥物開發中非常重要環節,藥物必須先在動物實驗中確認其機制、劑量與副作用等多種資訊和安全性後,方能進入臨床試驗。當然,抗癌藥物也不例外。
所謂的動物模式,就是指「在動物身上進行生物、行為之研究成果,及在動物產生的先天或誘發性病理變化,在人類或另種動物有類似現象,以作為參考,此稱為動物模式」2。
其中,當動物模式用於癌症時,我們可以稱之為癌症動物模式,用於測試癌症新藥的實驗動物中,實驗小鼠因其成本低、體積小、易操作,並且有著豐富的多樣性和生理遺傳資料等特性,是最常使用的癌症動物模式。
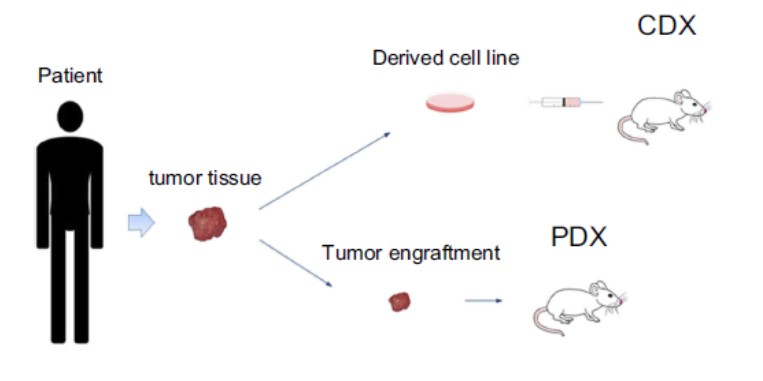
科學家如何將癌細胞「移植」到小鼠身上?
小鼠的癌症動物模式,根據移植方式可分為以下兩類:
(一)同種移植 (Allogeneic Model):將同種小鼠體內所產生的癌細胞,移植到同種小鼠身上。
這種方式的優點是方便、快速、成本低,且能避免小鼠免疫系統對移植的癌細胞產生排斥反應。缺點在於小鼠和人類的癌細胞在生理上並不同,未能反應藥物的真實效果。
(二)異種移植 (Xenograft Model):將非小鼠所產生的癌細胞,移植到小鼠身上。
這種方式的好處在於,將人體產生的癌細胞移植到小鼠身上,可以更好還原人體癌細胞的生理反應,更清楚藥物對癌細胞的作用。但壞處就是正常小鼠的免疫系統會對移植的癌細胞產生排斥反應,因此需要使用免疫功能缺乏的小鼠來進行,成本較高。
而異種移植,依據移植細胞的來源,又可分為兩類模型:
- 細胞株異種移植 (Cell line-derived xenograft, CDX):將已建立的腫瘤細胞株註1移植到小鼠身上。因移植的細胞株已在體外培養多代,所以細胞的來源和特性一致,可快速建立模型,但細胞株在體外培養的過程中,其生理特性會與原始腫瘤組織逐漸不同。
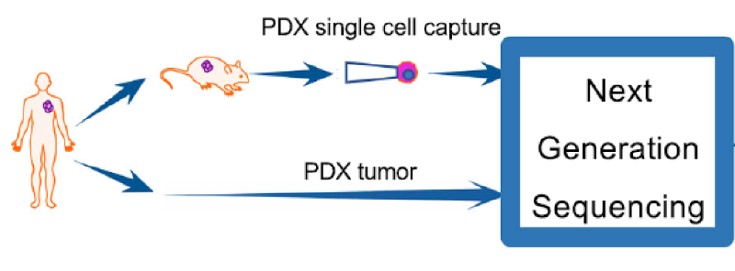
- 人源性腫瘤細胞異種移殖 (Patient-derived xenograft, PDX):將病患身上的腫瘤組織直接移植到小鼠身上。此方法能保存腫瘤組織的原始樣貌(例如腫瘤微環境),更能反應腫瘤的真實生理特性,不過建立此模型的成本較高。
PDX 是直接將病患的腫瘤組織移植到小鼠體內,更好的保留了腫瘤組織的生理特性,因此在藥物測試上比 CDX 更具臨床意義,這讓 PDX 模型成為越來越多抗癌藥物在動物實驗上的首選。
雖然 PDX 能更準確地重現人類腫瘤,但令人不解的是:
為何許多在 PDX 中能有效對抗腫瘤的新藥,在臨床試驗卻常以失敗告終?
近日,美國德克薩斯大學休斯頓健康科學中心和麥戈文醫學院的研究團隊,針對這個問題提出一個可能的解釋:病毒感染。
實驗不準可能是病毒惹的禍?
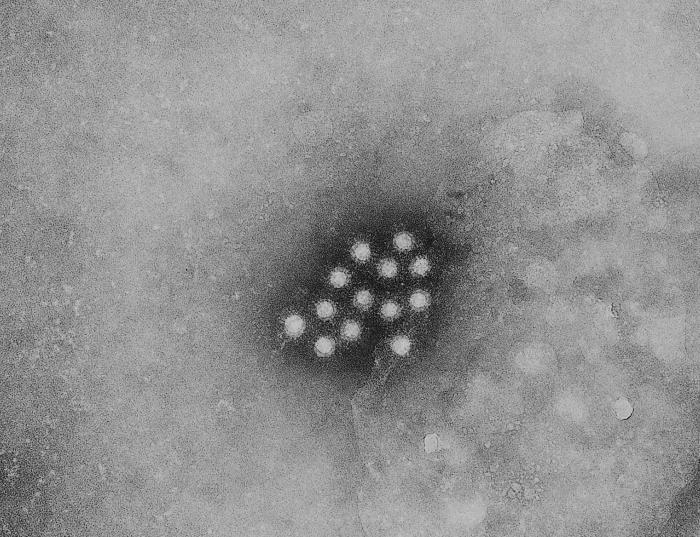
引起他們注意的是 2018 年的一份報告3,該報告指出:
大腸癌 PDX 模型中的大腸癌組織,可偵測到鼠白血病病毒 (Murine leukemia virus, MLV)註2的 DNA,但病患的大腸癌組織並沒有鼠白血病病毒的 DNA。
因此該報告推測,這些小鼠身上的人類腫瘤組織可能被鼠白血病病毒感染了,也就是說鼠白血病病毒極有可能會感染 PDX 中的人類腫瘤組織。
為了驗證這個可能,首先研究團隊分析了 PDX 資料庫中 184 個 PDX 模型的基因數據,結果顯示,腫瘤組織內有鼠白血病病毒DNA 數據的 PDX 模型,多達 170 個。

鼠白血病病毒從哪裡來?
為了排除鼠白血病病毒是來自 PDX 模型內小鼠細胞的可能,他們分離出 PDX 內的單一個腫瘤細胞,並和病患的腫瘤細胞一同進行定序分析。
結果顯示,科學家無法在病患的腫瘤細胞偵測到鼠白血病病毒的 DNA,但卻在 PDX 模型內的腫瘤細胞找到了,這證實了,小鼠體內的鼠白血病病毒會感染人類的腫瘤組織。
你可能會問,鼠白血病病毒感染對腫瘤組織有甚麼影響?影響可大了!
研究團隊發現,被感染的腫瘤組織其基因表現模式和原始腫瘤組織不同。
當腫瘤感染越多的鼠白血病病毒,腫瘤組織內與免疫反應、藥物代謝的相關基因群,其表現模式會顯著改變,這讓 PDX 腫瘤組織對藥物的反應,很可能不同於原始腫瘤組織。
鼠白血病病毒可以活化 T 細胞!
文章中提出一個免疫療法的例子:PD-1 和 PD-L1。
正常 T 細胞會去攻擊腫瘤細胞,但 T 細胞表面上有一個名叫 PD-1 (Programmed cell death protein 1) 的蛋白質,當蛋白質活化時,它會抑制 T 細胞的活性。
而腫瘤細胞為了避免 T 細胞的攻擊,會在細胞表面上產生 PD-L1 (Programmed cell death 1 ligand 1) 這個蛋白質,當 PD-L1 與 T 細胞表面上的 PD-1 蛋白質結合後,就會抑制 T 細胞的活性,讓腫瘤細胞躲避 T 細胞的攻擊。
針對這個機制,目前常用的免疫療法就是阻斷 PD-1 和 PD-L1 的結合(加入 PD-1 或 PD-L1 抑制劑),讓 T 細胞的活性不會被腫瘤細胞抑制。
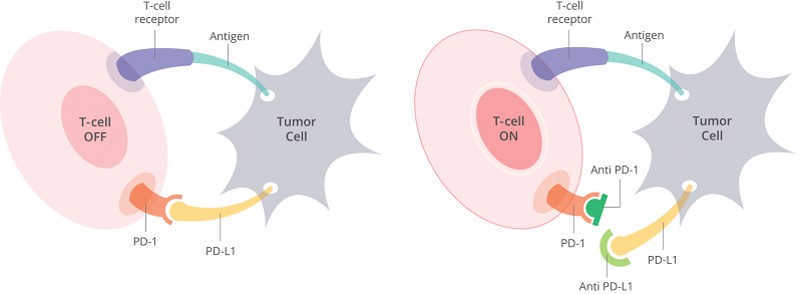
研究團隊發現感染越多鼠白血病病毒的腫瘤組織,PD-L1 的表現會越少,這讓腫瘤細胞抑制 T 細胞的能力降低,此時,若科學家再加入 PD-L1 的抑制劑,就會讓小鼠的 T 細胞大舉活化,讓腫瘤細胞大量死亡。
如此一來,在動物實驗的階段中,科學家可能就會高估了 PD-L1 抑制劑的效果!在 PDX 模型中,雖然 PD-L1 抑制劑看似有效,但進入人體試驗後效果可能會大打折扣。
在人體的臨床試驗中,因為人體腫瘤組織並沒有被鼠白血病病毒感染,PD-L1 的表現量比 PDX 模型更多,抑制 T 細胞的能力更強,如果 PD-L1 抑制劑的效果不夠強或者劑量太少,很難產生效果。
別擔心,PDX 模型並未被全盤否定!
過去科學家們都認為,由於 PDX 模型是直接將未經處理的病患腫瘤組織移植到小鼠體內,在各方面保留大部分腫瘤的生理特點,因此具有較好的臨床療效預測性,但也許事實並非如此。
這篇研究的結果顯示,某些抗癌藥物雖然在 PDX 模型中療效顯著,但由於藥物殺死的是被鼠白血病病毒感染的腫瘤細胞,和原始人類腫瘤的生理特性已不同,因此藥物在人體試驗中可能無效。
當然這個研究並非否定 PDX 模型,而是提出改進方向,PDX 仍是目前最能反應真實人類腫瘤特性的動物模型,只是,未來科學家在使用 PDX 模型時,需定期對實驗動物進行病毒感染測試,從而減少病毒對腫瘤組織的影響。
另外病毒感染也只提供一部份解釋,相信隨著更多研究的投入,能讓我們更了解動物實驗和人體試驗間的鴻溝。進而讓我們設計出更好的動物模型,提升藥物開發的效用與安全性。
註釋
- 細胞株:細胞株是指原始細胞(可能來自組織、器官或細胞)經過篩選後,可重複培養的細胞群。細胞株培養出的每個細胞狀態都極為相似,因此是研究細胞生物學的重要材料。
- 鼠白血病病毒 (Murine leukemia virus):是一種能導致鼠類產生腫瘤的反轉錄病毒,目前發現也會感染其他脊椎動物。
參考資料
- Yuan, Z., Fan, X., Zhu, JJ. et al. Presence of complete murine viral genome sequences in patient-derived xenografts. Nat Commun 12, 2031 (2021).
- 梁善居/國防醫學院動物中心主任:第九章-人類疾病之動物模式(Animal Models for Human Diseases)
- Bock, S., Mullins, C. S., Klar, E., Pérot, P., Maletzki, C., & Linnebacher, M. (2018). Murine Endogenous Retroviruses Are Detectable in Patient-Derived Xenografts but Not in Patient-Individual Cell Lines of Human Colorectal Cancer. Frontiers in microbiology, 9, 789.
- Why some cancer drugs may be ineffective