本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位
CRISPR 的原理與應用
2018 年 11 月,中國基因編輯寶寶引起舉世譁然!這個事件的前因,要追溯到 2012 年橫空出世的基因剪刀 CRISPR,讓人類從此可精準、快速、便宜的編輯 DNA。但這把剪刀目前還有技術瓶頸,只適合治療可拿出體外的免疫細胞。我們邀請中研院生物化學研究所、專研 CRISPR 的凌嘉鴻助研究員,介紹這項正在翻轉世界的基因神器。
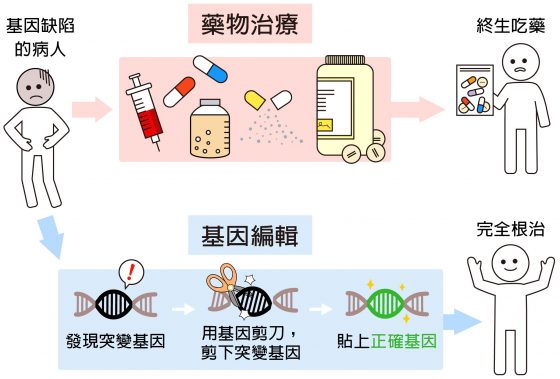
編輯人體基因,就是修改人體 DNA,主要動機是根治基因突變引發的疾病。
「但是瑞凡,我們真的需要基因編輯來治病嗎?」
事情是這樣的:DNA 是生命的藍圖,指揮細胞生產蛋白質,維持人體的生長與運作。當 DNA 的重要位置發生突變,「細胞工廠」運作會失控,就可能造成生理失調,甚至像白血病等重大遺傳疾病。
「生病了,可以吃藥。但基因突變造成的疾病,藥物只能控制病情。」凌嘉鴻繼續解釋:「因為從藍圖就錯了,細胞永遠只能製造錯誤的蛋白質。想要根治,最好直接更正藍圖,修改 DNA。」
基因編輯,可以從源頭下手,找到錯誤的 DNA 片段,用一把分子「剪刀」切開,剔除這個錯誤的基因,或是在缺口處「貼上」正確的 DNA 片段。
圖說設計│黃曉君、林洵安 資料來源│凌嘉鴻
所以首先,必須要有一把精準、能夠剪開 DNA 雙螺旋的好剪刀,CRISPR 就是當前最好用的一把。有趣的是,它來自細菌的免疫系統。
細菌裡的基因剪刀
987 年,日本科學家在大腸桿菌的基因體發現一段古怪的規律序列,某一小段 DNA會一直重複(Repeat),重複片段之間又有一樣長的間隔 (Spacer),用途不明,科學家把這段序列叫做 CRISPR (clustered, regularly interspaced, short palindromic repeats)。後來發現,許多細菌都有 CRISPR,它是細菌免疫系統的一種機制,可以記憶曾經來犯的病毒。
想不到,這個看似不起眼的 DNA 片段,將會引爆基因編輯的大狂潮!
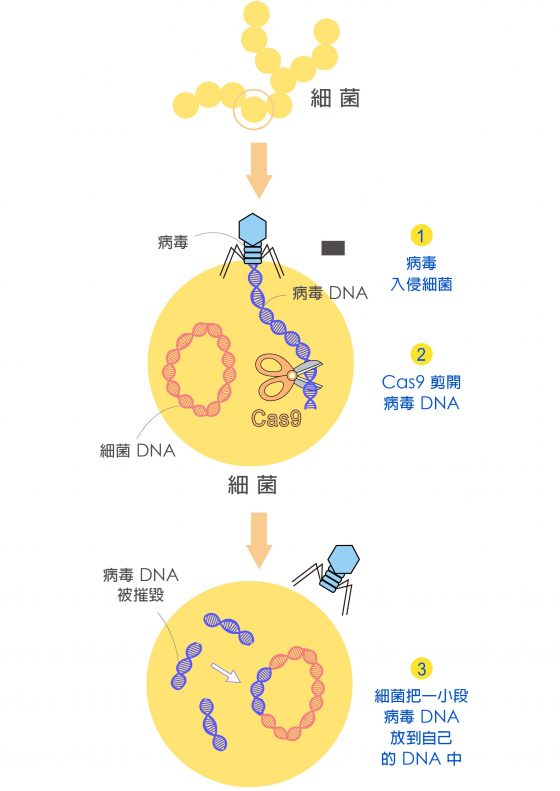
故事是這麼開始的:當病毒入侵細菌,會把自己的 DNA 注入到細菌中,企圖霸佔細菌工廠的資源,複製新病毒。但細菌也不會乖乖挨打,它們的免疫系統可以辨識、摧毀病毒的 DNA。這是一場微觀世界的閃電戰,細菌的反擊必須夠快、夠準,才有機會存活!
有些細菌僥倖存活後,會挑選一段病毒的 DNA 碎片,插入自己的 CRISPR 序列 (增加一段 Spacer),就像為病毒建立「罪犯資料庫」。當病毒第二次入侵,細菌就能依靠 CRISPR 序列快速認出這種病毒,第一時間反殺,提高存活率。
圖說設計│黃曉君、林洵安 資料來源│凌嘉鴻
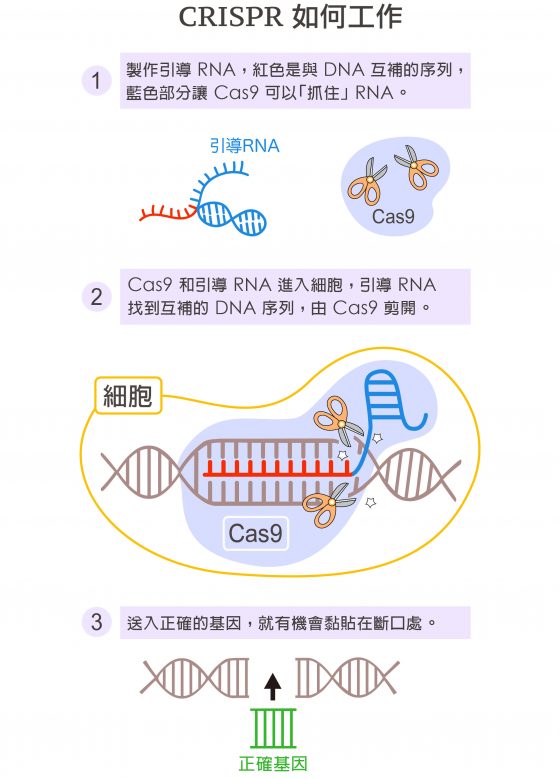
細菌是如何認出病毒的呢?首先,細菌會用舊病毒的 DNA 片段 (Spacer) 當模板,打造一條互補的引導 RNA,例如病毒 DNA 的鹼基是 T、RNA 是 A,DNA 是 G、RNA 是 C,或是互相顛倒。引導 RNA 再利用這種互補關係,比對新病毒 DNA 片段,如果可以互補,表示新舊病毒相同。
然後,一種可以切割 DNA 的酵素 Cas9 (武裝警察),會抓著這段引導 RNA (嫌犯資料),前去「盤查」新病毒的 DNA,看看有沒有跟引導 RNA 互補的段落。這一次反過來,RNA 是 A,DNA 是 T;RNA 是 C,DNA 是 G,或是互相顛倒。
一旦找到了,Cas9 立刻剪開「被認出」的 DNA 片段。DNA 被剪斷摧毀,病毒就沒戲唱了。這種細菌的免疫機制,稱為 CRISPR-Cas9。
基因神剪 CRISPR
這麼基礎的細菌免疫學,跟基因編輯有什麼關係呢?想想,基因編輯的關鍵是:找到一把可以切開 DNA,又不會隨便亂剪的分子級剪刀。細菌的 Cas9 酵素,憑著一段引導 RNA,就能精準「喀擦」鎖定的 DNA 片段。好剪刀,不用嗎?
實務上的操作方法很簡單:先將 Cas9 做好、放入冰箱,想要剪某段 DNA,就訂做一條互補的引導 RNA。然後將 Cas9 解凍、與引導 RNA 結合,再用電擊的方式進入細胞,讓它去剪下錯誤的基因。
壞基因剪下來了,怎麼貼上好的基因?因為細胞天生會自動修補受損的 DNA,只要把正確的基因送進細胞核,就有機會被細胞拿來修補 Cas9 剪下的斷口,完成基因編輯!
基因編輯技術大躍進
CRISPR 不是第一把基因剪刀。早在 1990 年代,科學家就開發了許多種能「剪開」DNA 的酵素。每種酵素有自己的特殊結構,只能跟特定的 DNA 片段結合,藉此精準切割目標基因。只不過,如果研究者想剪開另一段 DNA,即使序列只有一點點差異,也要花費兩三個月重新設計、組裝全新的酵素,技術複雜、耗時又花錢。
直到 2012 年,科學家找到 CRISPR 這把神剪!它不像過去的酵素剪刀:剪一種基因,設計組裝一把酵素剪刀。CRISPR 從頭到尾只用一把萬能酵素剪刀 Cas9,加上一條引導 RNA,就能切割所有的 DNA。目標基因換了,訂購一條 RNA 就好,不需要重新設計複雜的酵素,技術和價格門檻都非常低。
所以 CRISPR 一問世,立刻鋪天蓋地應用在細菌、真菌、動物、植物、人類醫學。2010 年 有關 CRISPR 的論文不到 50 篇,到了 2015 年,已暴增到 1100 篇。
基因編輯治療免疫疾病
「既然 CRISPR 這麼好用,是不是可以終結所有的遺傳疾病了?」可惜的是,這把剪刀還有很多技術上的瓶頸, 還不適合直接治療人體細胞。
「最重要的瓶頸之一:這把細菌的基因剪刀用在人體的 DNA,不是百分百準確。」凌嘉鴻慎重提醒。
Cas9 能辨認的序列是 23 個鹼基,但人體 DNA 鹼基序列有 65 億個,Cas9 想要找到正確的序列,宛如大海撈針!
以統計學方法來算,要從 65 億個鹼基序列裡找到一條獨一無二的序列,長度至少要 28 個,低於這個數字,找到的可能只是相似的序列,因此 Cas9 無法保證統統剪對位置。當 Cas9 切錯位置,可能造成難以想像的副作用。
「目前比較安全的作法,是先從病人體內取出細胞修改,確定沒問題再放回體內。」凌嘉鴻說。不過,大部分細胞、組織都不可能任意取出,只有隨時懸浮在血液中的免疫細胞,抽血就能取得。 如果有人免疫細胞先天不足,可以先把它們取出體外,修改基因,例如把 T 細胞取出來,「教會」它們癌細胞長什麼樣子,再把「變聰明」的 T 細胞放回體內,找出癌細胞進行摧毀。
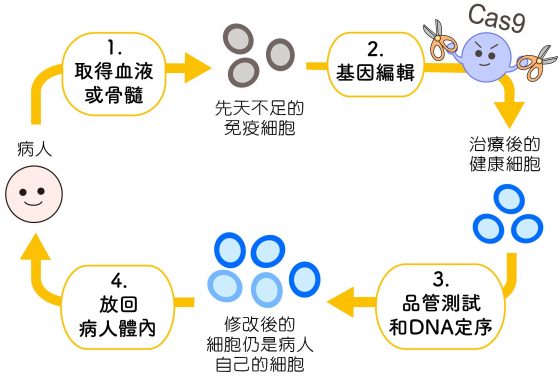
圖說設計│黃曉君、林洵安 圖片來源│凌嘉鴻
最近幾年,很多醫藥或癌症研究都轉向 CRISPR,像中國很早就開始將 CRISPR 搭配免疫療法,美國、歐洲也漸漸跟上。 CRISPR 還可用在幹細胞,先從病人身體取出幹細胞,先在體外進行基因編輯,再放回體內分化成各種健康細胞,更是潛力無窮!
想知道基因編輯寶寶現階段為什麼母湯?CRISPR 還要克服哪些技術難題,才能安全的編輯人體基因?到了那一天,人體基因編輯的界線又該劃在哪裡?請看下一篇專訪。
延伸閱讀
- 凌嘉鴻個人網頁
- 知識大講堂《Your Genome Your way 》
- Generation of knock-in primary human T cells using Cas9 ribonucleoproteins.
本文轉載自中央研究院研之有物,原文為人體基因編輯是在編什麼?五分鐘搞懂基因神剪 CRISPR,泛科學為宣傳推廣執行單位