本文由《唐獎教育基金會》委託,泛科學企劃執行
- 作者/李紀潔、羅鴻、泛科學編輯部
從古埃及的紙莎草文獻到祕魯印加帝國的古木乃伊體內,都可見到人類飽受癌症侵擾的證據。而在醫療昌明的現代,癌症仍然高居國人十大死因的首位。人類與癌症纏鬥了數千年,難道沒有有效的治療方式,終結這長年來的惡夢嗎?
在明星標靶藥物伊馬替尼(imatinib)於 2001 年出現之前,常見的癌症治療方法包含了手術、放射線治療和化學治療。但這些療法皆無法針對癌細胞進行治療,也都有相對嚴重的副作用。今年(2018)的唐獎生技醫藥獎頒給三位美國知名的科學家:東尼 ‧ 杭特(Tony Hunter)、布萊恩‧德魯克爾(Brian J. Druker)、約翰 ‧ 曼德森(John Mendelsohn),他們的研究開啟了針對癌細胞進行癌症「標靶治療」的新紀元。
宛如對癌症專用神奇子彈的標靶藥物到底機制是什麼?它又是如何誕生的呢?
開啟標靶藥物研發濫觴的「酪胺酸磷酸化機制」
能成為第一個知道(科學新發現)的人,真的是非常好的感受。──東尼 ‧ 杭特博士,2017 訪談
故事從頭說起,在 1980 年代東尼 ‧ 杭特博士進行生化研究時,科學界僅知兩種胺基酸:蘇胺酸(Threonine)與絲胺酸 (Serine)有磷酸化(Phosphorylation)的現象。磷酸化意指「在分子上加上磷酸根(PO32-)」,這個作用在生物化學中有很重大的效用,可能會造成截然不同的訊息傳遞(signaling),甚或大幅影響原有蛋白質的功能。而杭特博士在科學上的主要貢獻,在於他研究會引發癌症的多瘤性病毒(polymavirus)的蛋白激酶(protein kinase)時,誤打誤撞發現其作用是磷酸化第三種胺基酸酪胺酸(tyrosine);在後續的實驗中,更進一步證實了多瘤性病毒與勞斯肉瘤病毒(Rous sarcoma virus)致癌的轉化蛋白都是酪胺酸激酶(tyrosine kinase, TK),這個發現暗示了失控的酪胺酸磷酸化機制是癌症起源的關鍵,更進一步成為現今標靶藥物研發的濫觴。

為什麼這樣一個蛋白質的化學變化會有如此劇烈的影響?我們要回過頭來從細胞內的溝通談起,當細胞接收到外來生長訊號,此訊號會一個蛋白質傳一個蛋白質地將訊號送到細胞核中,對 DNA 進行調控,影響生長、分化、代謝等重要的生理行為,這樣的溝通即是細胞內的「訊息傳遞」機制。把訊息傳遞想像成一場接力賽,在這場接力賽中,每位跑者都是不同的化學物質,這些化學物質接力傳訊的結果,最終會引發細胞重要的各種生理行為。
生物體中有非常多種酪胺酸激酶,它們在訊息傳遞的接力賽中主要扮演最前頭的跑者,會改變下游蛋白質的結構(替蛋白質中的酪胺酸加上磷酸根),從而影響細胞的生長、分化、遷移、代謝、細胞凋亡等等重要的生理行為。依照作用的位置,酪胺酸激酶可分成兩類:在細胞膜上的受體酪胺酸激酶(receptor TK)及細胞質內的酪胺酸激酶。而若是細胞不正常大量表現酪胺酸激酶或蛋白磷酸酶(tyrosine phosphatase,功能跟激酶相反)失去功能時,便可能導致細胞的不正常增生,甚至產生腫瘤。
知道了發病機制,只要找到方法抑制發生異常的酪胺酸激酶,或許就得以控制癌症──這就是 TK 標靶藥物研發的核心概念。
明星標靶藥物的誕生:伊馬替尼
德魯克爾博士的貢獻,則在於承襲前述基礎研究的成果,研發出治療慢性骨髓性白血病(Chronic myelogenous leukemia, CML),也是世界上第一款酪胺酸激脢抑制劑(TKI)標靶藥物「伊馬替尼」(imatinib)。

1845 年 已經有紀錄描述這種疾病,但直到 1985 年才有研究指出,致病的主要成因為患者的骨髓造血細胞中出現染色體易位(chromosome translocation),後續的研究發現患者因此會製造 ABL/BCR 基因嵌合蛋白。未發生易位前的 ABL 蛋白就是一種酪胺酸激酶,在白血球產生的機制中就像個開關,會視需求打開或關起──而當這個開關卡住無法關閉,就會導致白血球無限制的增生──也就是白血病。
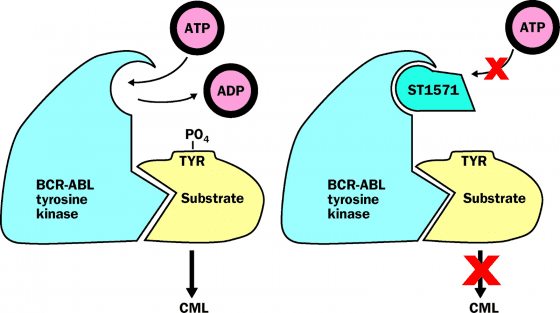
因此,理論上如果用小零件卡住這個開關,就可以阻止白血球異常增生──也就是針對此酪胺酸激酶接合 ATP 的位置,設計出小分子佔領其位置讓它無法工作(無誤),從而抑制白血球過度產生的訊息傳遞鏈,就可以控制白血病啦!但是,事情當然沒有想像的這麼簡單,這個分子必須要能夠通過臨床測試,不會在殺死癌細胞的同時引發太多副作用才行。
在德魯克爾博士開始實驗的那幾年,慢性骨髓性白血病病患預後的情況一般而言相當糟糕:約有 25-50% 確診的患者會在一年內死亡,臨床現場的經驗促發他不畏重重關卡,決心找到真正有效的治療方法。這個歷經重重測試、與兩個製藥公司的臨床試驗才得以誕生的藥品,就是第一代標靶藥物伊馬替尼(imatinib),商品名「基利克®」(Gleevec®)。這個藥物的誕生,使今日慢性骨髓性白血病患者生存率,與常人並無太大的差異。
將抗體應用於治療癌症:西妥昔單抗
前面有提及,酪胺酸激酶主要可分成兩種,在細胞膜上的受體及細胞質內運作的酵素。伊馬替尼就是用以阻斷細胞質內酪胺酸激酶運作的小分子;而接下來的故事,則是使用抗體(antibody)來阻斷細胞膜上的受體酪胺酸激酶的作用,也就是另一位唐獎得獎人約翰 ‧ 曼德森的貢獻。

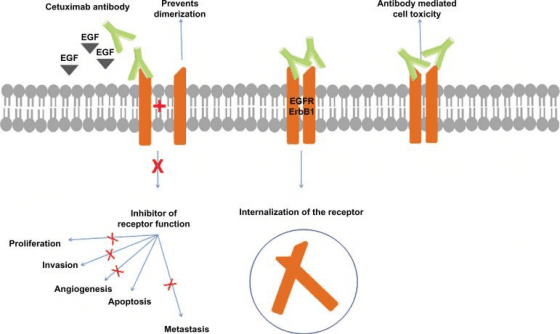
1950 年代,科學家就發現了表皮生長因子(epithelial growth factor, EGF)能夠促進細胞的生長及發育。表皮生長因子事實上不會進入細胞內,會經由細胞膜上的受體(EGF Receptor, EGFR)來產生作用,EGFR 也是種酪胺酸激酶,藉由磷酸化下游分子傳遞訊息。就如前面的故事,當酪胺酸激酶出了錯──在這個例子中,當細胞表面有了太多的 EGFR 或其發生突變──便可能引發細胞的大量增生而形成癌症。
細胞表面的受體(Receptor),有點像細胞膜上專門接收特定分子訊息的小信箱,在 EGFR 的例子中,當它收到了表皮生長因子的資訊,就會進行磷酸化啟動細胞生長發育的訊息傳遞;但當細胞表面的小信箱多得不正常,細胞也會不正常成長──也就是癌細胞的起源。如果想阻止癌症,該如何處理這麼多 EGFR 小信箱?一個讓信箱失效的好辦法:拿長得很像的垃圾信件塞爆它。
這時正是免疫科學中,能夠辨識細胞表面特殊分子的抗體出場的時機了,在 1980 年代初期,免疫科學並不曾被視為癌症的潛在療法。約翰‧曼德森博士與同事成功找出能夠與變異的 EGFR 結合並且抑制其功能的抗體:西妥昔單抗 (cetuximab),商品名「爾必得舒®」 (Erbitux®)。同樣歷經層層測試的西妥昔單抗最終在 2004 年上市,而後成為大腸癌、頭頸癌(範圍涵蓋顏面、鼻咽腔、口腔、咽喉、頸部)等癌症的重要標靶藥物;後續有更多研發跟進使用抗體作為標靶藥物,來抑制受體酪胺酸激酶的活性。
破解複雜生命謎團的漫長接力賽還未結束
正如細胞中的訊息傳遞,是經歷多種化學物質環環相連的複雜接力賽;人類要治療並解密癌症的致病機轉更是一場漫長的接力賽,是眾多的科學家投入了他們的光陰歲月,才得以逐漸撥雲見日、去破解複雜生命故事中的每個環節。1980 年代杭特博士發現酪胺酸磷酸化機制、辨識致癌基因的基礎研究是標靶治療得以蓬勃發展的基石;而接著 2001 年德魯克爾博士推動的第一支 TKI 標靶藥物伊馬替尼上市,和 2004 年曼德森博士研發的第一個 EGFR 抗體標靶藥物西妥昔單抗上市,也才讓癌症治療的曙光漸漸乍現。直至今日,仍有許多人投入標靶藥物的研發,不論是藥物或是治療癌症的種類都在逐步增加中。
人類與癌症千年的抗爭還未結束,但眼前不再只有一片漆黑;只要我們懷著像是這三位唐獎生醫獎得主;以及眾多科學家們在面對問題時的科學精神:在謎團與困境中不屈不撓,面臨失敗時永不放棄,並總是以最大的努力去找尋重要問題的答案。終有一天,我們能擊敗這個困擾已久的惡夢。
參考資料:
- O’Dwyer, M. E., & Druker, B. J. (2000). STI571: an inhibitor of the BCR-ABL tyrosine kinase for the treatment of chronic myelogenous leukaemia. The lancet oncology, 1(4), 207-211.
- Patil, N., Abba, M., & Allgayer, H. (2012). Cetuximab and biomarkers in non-small-cell lung carcinoma. Biologics: targets & therapy, 6, 221.
- Druker, B. J. (2009). Perspectives on the development of imatinib and the future of cancer research. Nature medicine, 15(10), 1149.
本文由《唐獎教育基金會》委託,泛科學企劃執行