- 作者/ 陳淵銓 、 李慧芳
細胞治療係取自人類自體﹙autologous﹚細胞或同種異體﹙allogeneic﹚細胞,經加工或體外培養程序,再將整個細胞引進病人體內使用,以診斷、治療或預防人類之疾病;基因治療則利用分子生物學的技術將特定基因導入患者體內,以檢測標的基因組或造成標的基因組重組,從而診斷、治療或預防人類之疾病。
細胞治療起初主要用於抑制器官或骨髓移植時引起的排斥(rejection)反應。基因治療產品起初主要用於治療罕見疾病或遺傳性疾病,但近來二者已往適用於治療心血管疾病、神經退化性疾病、代謝性疾病及癌症等發展,並獲相當成果。實際臨床應用於病人,在國外被列為所謂先進醫療產品(advanced therapy medicinal product, ATMP)。
國外自 1997 年起始上市的細胞及基因治療產品
細胞治療產品自 1997 年 Carticel 首先獲得美國食品藥物管理局(US FDA)核准,迄今已有許多品項在國際上核准上市(表1),並於病人身上臨床應用,有些產品仍在研發或臨床試驗中,預期會有更多產品陸續核准上市。
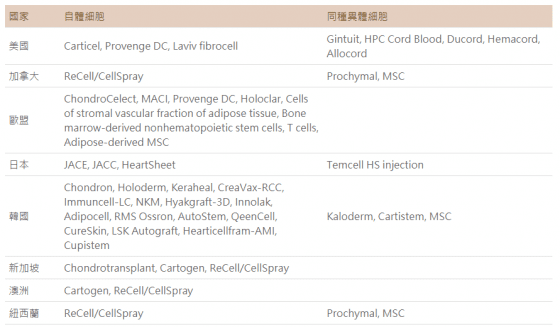
- 縮寫:Hemacord (HPC, Cord Blood); Mesenchymal stem cell (MSC); Matrix applied characterized autologous cultured chondrocytes (MACI)
基因治療產品則主要仍在研發或臨床試驗階段,臨床試驗大多在美國、歐洲及澳洲進行(Goncalves 2017),但也有已核准上市者,如用於治療家族性脂蛋白脂質分解酶缺乏症(familial lipoprotein lipase deficiency, LPLD)的 Glybera (alipogene tiparvovec)是歐洲藥物管理局(European Medicine Agency, EMA)核准的第一個基因治療產品(2012 年 7 月)。
美國食品藥物管理局則分別已核准 2 種使用嵌合抗原接受體 T 細胞 (chimeric antigen receptor T cells, CART) 療法的基因治療產品,包括用於治療 25 歲以下的復發性和難治性 B 細胞急性淋巴性白血病 (acute lymphoblastic leukemia) 患者的 Kymriah(tisagenlecleucel)(2017年8月)和特定型大B細胞淋巴瘤(large B-Cell lymphoma)成人患者的 Yescarta (axicabtagene ciloleucel) (2017年10月)。
細胞及基因治療在國外發展相當迅速,先進國家對這種產品的相關法規通常有暫時性或條件性的規定,審查機制則較具彈性(flexibility)或有快審制度(fast track)。儘管細胞及基因治療產品在國外已蓬勃發展,但綜觀先進國家發展的經驗,仍可發現它們曾遭遇或正在面臨一些挑戰(Goncalves 2017, Sipp 2017, Chen 2017, Kimmelman 2016, ISSCR 2016, Almasbak 2016, Das 2015)(表2)。

細胞及基因治療產品在國內的現況
我國雖尚未核准任何細胞或基因治療產品上市,但已制定「人類細胞治療產品臨床試驗申請作業及審查基準」、「人類細胞治療產品查驗登記審查基準」及「人體試驗管理辦法」等相關法規,分別規範細胞治療產品的臨床試驗申請程序、查驗登記審查基準及相關人體試驗研究的管理。
「細胞及基因治療產品管理法草案」則已於 2017 年 7 月 25 日公告讓社會大眾提供意見,草案內容參考美國、歐盟及日本等國內外相關立法例而擬具,考量細胞及基因治療產品之特性及實際醫療使用情形,規範經人類細胞加工之細胞及基因治療產品應符合本法之規定,並就相關產品之上市販賣審查,制定所謂「附條件期限之承認制度」。
根據「人體試驗管理辦法」的規定:
醫療機構為治療危及生命或嚴重失能之病人,在國內尚無有效之藥品、醫療器材或技術可資適用時,得就經中央主管機關核准,且累積相當安全數據之人類細胞治療人體試驗,擬訂附屬計畫,連同已核准之原人體試驗計畫影本,依規定審查通過後,向中央主管機關申請核准使用於符合相當適應症而未能符合原人體試驗受試者資格者。
因此,有關細胞治療產品的使用,國內醫療機構已可依現行法規擬訂治療計畫(treatment protocol),向衛生福利部申請核准於人體臨床應用,申請的流程和架構亦已建立(圖1)。
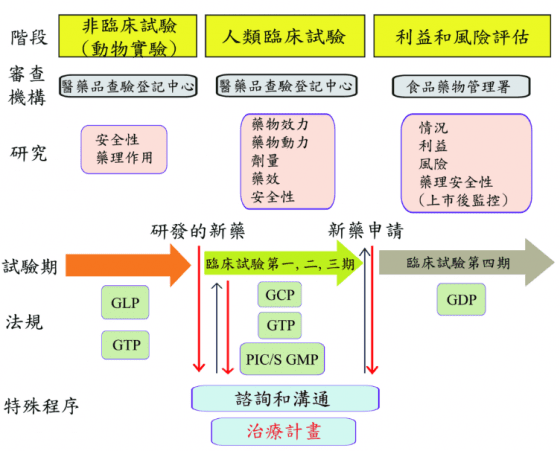
- 縮寫:Good Clinical Practice (GCP); Good Distribution Practice(GDP); Good Laboratory Practice(GLP); Good Tissue Practice(GTP); Pharmaceutical Inspection Convention and Pharmaceutical Inspection Co-operation Scheme/Good Manufacturing Practice (PIC/S GMP)。
有關細胞治療產品許可證的核發,參考日本醫藥品醫療機器總和機構(Pharmaceuticals and Medical Devices Agency, PMDA)的作法,設計一種暫時性許可證制度供醫療機構申請,從2016年開始,國內醫療機構在完成臨床試驗第一期後,得先核發適應性許可證(adaptive licensing),細胞治療產品即可提供病患使用,此作法在臨床試驗第二、三期使用過的病患數預計會比經正常程序核發許可證者為多(圖2)。
這種彈性的作法已於 2017 年 7 月 25 日公告之「細胞及基因治療產品管理法草案」第六條(附條件及期限之暫時性許可)中正式規定︰
細胞及基因治療產品推定具備有關申請之療效性,與確認安全性者,經中央衛生主管機關審查後,得核發附條件及給予不超過五年效期之暫時性許可證。
部分細胞及基因治療產品尚未進行療效驗證,但有足夠數據可推定其療效,為顧及國民得儘速使用細胞及基因治療產品之權利,在確保安全性之前提下,爰參照日本藥機法二十三條之二十六規定,給予附條件、期限之暫時性許可證,與第六條之許可證區隔。
依本條取得暫時性許可證之細胞及基因治療產品,應持續進行細胞及基因治療產品之使用成效試驗,並於效期內重新申請查驗登記,如符合第六條規定者,改發給產品許可證。
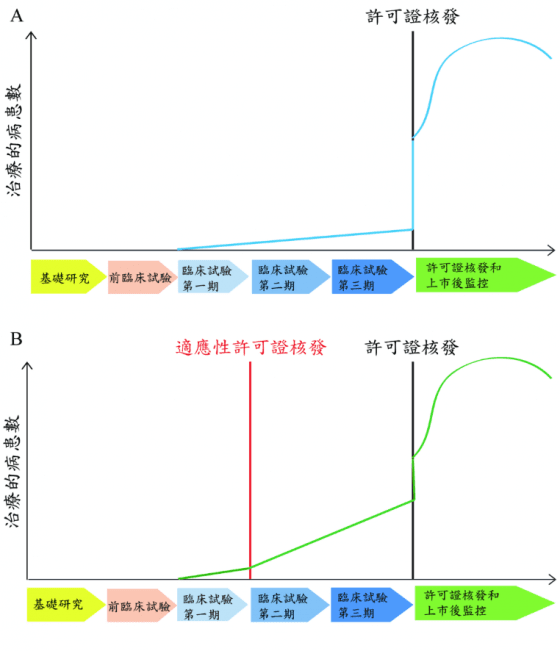
資料來源:引用Cell therapy regulation in Taiwan. Cell Transplantation. 13 March 2017; 26(3):483-492; 本研究整理
在國內相關政策、制度及法規逐漸建立的情況下,我們預期在不久的將來,應會有細胞或基因治療產品在台灣正式核准上市,展望未來,政府須有相關政策促進其發展。
- 研發創新:目前新產品開發進展快速,技術逐漸成熟,臨床應用範圍日益廣泛,為促進醫藥科技的創新,與先進國家並駕齊驅,應鼓勵相關產品的研發及生產,並培養研究、經營及管理的人才,促成製藥產業的升級與進步。
- 產學合作:應建立產官學界合作的管道和交流的平台,促成國際合作及經驗交流,鼓勵轉譯醫學(translational medicine)的發展,使得基礎研究能與臨床應用結合。
- 醫療精進:因產品具有高度科學性、專一性及客製化的特徵,為符合病患個體的精準醫療(precision medicine)的需求,應創造一個生物經濟(bioeconomics)體系和建立因應個體差異的人體生物資料庫(biobank)。
目前國內研究及醫療機構正在合作建置台灣人體生物資料庫(Taiwan biobank),主要是結合基因與其他醫學資訊,針對本土常見疾病進行大規模的世代研究與病例對照研究,藉此瞭解國人常見疾病之致病因子與機轉,有助於改善疾病治療方針、預防策略及降低醫療成本(台灣人體資料庫網站)。

參酌先進國家發展的經驗及前例,面對細胞及基因治療產品可能在台灣帶來的衝擊或挑戰,應有以下因應的政策規劃:
- 法規的制定和修訂:相關法規的制定與修訂應及時並有彈性,並建立條件式許可(conditional approval)制度,審查程序須有快審制度及溝通機制,讓有些尚未進行療效驗證,但有足夠數據可推定其療效之細胞及基因治療產品,在確保安全無虞的條件下,在民眾面臨嚴重情況(serious condition)或未被滿足的迫切醫療需求(unmet medical need)時得儘速使用之。
- 利益和風險的評估:細胞及基因治療產品雖能治癒病痛,帶給病患恢復健康的曙光,但異體外來基因或重組基因在人體內有引發不良反應甚至致病(癌)的風險,須建立一套科學性的風險評估機制,確保利益高於風險。
- 利益相關者的擴大參與:增加利益關係人(如醫師、病人、專利持有者及產品生產者等)對產品風險評估的參與,可能會增加可接受利益/風險閥值(threshold for benefit-risk ratio)制定的複雜性,須確保資訊的公開透明和建立包括所有利益相關者的溝通機制。
- 個人利益和公共利益的平衡:細胞及基因治療產品須長期使用,具潛在高利潤性,為避免專利的爭奪及臨床應用的商業化,應擬定相關政策制定完善的專利申請及醫療付費、保險制度。
- 經費及負擔的考量:細胞和基因治療產品研發經費及人力通常耗費龐大,但獲利很難預估,例如Glybera獲得核准進入歐洲市場後,目前製造廠已經因為成本回收不如預期而暫停生產了(Nicol 2017)。因此,收入及利益須高於耗費,為確保收支至少保持平衡,產業投入生產前應有先期財務評估計畫。
新興的醫療方法,將在台灣如何發展?

細胞及基因治療是新興的醫療方法,為人類醫療開創了新的領域,在國外有不少生技公司和藥廠研發和生產相關產品,並已獲核准供病人使用。近來,由於生物技術之快速發展,細胞培養、加工及保存等技術逐漸成熟,國內研究人員亦積極投入各種細胞及基因治療產品的開發,並計畫將相關產品實際於臨床應用,以尋求疾病治療之突破,改善病人的生活品質。
衛生福利部、科技部再生醫學科技發展計畫辦公室、生技新藥發展協會及相關醫學會、研究機構曾於 2017 年 9 月 16 日召開再生醫學與細胞治療倫理法規論壇,討論「細胞及基因治療產品管理法草案」的內容及可能面對的困難或挑戰,先期了解和溝通各界的意見,以確保病患權益,並對可能衍生的倫理問題提供解決之道,使得未來可能核准上市的細胞及基因治療產品能在國內長期良性發展。
我國雖然尚未核准任何細胞及基因治療產品在台灣上市,但相關法規已制定或正在研擬中,準備因應相關產品於臨床應用上的需求,但考量細胞及基因治療產品之新穎性、特異性及複雜性,其管理方式應與其他藥物不同,進而促進產業發展,並保障病人權利。綜觀國際潮流趨勢及國內發展現況,政府應有前瞻性的政策規劃,在兼顧醫療之品質、安全、有效及倫理的條件下,開創美好的前景並避免負面的效應。
參考文獻
- 人類細胞治療產品臨床試驗申請作業及審查基準(2014年9月17日公告)。
- 人類細胞治療產品查驗登記審查基準(2015年7月公告)。
- 人體試驗管理辦法(2016年4月17日修正公告)。
- 台灣人體資料庫網站(資料取自:https://www.twbiobank.org.tw/new_web/ )。
- 再生醫學與細胞治療倫理法規論壇(2017年9月16日於中央研究院人文館國際會議廳舉行)。
- 細胞及基因治療產品管理法草案(2017年7月25日公告於衛生福利部食品藥物管理署網站)。
- Almasbak H, Aarvak T, Vemuri MC. (2016). CART cell therapy: a game changer in cancer treatment. Journal of Immunology Research. 2016; 2016:5474602.
- Chen YC, Cheng HF, and Yeh MK (2017). Cell therapy regulation in Taiwan. Cell Transplantation. 13 Mar. 2017; 26(3):483-492.
- Das SK, Menezes ME, Bhatia S, Wang XY, Emdad L, Sarkar D, Fisher PB. (2015). Gene therapies for cancer: strategies, challenges and successes. Journal of Cell Physiology. Feb. 2015; 230(2):259-71.
- Goncalves GAR, Paiva RMA. (2017). Gene therapy: advances, challenges and perspectives. Einstein (Sao Paulo). 15 Jul-Sep 2017; 15(3):369-375.
- ISSCR(International Society for Stem Cell Research)2016 guidelines for stem cell research and clinical translation (12 May, 2016).
- Kimmelman J, Hyun I, Benvenisty N, Caulfield T, Heslop HE, Murry CE, Sipp D, Studer L, Sugarman J, Daley GQ. (2016). Policy: global standards for stem-cell research. Nature. 19 May 2016; 533(7603):311-313.
- Nicol D, Eckstein L, Morrison M, Sherkow JS, Otlowski M, Whitton T, Bubela T, Burdon KP, Chalmers D, Chan S, Charlesworth J, Critchley C, Crossley M, de Lacey S, Dickinson JL, Hewitt AW, Kamens J, Kato K, Kleiderman E, Kodama S, Liddicoat J, Mackey DA, Newson AJ, Nielsen J, Wagner JK, McWhirter RE. (2017). Key challenges in bringing CRISPR-mediated somatic cell therapy into the clinic. Genome Medicine. 2017; 9:85.
- Sipp D, Caulfield T, Kaye J, Barfoot J, Blackburn C, Chan S, De Luca M, Kent A, McCabe C, Munsie M, Sleeboom-Faulkner M, Sugarman J, van Zimmeren E, Zarzeczny A, Rasko JEJ. (2017). Marketing of unproven stem cell-based interventions: A call to action. Science Translational Medicine. 5 Jul. 2017; 9(397).











-200x200.jpg)