從基礎研究,了解神經退化原因
失智症是個難解的神經退化疾病,國內外科學家皆投入大量研究,希望找出病理機制以研發新藥。但人腦的神經網絡複雜程度,遠超出目前理解範圍,在用藥之前,無論是科學家或是我們自己,都需要對神經網絡有更清楚的認識。
中央研究院生物醫學科學研究所的陳儀莊特聘研究員,帶領團隊與跨領域專家合作,除了研究神經細胞與神經膠細胞之間的影響,亦盼能以亨丁頓舞蹈症為模型,發展可沿用於治療其他神經退化疾病的藥物。
神經退化疾病,至今仍無藥可醫
2016 年年底,美國一個著名的大藥廠宣佈了其研發 27 年的失智症藥物,在臨床研究上效果不佳。消息一出,無論是科學家、病人或投資者都很沮喪,全美生技股市甚至降了 8-10 %。在這個低迷的氣氛中,曾得過諾貝爾生理學暨醫學獎的生物學家 David Baltimore 站出來鼓勵大家:
其實我們對神經細胞還不夠了解,如果夠了解,很多問題我們會事先想到。我們應該更努力發展新的科技,並加強分享資訊和數據,才能成功。
在台灣,距今十幾年前政府就開始推動藥物發展,例如 NRPB 生技醫藥國家型科技計畫。而在 2012 年立法院的臨時議案中,數十位立法委員聯合簽名,要求政府會同中研院研發改善失智的抗體與藥物。這幾年來,我們社會老年化的狀況更為嚴重,報紙上社會版面常出現因家人無力長期照顧失智長輩而發生的悲傷故事。
但羅馬不是一天蓋成,若只急著研究藥物的藥效,而忽略全面的了解,就很容易出差錯。例如當科學家發現一個新藥物可以修復退化神經細胞的功能時,若在尚未了解此藥物是否造成身體其他組織的副作用時, 就立刻進行開發,此藥物在臨床實驗失敗的機率就很高,因此藥物研發應更深入。
人腦的神經網絡複雜程度遠遠超出目前的理解範圍,這也是為什麼至今仍無藥物可快速根治神經退化疾病的原因。國內外科學家尚在努力地從基礎研究了解人腦的神經網絡,中央研究院也投入大量心力在此領域中,其中一個研究方向是以研究神經細胞為主體,探討神經細胞和其他腦細胞(包括神經膠細胞)之間的影響。
本文透過陳儀莊特聘研究員的解說,一同從基礎出發,先了解自己的神經網絡,並探討如何發展神經退化疾病模型,進而開發藥物的可能性。
在吃藥前,先認識自己的神經網絡
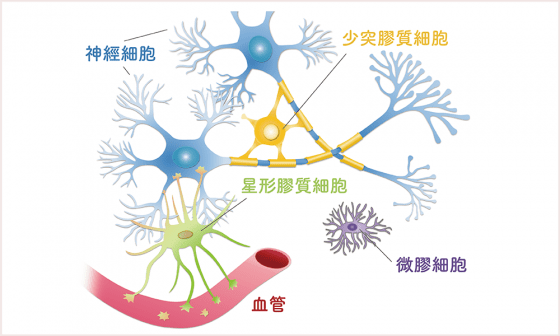
人腦的神經網絡中,負責連結神經網絡的「神經細胞」最為重要,神經細胞活動時會有很多電位經過,電位傳導地越快,神經網絡傳遞功能效果越好。但在傳導電位的過程中,如何避免「短路」?就靠「少突膠質細胞」將神經細胞包起來保護。而在腦中佔了 85% 的「星形膠質細胞」,就像支持整個國家發展的基礎工作人員,非常重要。
「星形膠質細胞」一腳連接神經細胞、一腳連接血管,幫助神經細胞接收養分、並協助清理代謝廢物。
個子很小的「微膠細胞」數量很少,僅佔全部腦細胞的百分之五,他們彷彿人腦中的警察,看到壞東西會將之吞噬。當看到發炎狀況時,會釋放出細胞激素 ( cytokine ) 殺死入侵的細菌或抗發炎。幾乎所有的神經退化疾症都和微膠細胞的失能有關。但微膠細胞是個雙面刃,如果它分泌太多細胞激素也會傷害神經細胞,這種情況在人腦老化時很容易發生。
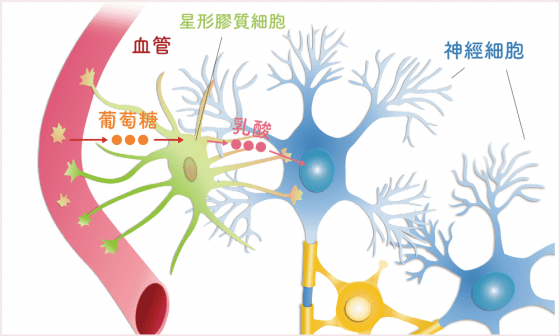
能吃就是福,對於神經細胞而言,順利獲取能量是一件很重要的事。血液中的葡萄糖,會先經過星形膠質細胞變成乳酸,乳酸再進入神經細胞轉成能量。這個乳酸釋放、吸收與轉換能量的過程,有時候效果會變差,對長期記憶的形成及維繫造成不利影響。
Cristina M. Alberini 博士的研究室曾以實驗證實(註一),在老鼠負責記憶的海馬迴組織中打入大量乳酸,發現老鼠的記憶變好了,因為神經細胞獲得很充足的能量、得以順利運作。所有的記憶的形成和維持,都依賴神經網絡順利運作。如果有人變得健忘,可能是這個神經網絡傳導效果變差了,若能透過增加神經細胞能量的方式,來促進神經網絡傳導效能,也許可以改善失智,以前的記憶也許並不是消失,而是無法順利傳導。
神經退化原因:壞蛋白質堆積致禍
便秘是因為廢物阻塞在腸道,會導致極不舒服的感覺,嚴重時甚至會喪失生活和工作的能力。對人腦中的神經細胞而言,若無法順利代謝壞蛋白質,則會導致堆積成斑塊,也會阻礙神經傳導功能,嚴重甚至造成神經退化疾病,例如失智症、亨丁頓舞蹈症、漸凍人等等。
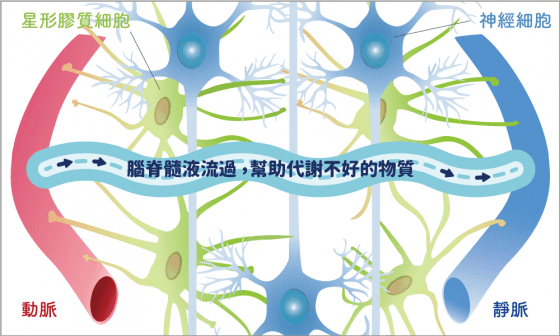
但神經細胞如何倒垃圾呢?就要靠「腦脊髓液」幫忙。星形膠質細胞的腳會包住血管和神經細胞,在血管和星形膠質細胞中間形成一個極小的空間,足以讓大腦中的腦脊髓液通過,把存在於神經細胞的壞蛋白質帶出腦部加以排除、以防堆積成斑塊,例如造成失智症的類澱粉蛋白(A-β)。當腦脊髓液流通地越順暢,代謝效果就越好。
如果家裡突然出現一個隕石,越來越大,越來越大,那你正常的生活機能就會喪失。這就是蛋白質斑塊對神經細胞的威脅。
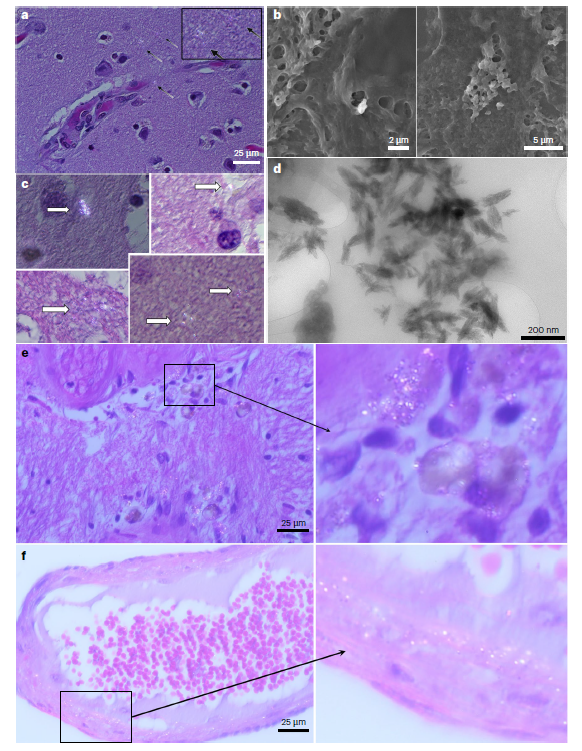
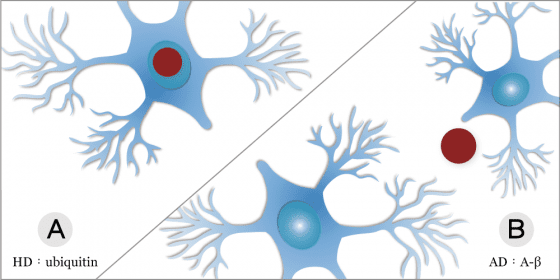
許多種神經退化疾病的神經細胞,都有蛋白質不正常堆積的情形,包含亨丁頓舞蹈症(下圖 A)、阿茲海默症(下圖 B)、帕金森氏症 、及漸凍人。年輕的時候,神經細胞會把壞蛋白質分解或排出,小小的微膠細胞也會跑來試著吞噬壞蛋白質,如果排清和吞噬的能力好,壞蛋白質累積在腦中就會少。但壞蛋白質終究還是會累積,當累積越來越多,會在神經細胞周圍(或細胞中)累積成一大坨斑塊,導致神經細胞死掉、神經網絡傳導功能降低,這就是神經退化疾病產生的原因之一。
為了神經細胞好,你有理由多睡覺
Maiken Nedergaard 博士的研究室,以老鼠做了一個實驗(註二),在腦膜打進去不同分子大小的染料,觀察染料如何隨著腦脊髓液在腦中流動擴散。紅色的染料分子比較大,綠色的染料分子比較小。他們發現腦脊髓液流動擴散的效果,和「年齡」及「睡眠」息息相關。

如上圖所示,年輕的老鼠(上方腦切片)腦脊髓液流通效果很好,大分子的紅色染料和小分子的綠色染料遍布腦中混成黃色,大小分子在腦中跑得差不多快。但年老的老鼠(下方腦切片)就不是這樣了,只有小分子的紅色染料透過腦脊髓液傳輸得比較快,大分子的綠色染料還是停在從腦膜打入的位置、沒什麼移動。
無論是老鼠或人類,年紀增長之後腦中的代謝功能都會變差,進而出現神經退化,這是個殘酷的事實。
但先別數著年齡哭泣,大家可以從現在開始好好地睡覺,而且要睡飽。因為在 Dr. Maiken Nedergaard 的實驗中,發現睡覺時神經膠細胞會變小,讓腦脊髓液流通的空隙變大、流速變快,是清理神經網絡中壞蛋白質的最佳時機。
為了讓神經細胞順利清理廢物,每個人都需要好好睡個覺。
以亨丁頓舞蹈症為模型,發展神經退化疾病藥物
了解神經網絡之後,下個目標是藉由神經退化疾病的動物模型,了解哪些機制影響發病,藉以找出用藥的機會。
失智症是老年最常見的神經退化疾病,但病因相當複雜、目前並無完善的動物模型。而「亨丁頓舞蹈症」只有一個基因突變就造成疾病,現階段已經有相當好的動物模型供科學家探討。
陳儀莊與研究團隊從亨丁頓舞蹈症著手研究藥物發展,是由於亨丁頓舞蹈症和其他神經退化疾病有類似的病理機制,例如神經細胞都會有壞蛋白質堆積的狀況、沒辦法正常分解。若有藥物能藉著促進壞蛋白的分解來治療亨丁頓舞蹈症,就能進一步探討同樣的藥物是否也能用於治療漸凍人或失智症等其他神經退化疾病。
人的身體中,所有東西都是雙面刃。
在藥物成功開發前,很多人希望專家可以先告訴自己吃什麼病就會好、吃什麼會糟,但陳儀莊提醒,神經網絡是個相當複雜的系統,每個食物的作用也很複雜,並非一言就能定之。希望大眾可以從認識自己的神經細胞開始,進而了解如何保護神經網絡正常運作。
另外,亨丁頓舞蹈症會透過基因代代遺傳,目前在世界上有些落後地區仍認為罹患此病可能是家族受到妖魔附身或詛咒,這是對於神經退化疾病不夠了解而產生的誤會。其實神經退化疾病並不會危害他人,反而是病人因為無法好好走路、容易跌倒,或是忘了自己有沒有吃過飯,造成自身的危險。在藥物成功開發前我們都能做到的事,是對神經退化疾病更加了解,照顧好自己的神經網絡,也願意為病友及家屬提供協助。
延伸閱讀
- 在神經細胞世界裡探險!專訪神經科學家陳儀莊
- 陳儀莊的個人網頁
- 中研院知識饗宴「敵我難料──神經退化疾病中的星形膠質細胞」
- 註一. Gao et al., 2016, PNAS 113: 8526- 8531.
- 註一. Suzuki et al., 2011, Cell 144: 810-823.
- 註二. Xie et al., 2013, Science 342: 373-377.
- 註二. Kress et al., 2014, Ann. Neurol. 76: 845-861.
- Kao* , Lin* et al., 2017, Human Molecular Genetics (doi: 10.1093/hmg/ddw402).
- Chiu*, Lin*, Chuang*, Chien* et al., 2015, Human Molecular Genetics 24: 6066-6079.
- Liu Y-J et al., 2015, FEBS Letters 2015, 589: 432-439
- Liu Y-J et al., 2015, Human Molecular Genetics 24: 787-801.
- Hsiao et al., 2014, Human Molecular Genetics 23: 4328-4344.
- Lin et al., 2013, Mol. Cell Biol. 33:1073-1084.
- Ju et al., 2011, Journal of Cell Biology 194: 209 – 227.
- Huang*, Lin *, 2011, PLoS ONE 6: e20934.
- Chou et al., 2005, Journal of Neurochemistry 93: 310-320.
執行編輯|林婷嫻 美術編輯|張語辰
本著作由研之有物製作,以創用CC 姓名標示–非商業性–禁止改作 4.0 國際 授權條款釋出。
本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位