本文由器官捐贈移植登錄中心贊助,泛科學策劃執行。
作者:蔣維倫
「愛滋患者可以捐贈器官嗎?那不會很恐怖嗎?」
「本來嘛,愛滋患者的確是不能捐贈器官的。但在2013年之後,就不太一樣了……」
–美國在2013年成為全球首個開放愛滋患者捐器官的國家 (僅能捐贈給同樣HIV陽型的人)
那些關於器官捐贈 & 移植,不敢舉手問的問題……
死亡一直是台灣人所忌諱的話題,所以連帶著的許多關於器官捐贈和移植的問題也不知從何問起,今天藉由本文,來替大家補充一點相關的知識吧!
「為什麼我去每間醫院都會看到器官捐贈的勸募?有這麼缺嗎?」
是的,真的有這麼缺。單以美國為例,約有12萬名患者在等候器官,而在台灣,命懸一線的器官衰竭患者將近有9000人。但這些患者僅有約1/10的比例能夠等到器官,而剩下的90%的病人,就只能在名單上等到死神來臨的那天。
「不會有人買賣器官嗎?怎麼確定這些遺愛的器官都是給了最需要的病人,而不是出價最高的病人?」
對於器官買賣的態度,世界各國趨於一致,中國、日本、韓國和我國等,都以法律白紙黑字地規範器官買賣違法。我國在2015年修法,購買、販賣或仲介器官都屬於違法的行為,而且內文規定,即使是在國外買賣器官,仍然會被判刑。
而在台灣的移植醫學發展早期,每家醫院都各自為政,並沒有全國性的患者資訊系統。而2001年的5月,陳希聖教授之死引起了一連串的改革,促使政府成立了專職統籌器官分配的器官捐贈移植登錄中心,而柯文哲醫師主導建置的器官分配軟體資料庫系統,更在2005年4月1號上線,從那天起,不論在任何一家醫院所捐贈的大愛器官,都會由系統進行分配,由軟體顯示目前最適合的患者以及所在的醫院,大幅地減少電話溝通的時間,以確保器官移植的公平、透明和專業性!
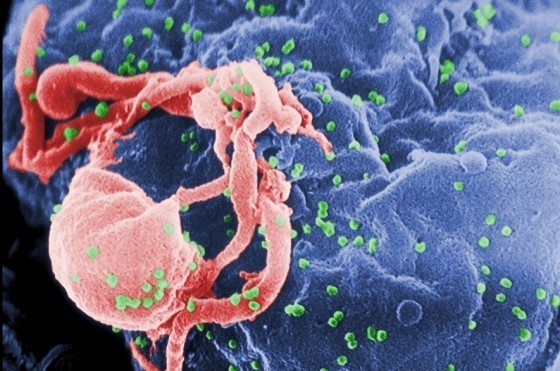
「會不會分配到有愛滋病毒的器官給我?」
醫學的考量上,部分疾病的患者是不能捐贈器官的,其中就包含愛滋病患者,所以並不會有感染愛滋病毒的器官進入移植手術裡。
「騙人!那當年的愛滋器官誤植事件怎麼來的?」
在2002年建立器官捐贈移植登錄中心之時,雖然規範愛滋等疾病的病人無法成為捐贈者,但並沒有納入疾病管制局的愛滋患者資料庫,此潛在的缺點在9年後的愛滋器官誤植事件完全暴露出來。因此現在捐贈者每登錄一個捐贈者的資料到器官捐贈移植登錄中心的登錄系統中,電腦會同時和疾病管制署連線,以排除愛滋病和庫賈氏病人的可能性,避免降低類似事件再次發生的可能性。
「但,關於愛滋患者的就醫權益還沒結束」
愛滋病在1981年首次出現在世界上,兇惡的致死率以及無藥可醫的特性,震撼了所有人,也因此世界各國的移植醫學都將愛滋患者排除在外,於是愛滋患者和我們不一樣,他們無法享有移植醫學帶來的福利(這算是歧視嗎?)。但自從1995年何大一博士發展雞尾酒抗病毒療法之後,快速進步的醫學逐漸控制住愛滋病的發展,也因此愛滋患者的就醫權益等議題開始浮出檯面。移植醫學從以前的完全拒絕愛滋患者,如今已有少數歐美國家已經開放愛滋患者接受器官移植(美、英、義、法和西班牙),我國也極有可能在2016年開放,成為亞洲首個讓愛滋患者獲得器官移植機會的國家。

「我得了B型肝炎(或C型肝炎),那還可以簽署器官捐贈的意願嗎?」
可以!B肝帶原者的器官也可以救人!到了要真正捐贈之時,醫師會判斷捐贈者的器官狀況疾病毒量確定是否適合捐贈。事實上,目前僅有愛滋患者、狂牛症(庫賈氏病)和無法控制的傳染病患者,會被婉拒捐贈器官。而B型肝炎帶原者或癌症患者等,在目前醫學進度的時代,都可以簽署捐贈意願,適時地表達自己的意願和看法 [註1]。
而值得關注的是,經過漫長的科學評估,美國在2013年通過新法案-HIV Organ Policy Equity Act,簡稱希望(HOPE)法案,此法案開放病情控制良好的愛滋患者也能夠捐贈器官拯救他人。此法案開放之後,會對未來的移植醫學造成什麼影響,值得我們持續的了解和關注,也許有朝一日,台灣也能跟進美國的腳步,讓更多人獲得一線生機,重獲新生吧!

「腦死是什麼?」
「腦死」一詞是從法文的「超越昏迷(coma dépassé)」演化而來的。1929年時,德國科學家漢斯·伯格(Hans Berger)首次發現並記錄大腦的神經活動,也就是今日所稱的「腦電波圖」,而只要是存活的大腦組織,就會發送電波,因此可以藉由觀測腦電波圖來了解大腦的狀態。但醫學界也發現到,頭部傷勢嚴重的病人,大腦死亡後,心臟仍會短暫地跳動一陣子,但由於腦組織沒有再生的能力,病人其實已經是回天乏術了。
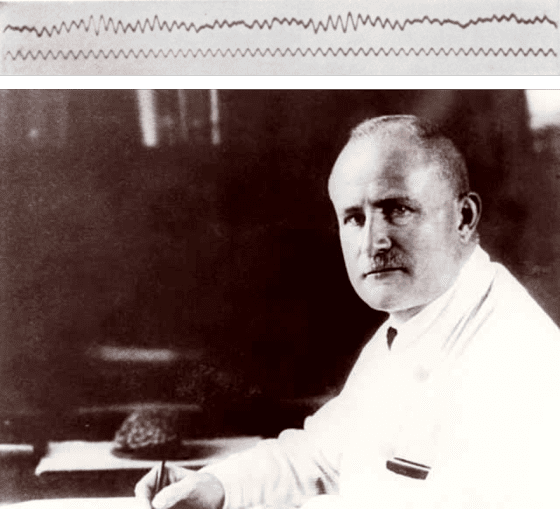
到了1959年,法文的醫學出版社(La Presse Médicale)和神經評論(Revue neurologique)期刊,先後登出了兩篇敘述神經系統死亡的論文,也就是我們今日熟知的腦死,作者不僅敘述症狀,作者也提出了「超越昏迷」的概念,醫學界逐漸對腦死的定義有了共識。
而腦死的概念不僅在法國醫界逐漸成型,宗教界的領袖更推了一把!天主教教宗庇護十二世(Pius ⅩⅡ)主張人的靈魂存於腦中,所以腦死之後,剩餘的軀體是不存在靈魂的。此思想逐漸被西方國家接受,1968年哈佛醫學院的醫師們在美國醫學協會(The Journal of the American Medical Association, JAMA)期刊發表聯合報告-「無法回復的昏迷(A Definition of Irreversible Coma)」,陳述腦死的定義,並且說明了腦死的患者是無法存活的,促請各州政府將標準列入法規。從此之後,腦死在醫學、法律上都有了明確的定義,移植醫學開始大步邁進。
腦死概念的出現,對移植醫學非常重要,因為在此概念成型之前,法律僅接受心跳停止後才能捐贈器官,而心跳停止後消失的血液循環可能會對臟器產生許多不良影響(如:血栓、組織缺氧壞死或其他藥物的影響),導致捐贈器官的品質下降,進而影響移植手術的成功率。

「我看到國外有移植陰莖的手術,我想幫我的朋友問可不可以……」
在我國不行喔~雖然國外有移植陰莖和子宮的案例,但由於此二器官並未在我國開放,所以可能要專案申請才有機會喔!
寫在文末
在台灣,「死亡」的議題一直是個禁忌的話題,但一昧的逃避討論,無助於醫學的進步。在以色列、印度和韓國等,分別認為在校園推廣生死教育、結合宗教領袖宣導、以及配合媒體名人的親力親為,都能正面的提升器官捐贈在一般民眾的接受度。他山之石可以攻錯,我國也應該學習他們的做法,讓更多的民眾認識移植醫學以及它們背後的故事。
- 註1:若是有眼睛腫瘤的病史,仍無法捐贈眼角膜,在不同的器官將會有類似的規定,預知詳情,歡迎前往器官捐贈移植登錄中心粉絲團發問!
參考文獻
- Bram P Wispelwey, Ari Z Zivotofsky, Alan B Jotkowitz (2015) The transplantation of solid organs from HIV-positive donors to HIV-negative recipients: ethical implications, Journal of Medical Ethics, 41, 367-370, DOI: 10.1136/medethics-2014-102027
- 財團法人器官捐贈移植登錄中心官方網頁。
- 人體器官移植條例,衛生福利部衛生福利法規查詢系統。
- 人體器官移植分配及管理辦法,財團法人器官捐贈移植登錄中心官方網頁。
- HIV Organ Policy Equity (HOPE) Act is Now Law. 美國白宮官方網頁。
- Uterus Transplants May Soon Help Some Infertile Women in the U.S. Become Pregnant. 紐約時報官方網頁。
- Penis Transplants Being Planned to Help Wounded Troops. 紐約時報官方網頁。