維吉尼亞大學醫學院(University of Virginia School of Medicine)的研究團隊,發現一條直接連接大腦與免疫系統的淋巴管,這很可能改寫全球的教科書。
令人驚訝的是,這條淋巴管居然能逃過詳徹的全身淋巴系統偵測如此多年。這條特別的淋巴管,將補足過去淋巴系統於中樞神經系統中所缺失的一塊。此項發現的中樞神經淋巴系統,迫使過去神經免疫學的基礎假設要重新評估,並可能揭示與免疫系統障礙相關的神經炎、及阿茲海默症等退化性神經疾病的病因。
因為發現了腦有腦膜淋巴管,科學家可以像討論其他與周邊神經系統相連的組織一樣,從機制面上探討免疫相關的神經疾患。維吉尼亞大學腦免疫與神經膠細胞中心(UVA’s Center for Brain Immunology and Glia, BIG)主任Jonathan Kipnis教授說:「這項發現完全改變了我們看待神經與免疫的交互作用。之前我們一直認為它是深奧而無法進行研究的東西,但現在我們能夠很務實地從機制面來提問了。」
人體中的新發現
維吉尼亞大學神經科學系(UVA Department of Neuroscience)主任Kevin Lee教授對於Kipnis實驗室研究發現的第一個反應是:「他們即將改寫教科書!」他表示,中樞神經系統中從來就不曾存在淋巴系統,但很明顯地,這第一次非凡的觀察,將徹底改變人們看待中樞神經系統與免疫系統之間的關係。
儘管Kipnis起初抱著懷疑的心態,不相信居然有人們從未注意到的結構存在在人體中。他們在發現那條淋巴管之後,做了許多研究以鞏固其研究發現。他說:「我以為這項發現早該在中世紀時結案,但很顯然並不是。」
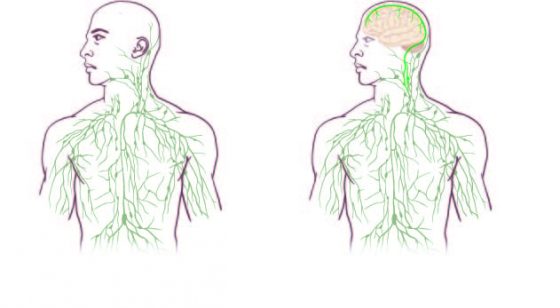
藏得非常好
這項發現因為Kipnis實驗室中的Antoine Louveau博士後研究員而誕生。 Louveau發展了一種方法來把老鼠的腦膜(覆蓋在大腦上的薄膜)安放在一個切片上,以便以一個整體的方式來檢查。他們把腦膜固定在顱骨內,好讓組織能妥當地在其原本的生理環境之中,然後再進行解剖。如果用其他方法執行,將不會是這樣的結果。
在注意到他切片上免疫細胞中類似血管圖樣的分佈,他做了淋巴管的測試,於是不可能成真了。
Kipnis 形容這淋巴管「藏得非常好」,並提到它沿著一條主要的血管一路通到靜脈竇:一個難以造影的地方。他說:「它太靠近血管了,如果你不知道你在找什麼,你必定會錯過它!」
Kipnis說:「這些淋巴管的即時的影像至關重要地展示了它們的功能,若不是與Tajie Harris合作,這是不可能成真的。」Harris博士,是神經科學系的助理教授也是BIG中心的一員。Kipnis亦向擁有驚人外科技巧的副研究員Igor Smirnov致敬,因為他也在此項造影的成功中扮演了關鍵的角色。
阿茲海默症、自閉症、多發性硬化症……以及更多
這意外發現的淋巴管,揭示了數億千計需被回答的,不管是關於大腦的運作、還是阻礙其運作的問題。以阿茲海默症為例, Kipnis表示:「阿茲海默症的患者的大腦中有許多蛋白質的累積。我們認為他們會積聚在大腦,可能是因為他們無法被有效地被這些淋巴管排除。」他指出,淋巴管在不同年齡看起來是不同的,所以他們在退化中所扮演的角色則是另一條可探索的途徑。而其他從自閉症到多發性硬化症等數量龐大的神經系統疾病,必須根據科學上存在的東西而非不存在的東西去重新思索。
參考資料:
- University of Virginia Health System. (2015, June 1). Missing link found between brain, immune system; major disease implications. ScienceDaily. Retrieved June 10, 2015 from www.sciencedaily.com/releases/2015/06/150601122445.htm
- Missing link found between brain, immune system — with profound disease implications. University of Virginia Health System [01 Jun, 2015]
-
Louveau, A. et al. (2015) Structural and functional features of central nervous system lymphatic vessels. Nature. DOI: 10.1038/nature14432