- 本文轉載自科技大觀園,原文為《時光流變中的偉大渺小:探尋初級纖毛於神經發育的功能》
- 作者/陳品萱|科技大觀園特約編輯
我們對於纖毛的印象,或許是在氣管、輸卵管表面,擺動的纖毛推動痰液或卵子前進,又或者是在更原始的生物如草履蟲表面,纖毛幫助生物游動。在演化早期,這一類的纖毛對於生物體生存具有重大的意義,細胞仰賴這些纖毛或特化的鞭毛運動,往特定的方向移動。

初級纖毛——不會動的纖毛有什麼用?
從單細胞生物演變到多細胞生物的漫長歷程中,纖毛協助運動的功用似乎不再如過往重要,但細胞仍然保留著這個胞器。這種不會運動的纖毛,就是初級纖毛(primary cilia)。許多神經細胞也具有初級纖毛,然而科學界對於這些纖毛的功能或作用仍不清楚。陽明大學腦科學研究所教授蔡金吾致力研究神經系統中的纖毛,試圖解析纖毛與腦部發育疾病以及腫瘤的關係。
科學家曾認為初級纖毛僅是演化過程中,運動纖毛退化而成的痕跡構造,後來卻發現它們的功能發生變化:它們雖不再具有運動的功能,但伸出細胞外的纖毛,成了一個像是天線般的構造,可以感應與接收外來訊息,有助細胞的訊息傳導。
初級纖毛不僅在生理與發育過程中扮演著重要角色,在許多細胞中,當初級纖毛發生缺陷時,也會造成細胞功能的缺失甚至疾病,統稱為纖毛類疾病(ciliopathies)。科學家發現患有纖毛類疾病者,常有智力發展或小腦萎縮等問題,推測初級纖毛的缺陷,影響神經系統的生理功能。
纖毛在神經系統中的功能究竟是什麼呢?蔡金吾在研究神經發育的過程中,發現纖毛也出現在許多神經幹細胞中,包含大腦的放射狀膠質細胞(radial glia cells, RGCs)與小腦的顆粒前驅細胞(granule neuron progenitors)。許多分化完成的神經細胞也具有纖毛,少數的一個例外,則是小腦中成熟的顆粒細胞(granule neurons)不具有初級纖毛。這項發現也促使蔡金吾的研究團隊更加好奇,初級纖毛在不同細胞、不同時期,分別具有什麼功能。
研究緣起:原來中心體和纖毛息息相關
不過蔡金吾並不是原先就想研究纖毛,起初的研究興趣是探討中心體對於神經細胞遷移(neuronal migration)作用的影響。中心體是動物細胞中的微管組織中心,在細胞分裂時協助將染色體分配到子細胞。
蔡金吾在哥倫比亞大學就讀博士班期間,研究大腦發育疾病——平腦症(lissencephaly)的致病機轉。大腦發育過程中,神經幹細胞分裂並分化成神經細胞的過程位於腦部深層,而神經細胞須遷移至腦部表層,進一步形成大腦皮質。在由 LIS1 基因突變造成的平腦症中,神經細胞的遷移會受阻。蔡金吾透過實驗觀察與文獻探討,認為神經細胞在遷移過程中,中心體就像婚禮禮俗中「帶路雞」的角色,會率先在細胞中往上跑,帶領細胞核往上移動;但 LIS1 基因若突變,中心體便無法往上跑,整個神經細胞無法往上遷移,造成發育上的缺陷。
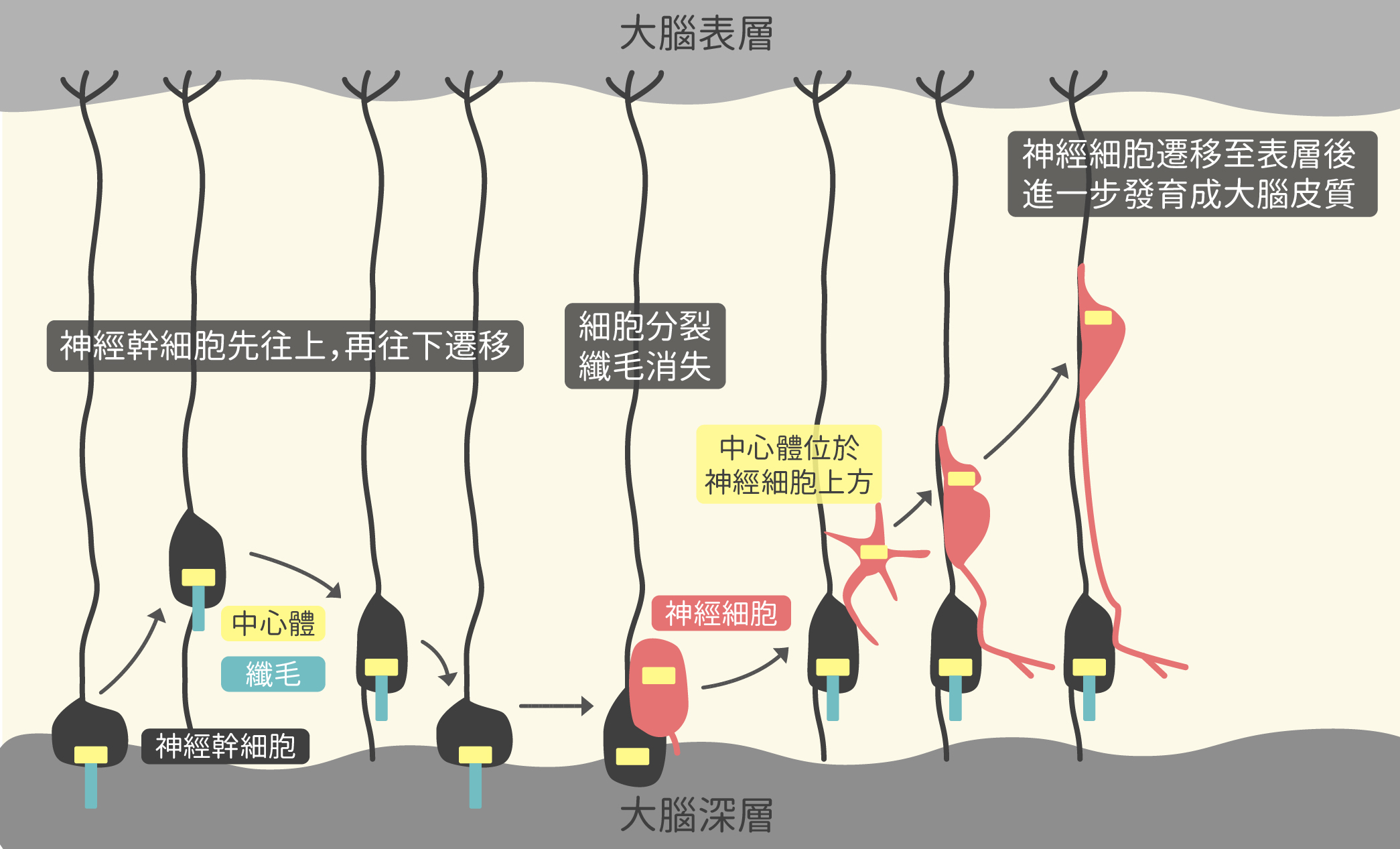
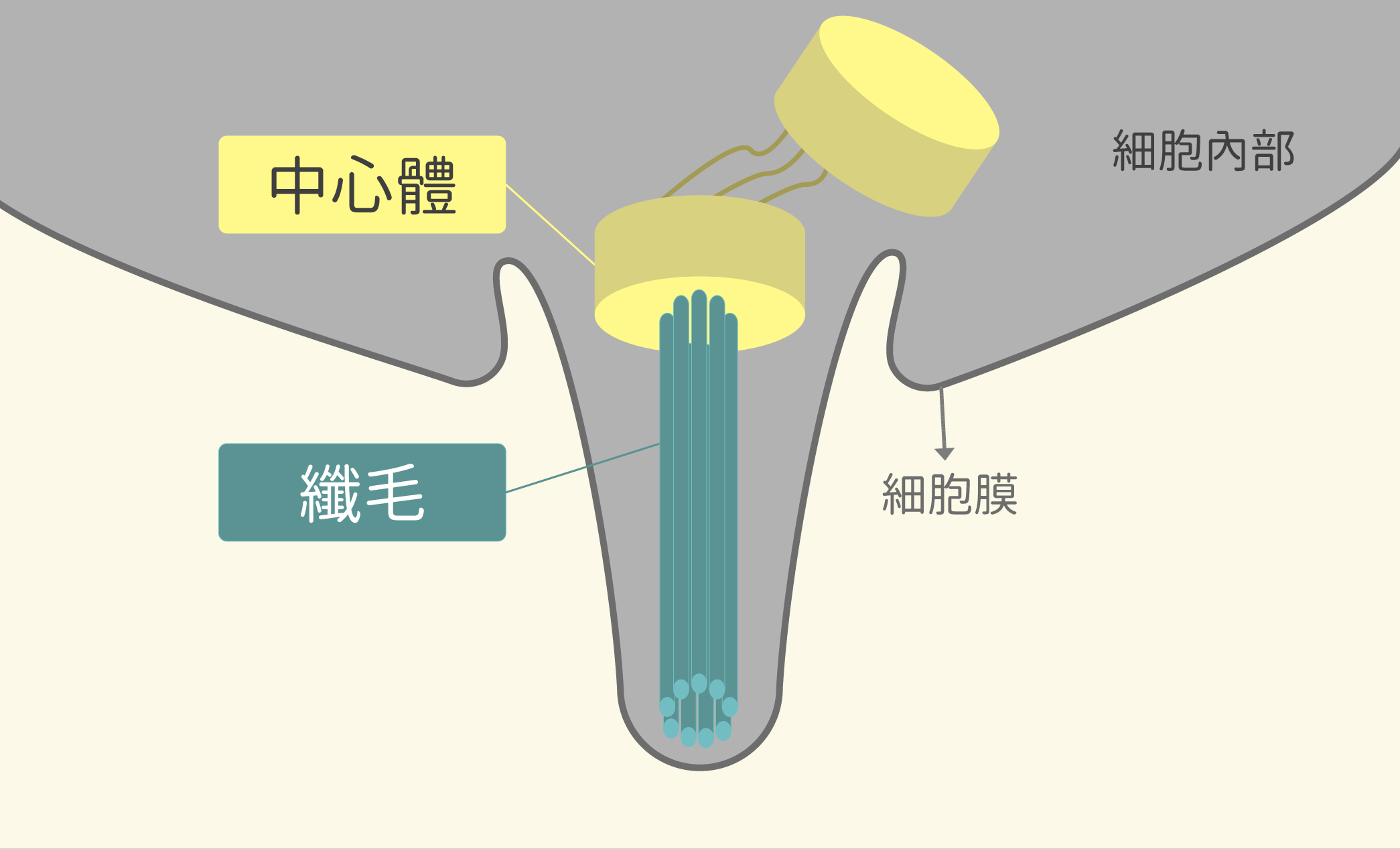
然而,中心體和纖毛有什麼關係?其實,纖毛是由中心體長出來的!
蔡金吾發現, 神經幹細胞在分裂之前,竟然會先往上、再往下遷移,而這個過程中,中心體並沒有扮演帶路的角色,反而始終位於細胞中的下方。原來是因為,位於神經幹細胞下方的中心體會朝下長出初級纖毛,等到分裂時纖毛則消失不見。
過度活化的天線,導致腫瘤形成
纖毛的生長在神經發育中扮演著重要的角色,然而當它失去調控時,又會出現什麼情形呢?近年蔡金吾與法國居禮研究所的 Dr. Olivier Ayrault 合作,探討小腦髓母細胞瘤的發展過程,開啟了與纖毛的正面交鋒。小腦髓母細胞瘤是一種嚴重的小兒惡性腫瘤,過往科學家已知有一類型的小腦髓母細胞瘤會過度表現 Atoh1(小腦顆粒前驅細胞生長必須的一種轉錄因子),卻不知道為什麼。
蔡金吾研究團隊透過小腦電穿孔技術,將特定 DNA 送入小腦的神經幹細胞,以操控要表現的蛋白質。
研究團隊以雙光子顯微鏡觀測小腦發育的情形,發現若讓 Atoh1 轉錄因子過度表現,神經幹細胞就無法正常分化與遷移,而是保持神經幹細胞的狀態並持續分裂。此外,也發現初級纖毛受到 Atoh1 的調控,Atoh1 的過度表現,使得初級纖毛持續存在。初級纖毛具有像是天線一般接收外界訊息的功能,因此細胞持續接收特定訊息,促使細胞不斷分裂、增生,進而形成腫瘤。
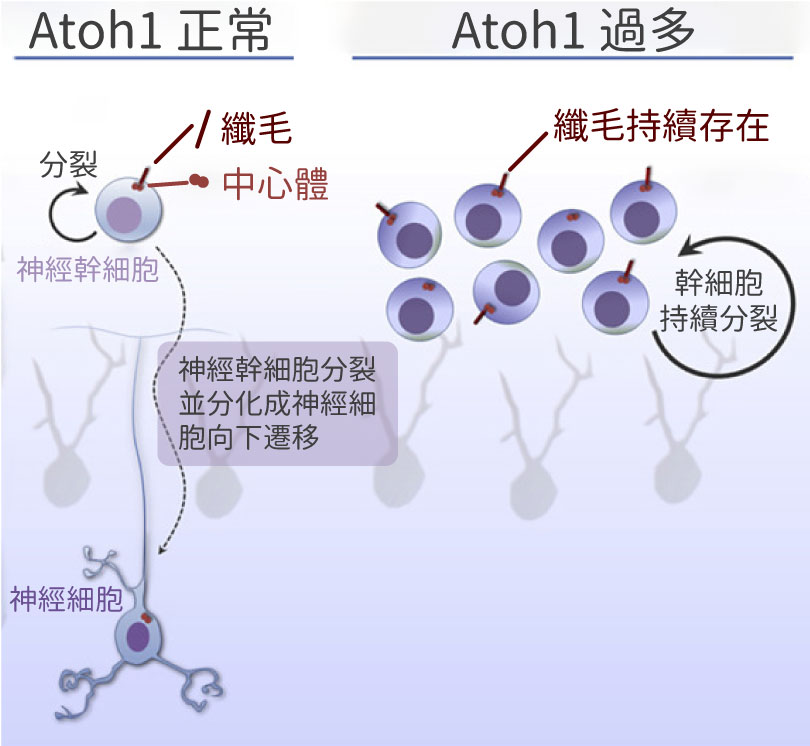
過往在癌症研究中,認為腫瘤形成往往與初級纖毛的缺失有關;然而在小腦髓母細胞瘤中,初級纖毛受到失調的訊息傳導而持續存在,卻反而成了促使腫瘤生長的關鍵。蔡金吾表示,原先並沒有特別思索纖毛與神經細胞功能的關聯,如今回顧,卻發現這些研究都與纖毛有著直接或間接的關係。目前蔡金吾與清華大學醫學科學系副教授林玉俊、陽明大學生化暨分子生物研究所副教授王琬菁合作,期望透過先進技術,更精準地進行實驗操縱,共同解開纖毛—中心體複合體在神經發育過程中的功能。
鼓勵學生多探索,會有意想不到的旅程
蔡金吾鼓勵學生們不要只是照著假說的脈絡走,更要多觀察、多探索。他回顧自己的經歷,有許多意想不到的驚喜發現,例如從事博士後研究時,觀察小鼠大腦的神經幹細胞遷移,眼角餘光的一瞥,意外發現一群新的細胞——外層放射狀膠質細胞(outer radial glia cells, oRGs),當時科學家認為只有靈長類才具有 oRG 細胞。這項發現令他們感到十分驚喜,也打破了過去既定的認知。
還有蔡金吾剛回臺灣時,聆聽一場癌症生物學的演講,聽到講者利用跳躍基因在細胞中隨機誘發突變,以鑑測出癌症進程中重要的基因。看似與自己研究領域無關的主題,卻讓他後來有一天夢到:是不是也能把跳躍基因應用於大腦發育的基因研究?醒來後,他趕緊衝到電腦前,在論文資料庫搜尋相關關鍵字,驚喜地發現還沒有人做過類似的研究。於是他帶領實驗室學生,結合子宮內電穿孔(in utero electroporation)技術,把跳躍基因送到大腦的神經幹細胞中,再進行篩選,成功找出與大腦發育相關疾病的基因。蔡金吾形容這像是一種 eureka moment,一個靈光乍現的時刻。

研究過程雖非一帆風順,但是這些不可預期的、意想不到的發現,卻讓蔡金吾感覺十分有趣,他強調,當實驗結果與預設的假說不符時(當然,前提是結果可重複可再現),不要感到害怕,而是要更進一步去探究。蔡金吾笑說:「這可能也是為什麼我十歲的時候,就想要做科學研究。」
蔡金吾的跨領域人生
受到華裔太空人王贛駿教授的啟發,小時候蔡金吾便對物理學產生濃厚的興趣。由於對大自然的好奇,上大學後雙主修物理與動物科學,在臺大物理系教授曹培熙的實驗室進行專題研究期間,架設光鑷子(optical tweezers),應用於細胞力學的研究,後來經過臺大生命科學系教授嚴震東推介,進入陽明大學微生物免疫學研究所教授林奇宏的實驗室進行相關研究,後來又到哥倫比亞大學進行神經生物學研究,蔡金吾一路上累積的跨領域研究經驗,其實都不是原先預想到的。他指出,人生並非一路筆直的坦途,但是「當機會來臨的時候,我會去抓住它。」
未來蔡金吾除了延續過往大腦與小腦發育疾病的研究之外,近年來也投入神經退化性疾病的研究,希望能夠找到適合的藥物標靶,減緩患者症狀。蔡金吾說,從事科學研究其實受惠於社會非常多,除了探究疾病的機制以外,也期望能夠找到方法,協助治療疾病,改善患者的生活。
參考資料
1. Tsai, J., Chen, Y., Kriegstein, A. R., & Vallee, R. B. (2005). LIS1 RNA interference blocks neural stem cell division, morphogenesis, and motility at multiple stages. Journal of Cell Biology, 170(6), 935-945.
2. Hsiao, C., Chang, C., Ibrahim, R. B., Lin, I., Wang, C., Wang, W., & Tsai, J. (2018). Gli2 modulates cell cycle re-entry through autophagy-mediated regulation of the length of primary cilia. Journal of Cell Science, 131(24), jcs221218.
3. Chang, C., Zanini, M., Shirvani, H., Cheng, J., Yu, H., Feng, C., Mercier, A. L., Hung, S., Forget, A., Wang, C., Cigna, S. M., Lu, I., Chen, W., Leboucher, S., Wang, W., Ruat, M., Spassky, N., Tsai, J., & Ayrault, O. (2019). Atoh1 controls primary cilia formation to allow for SHH-triggered granule Neuron progenitor proliferation. Developmental Cell, 48(2), 184-199.e5.