大規模施打牛津 AZ 疫苗後,零星地出現極罕見的血栓併血小板低下患者,甚至多人死亡。經多日調查,歐盟認為此為牛津 AZ 疫苗罕見的副作用。本文介紹數名患者症狀、實驗室檢測等 [1, 2],並在文末推理出數位可能的兇手。
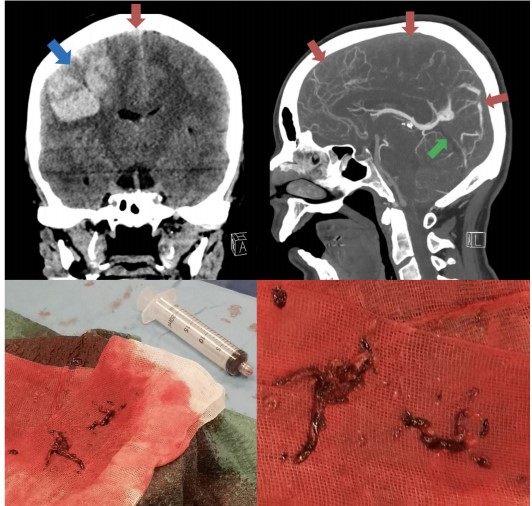
頭痛、背痛、中風、視力障礙
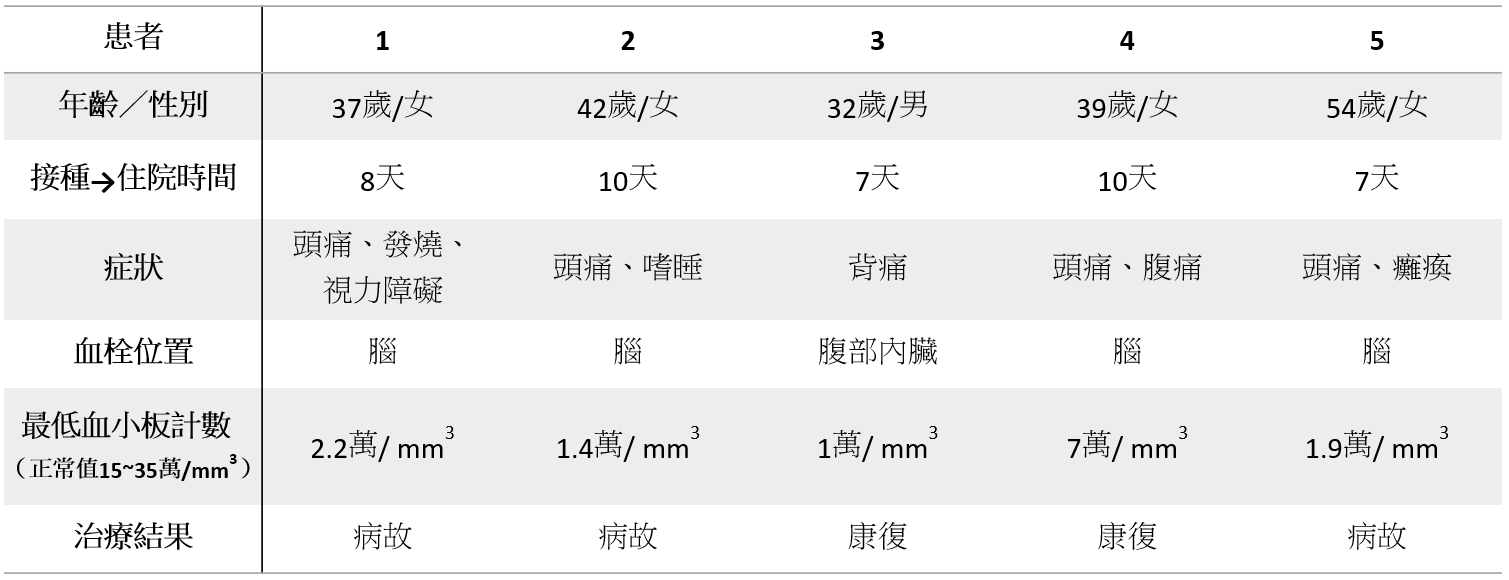
- 患者 1
37 歲女性,接種疫苗後一週,出現持續頭痛和發燒。檢驗發現血小板嚴重低下,電腦斷層掃瞄 (CT) 顯示大腦靜脈血栓;次日病況惡化,出現大規模腦出血且水腫,緊急進行開顱減壓手術。術後次日病故。 - 患者 2
42 歲女性,接種疫苗後一週出現頭痛。其後迅速惡化,出現意識衰退。檢驗發現血小板嚴重低下、電腦斷層掃瞄 (CT) 顯示大腦靜脈出現血栓。治療期間大腦嚴重出血而病故。 - 患者 3
32 歲男性,因背痛就醫,檢查時發現沒有出血,但卻有嚴重的血小板低下。電腦斷層掃瞄 (CT) 顯示肝臟門脈、脾臟靜脈等出現血栓。治療後最終康復。 - 患者 4
39 歲女性,接種疫苗後 8 天出現頭痛、腹痛,檢驗發現輕微的血小板低下。兩日後頭痛加劇,電腦斷層掃瞄 (CT) 顯示大腦靜脈出現血栓、嚴重的血小板低下。治療後最終康復。 - 患者 5
54 歲女性,接種疫苗後一週,睡醒後驚覺中風、癱瘓。送醫後發現嚴重的血小板低下、電腦斷層掃瞄 (CT) 顯示大腦出血。治療期間持續惡化,經手術仍未改善,最終病故。
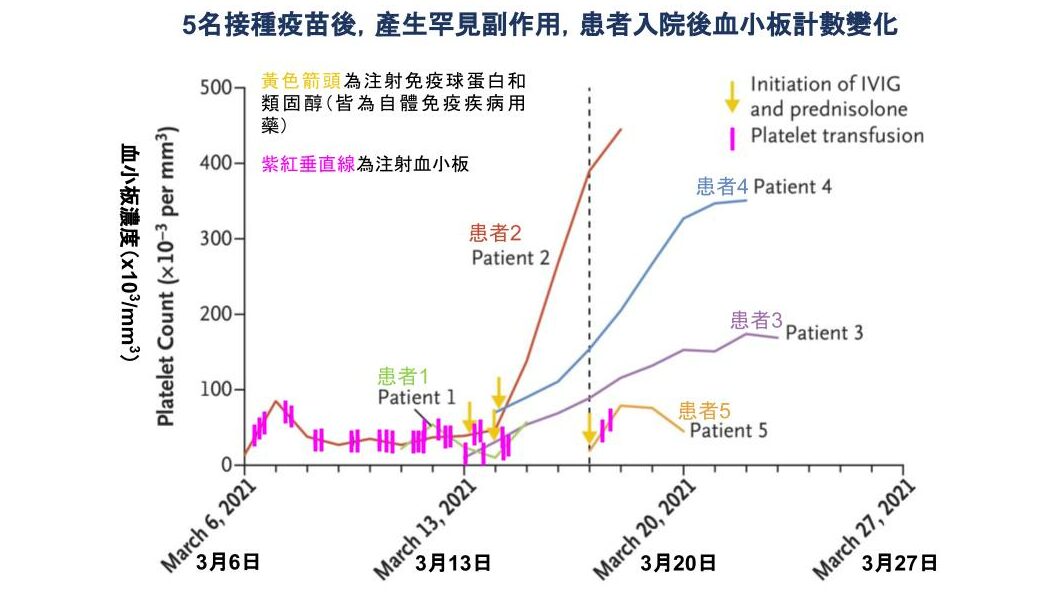
失控的抗體-自體免疫
患者同時出現「血栓」和「血小板低下」的罕見症狀。此病症讓人聯想到另一種疾病-肝素引起之血小板低下症 (HIT, heparin induced thrombocytopenia)。
肝素可防止血液凝固,在外科手術中,用肝素沖洗機械管壁,可避免血小板接觸管線後凝固。當肝素和人體的血小板第 4 因子 (PF4, platelet factor 4) 結合後,某些人的白血球會製造出辨認肝素/PF4 複合物 (PF4- heparin complex) 的抗體。失控的抗體刺激血小板釋出多種凝血物質、破壞內皮細胞,因此消耗大量血小板、活化凝血酶等,導致危險的血栓 [3-5]。因此 HIT 的患者,會同時出現血栓和血小板低下症狀。
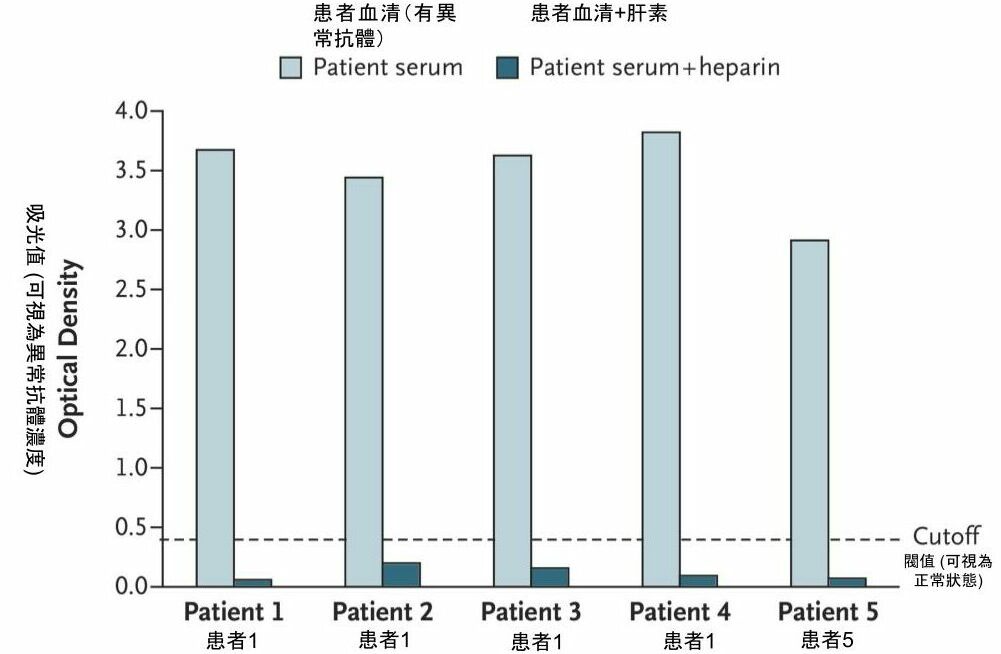
令人關注的是,此五名患者體內都有高濃度、類似 HIT 患者的抗體 (antibodies to PF4–polyanion complexes)。ELISA 測得的吸光值 (optical density) 約 2.9-3.8 之間,即便是 HIT 患者,抗體濃度的吸光值也鮮少超過 2,顯示出現對疫苗產生副作用的患者們,體內有高濃度、會攻擊自身血小板、引發血栓的失控抗體 [1]。此類似 HIT 的副作用,可被視為新疾病-疫苗誘導的血栓併血小板低下症 (VITT, vaccine-induced immune thrombotic thrombocytopenia)。
誰造成的!腺病毒 or DNA?
過往用腺病毒載體研究基因療法時,在動物裡發現,靜脈注射腺病毒可能會活化、凝集血小板[2],因此不能排除牛津 AZ 疫苗的副作用,起因是腺病毒載體誘發失控抗體。但不支持此假設的觀點是,疫苗是透過肌肉注射,與靜脈注射不同;且疫苗裡的病毒量少,不太可能引發如此劇烈的反應。另一個反駁的證據是,同為腺病毒載體的嬌生、俄羅斯衛星五號 (Sputnik V) 疫苗,並未回報出類似副作用 [註1]。
而近年來臨床發現,某些帶負電的高分子,如:戊聚醣多硫酸 (pentosan polysulfate) 等,也會誘發類似 HIT 的失控抗體。因此另一個嫌疑犯,是疫苗裡游離、未被包裹住,帶負電的 DNA。過往研究已發現,DNA 和 RNA 會和血小板第 4 因子形成複合物,進而誘發失控抗體[2],因此不能排除牛津 AZ 疫苗裡,有游離的 DNA 導致嚴重的副作用。但同樣的理由,大規模施打的嬌生、輝瑞-BNT 疫苗,其成分也有 DNA 或 RNA,為何只有牛津 AZ 疫苗出現此嚴重副作用?顯然目前的證據,仍無法讓這兩名嫌疑犯定罪。
和輝瑞-BNT、Moderna 疫苗相比,牛津 AZ 疫苗可說是意外不斷。偏偏它是台灣最大量的公費 COVID-19 疫苗,令人頗為擔心。只能期待更多的科學證據出現、恢復民眾信心,用疫苗幫助人類回到正常生活吧。
保持冷靜,繼續前進。Keep Calm and Carry On.
註 1:2021/04/09 報導,嬌生疫苗出現4例凝血、血小板低下的異常回報,尚待調查。
參考文獻
- Nina H. Schultz, M.D., Ph.D., Ingvild H. Sørvoll, M.D., Annika E. Michelsen, Ph.D., Ludvig A. Munthe, M.D., Ph.D., Fridtjof Lund-Johansen, M.D., Ph.D., Maria T. Ahlen, Ph.D., Markus Wiedmann, M.D., Ph.D., Anne-Hege Aamodt, M.D., Ph.D., Thor H. Skattør, M.D., Geir E. Tjønnfjord, M.D., Ph.D., and Pål A. Holme, M.D., Ph.D. (2021) Thrombosis and Thrombocytopenia after ChAdOx1 nCoV-19 Vaccination. The New England Journal of Medicine. DOI: 10.1056/NEJMoa2104882
- Andreas Greinacher, M.D., Thomas Thiele, M.D., Theodore E. Warkentin, M.D., Karin Weisser, Ph.D., Paul A. Kyrle, M.D., and Sabine Eichinger, M.D. (2021) Thrombotic Thrombocytopenia after ChAdOx1 nCov-19 Vaccination. The New England Journal of Medicine. DOI: 10.1056/NEJMoa2104840
- 肝素引起之血小板低下(Heparin induced thrombocytopenia,HIT)。中華民國血液病學會
- 肝素引起血小板低下症及案例報告。藥學雜誌
- I Ahmed, A Majeed, and R Powell (2007) Heparin induced thrombocytopenia: diagnosis and management update. Postgraduate Medical Journal. DOI: 10.1136/pgmj.2007.059188