- 採訪編輯|林任遠 美術編輯|張語辰
miRNA 研究為何重要——影響癌症的小小螺絲釘
miRNA 可調控許多生物的基因表現,並影響人類癌症的發生機制,是現代醫療的關鍵分子。詹世鵬副教授以 miRNA 為主要研究領域,現職於臺大醫學院微生物學科暨研究所,曾在中研院鄭淑珍院士門下求學,並將研究成果發表於《Science》,迄今持續拓展 miRNA 的基礎知識。而他的研究生涯起點,是高中時來到中研院參與的輔導實驗計畫。
調控基因表現的 miRNA
人類體內有上千個 miRNA 已完成定序,它們可調控 60% 的人類基因表現。而詹世鵬實驗室的主要研究領域是微核糖核酸的基因調控機制 (microRNA-mediated gene regulation) 以及小干擾核醣核酸 (small interfering RNA) 生成與作用機制的基礎研究。
詹世鵬在碩、博士班時期,於中研院鄭淑珍院士門下研究訊息核醣核酸剪接 (pre-mRNA splicing) 反應中的重要蛋白複合體 PRP19-complex,成果於 2003 年發表於《Science》,至今學界的最新研究仍引用為理論基礎。他隨後加入耶魯大學 Frank Slack 博士的團隊進行博士後研究。Slack 是發現 let-7 miRNA 的重要研究團隊成員,他的研究也證實 let-7 可調控致癌基因 RAS,並發現 let-7 的表現與肺癌有高度相關性。
到了博士後時期的研究主題,詹世鵬則探討微核醣核酸 (miRNA) 調控線蟲基因表現的機制。miRNA 的功能是近十多年來的重要生命科學發現,它們經由核醣核酸序列的互補性,辨認並結合標的訊息核醣核酸 (mRNA),抑制其訊息的轉譯功能、並促使其降解。
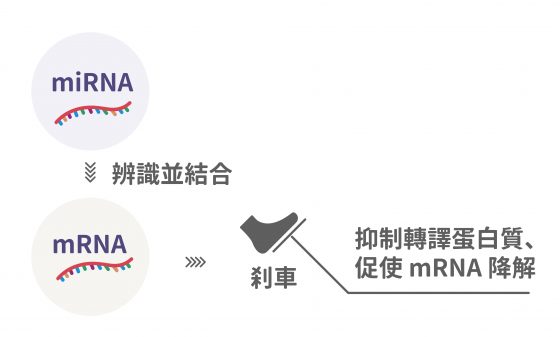
RNA(核糖核酸)在生物體內不僅是基因傳訊者,更以其他形式調節著基因表現,扮演個體發育、細胞凋亡、細胞分化等機制的關鍵角色。
提到 RNA,多數人會直覺想到分子生物學的中心原則,在基因表現過程中,mRNA (信使核糖核酸)擔綱訊息傳遞功能,也可說是夾在 DNA 和蛋白質之間的傳訊者。當 DNA 序列轉錄 (transcription) 成 mRNA 之後,mRNA 會再擔任模板、轉譯 (translation) 出蛋白質,進而展現生物化學層面的功能,而 tRNA、rRNA 則輔助此機制運作。
此外,miRNA (微核糖核酸) 與 siRNA (小干擾核糖核酸)廣泛存在於細菌、植物、動物體中,它們的功能不同於 mRNA ,自身沒有最終的蛋白質產物,卻能決定其他基因的表現。
研究證實 miRNA 的功能與人類癌症、個體發育關係緊密。但是,miRNA 調節基因表現的方式,仍是一面空白遍布的複雜拼圖。
藉由「線蟲」了解 miRNA
miRNA 是線蟲各發育階段的主要調控分子,巧妙貫串整個生命史;同時也因為 miRNA 的基因保守性,在其他生物與人類體內有許多基因是以相同機制調控,因此科學家會研究線蟲來了解 miRNA 的奧秘。
史上第一個被發現的微核醣核酸是線蟲的 lin-4 miRNA ,來自線蟲發育早期被活化的 lin-4 基因,轉錄出的 RNA 僅有 22 個核苷酸;lin-4 miRNA 本身無法轉譯產生蛋白質,卻能影響另一基因 lin-14 的表現。lin-4 不抑制 lin-14 基因的轉錄功能,卻能壓抑下一步的轉譯階段,使 lin-14 的蛋白產物大幅減少。此機制在 1993 年開始揭露,當時被視為線蟲特有的發育調節機制,並未引起廣大注意。
直到 2000 年,Gary Ruvkun 的研究團隊發現 lin-14 可以調控下游基因 let-7 的表現,而線蟲晚期發育時被活化的 let-7 產生的 miRNA 可以抑制下游基因 lin-41 以及成蟲發育基因 lin-29。以 miRNA 貫穿線蟲生命史的基因調控機制開始得到矚目。
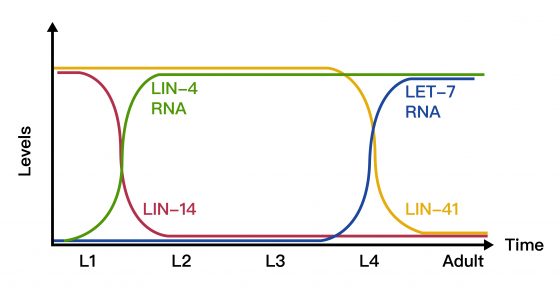
另外,於 2000 年,Pasquinelli 的研究團隊也指出 let-7 RNA 具有物種間的基因保守性 (Gene conservation),由於人類體內也含有 miRNA,miRNA 開始在發育學研究激起波瀾。
數年內,let-7 基因被發現與人類癌症關係緊密,例如,與肺癌病人術後存活率有直接關係、可以直接調控人類癌症基因 RAS。此後,許多研究團隊開始投入 miRNA 研究:包含尋找新種 miRNA,預測與鑑定其調控目標基因;研究 miRNA 在癌症中的角色,並測試相關療法。miRNA 成為分子生物學與基礎醫學領域的要角。
各種 miRNA 結合的輔助蛋白分子各異, 調控基因表現的機制也充滿複雜可能性。
miRNA 如何抑制基因表現仍存有爭論,某些研究支持 miRNA 抑制轉譯作用的起始 (initiation);同時也有學者發現,miRNA 抑制的是正在轉譯的核糖體 (post-initiation repression)。
miRNA 的作用途徑
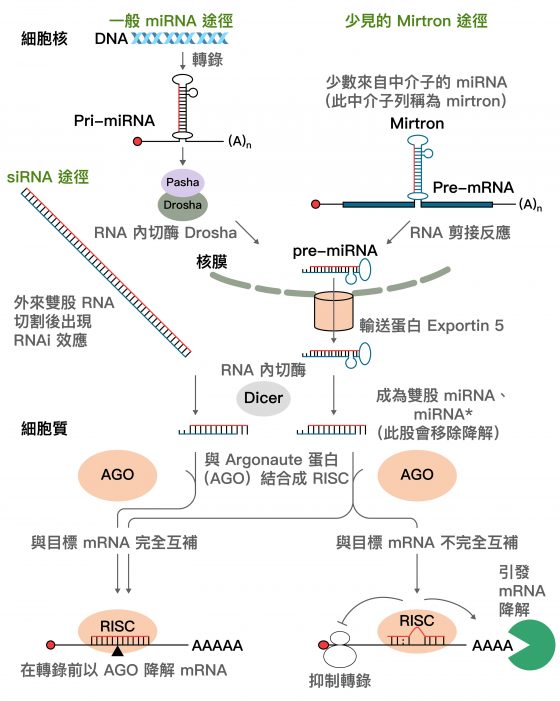
【miRNA 和 siRNA 的生成與作用】
一般路徑 (圖片由上至下):
1. DNA 與 RNA 聚合酶轉錄出上百至上千核苷酸長的 Pri-miRNA,透過 Drosha 切割為 60~70 核苷酸長的 pre-miRNA。
2. pre-miRNA 經過輸送蛋白 Exportin-5 進入細胞質,由 Dicer 切割為約 22 核苷酸長度的 miRNA 和互補股 miRNA* (將被移除降解的一股)。
3. miRNA 和 AGO 蛋白結合成 RISC ,尋找並結合目標 mRNA。完美結合就可以迅速切斷、降解 mRNA。結合不完全,形成突起 (bulge) 的話,就會抑制核糖體轉錄功能,進而由來自 RISC 的去腺嘧啶酶 (deadenylase) 複合物降解 mRNA。
—–
較少見的 Mirtron 路徑 (圖片右上至右下):
1. 來自中介子 (intron) 的 miRNA 序列,不經過 Drosha,而是由 RNA 剪接反應形成 pre-miRNA。此後的步驟與一般路徑相同。
—–
siRNA 路徑 (圖片左側至左下):
1. 外來雙股 DNA 進入細胞質,由 Dicer 切割為數十核苷酸長度的雙股 RNA 。
2. 其中一股與 AGO 等蛋白組成 RISC,可以和目標 mRNA 完美結合,並將其切斷降解。
如上圖所示,miRNA 的生成包含兩種核醣核酸內切酶: Drosha 與 Dicer ,接著和 Argonaute 蛋白質組成「核醣核酸沉默複合體」 (RNA-induced silencing complex, RISC) 抑制 mRNA 的轉譯作用或促使其降解。siRNA 則來自生物體外的長段 DNA,經 Dicer 切割而來,siRNA 亦可組成 RISC 引發目標 mRNA 降解。
詹世鵬在博士後研究中,就發現線蟲的 let-7 miRNA 形成的核醣核酸─蛋白複合體具有序列特異性,某幾種蛋白質僅與 let-7 miRNA 的特定序列結合,顯示 miRNA 形成 RISC 的特異性與多樣性。
此外,當 mRNA 的轉譯作用被 miRNA 抑制後,來自 RISC 的去腺嘧啶酶 (deadenylase) 複合物會進一步引發 mRNA 降解 (degradation)。因此在 miRNA 作用時,可以觀察到蛋白質合成被抑制,也可以發現到 mRNA 減少。然而,不同 miRNA 引發 mRNA 減少的幅度與速率,也在各種研究中都出現差異。
詹世鵬說,因為這些特點,miRNA 很可能因為「序列差異」,以及不同的「輔助蛋白分子」組合, 決定目標 mRNA 的命運。他在研究中發現,核糖體上的特定蛋白質會影響 let-7 miRNA 功能,該蛋白質所在的核糖體區域很可能是 miRNA 發揮抑制作用之處。
至今,詹世鵬仍然常常做實驗到三更半夜,致力將這些複雜且精微的反應,研究地更加透徹;為的是好奇心,也為了有朝一日能立基於這些知識發展醫藥應用。這樣的他,是怎麼踏上研究之路的呢?
踏入實驗室的契機

與實驗室一門之隔的辦公室中,詹世鵬檢查著待送檢的基因序列,一面回憶 33 年前加入第二屆「北區高中生物學習成就優異學生輔導實驗計畫」,從最基礎的生物學實驗雜務開始,踏上今天在臺大醫學院的分子生物學研究之路。「高一時,隔週日去中研院,上午聽課、下午做實驗,這樣的假日很棒!」詹世鵬回想。
但當時離開實驗計畫的同學,不是因為沒興趣做研究或想要玩樂,是因為他們去準備考醫學系了。
少年詹世鵬參與的是今日中研院「高中生命科學資優生培育計畫」之前身,當時由植物所協同動物所主持。由實驗計畫改組為今日的規模,共有 80 多位研究員參與指導,超過 2000 名高中生得以接受優秀的生物學家當面傳道解惑。而 30 多年來,能夠全程參與培育計畫的高中生大約是十分之一。
因為參與計畫,詹世鵬得到諾貝爾獎得主 Sanger 之門生──周德源博士、水稻基因定序計畫共同主持人──鄔宏潘博士指導。度過三分之一世紀,他還依稀記得師長們的風格,他笑著坦承:「上課內容當然已經忘了,有些老師也僅記得面貌。印象中有位老師很豪邁、有江湖味,但是名字卻遺失在腦海裡。」
Q:研究基礎生物學,有得到家人的支持嗎?
我當年成績也可以考上醫學系,但我用輔導實驗計畫的資格,甄選進臺大植物系。這算是比較非主流的選擇,我爸就在潮州老家跟鄰居埋怨我:「醫生不當,跑去讀個種花種草的科系。」當年輔導實驗計畫第一名的同學,最後的確是成為醫師了。
Q:在鄭淑珍院士門下學習將近十年,印象最深刻的是什麼事情?
鄭老師很嚴謹,不接受任何實驗沒有控制組的圖;會仔細確認每個學生的實驗結果能否重複再現,同時記得所有學生實驗的細節。這種治學風格下,每張實驗圖表都要重複操作改進,累積相當紮實的技術與研究成果。我的博論口試花了三個小時,愈講聽眾愈多,很多其他實驗室的學生中途加入。
鄭老師很重視學生的成長,希望我這種「土博士」能出國磨練。而且不會因為我們很熟,就幫學生打理各種推薦門路,她希望我們培養一切自理的能力。
Q:是否也在自己的實驗室中,再現了鄭老師的風格?
我從鄭老師那邊繼承的,大概就是經常和學生說:「實驗,沒有什麼到時候再做。」平常我們相處很輕鬆、沒有禁忌。但是我不接受學生對實驗說:「做到這樣就好了」、「到時候再做」、「如果要做的話…」這類不踏實的話。
我常和他們說:「做實驗,要就現在。沒有什麼到時候!」
Q:相對於其他職業,研究工作的特點是什麼?
做研究的好處,就是時間可以自理。有自由與資源可以去探索自己好奇的事情,這樣非常棒。當然,每個人的屬性不同,有些人的性格適合坐下來追根究柢;有些人比較坐不住,就未必能享受研究工作。像我是每天在實驗室跑膠也十分快樂的那種人。
Q:對有志於投入生物學研究的學生,有什麼建議?
生物學工作當然也有現實面的壓力。我這個世代和職位的學者,也常會被上級或長輩認為「還不夠努力」或「不夠聰明」,論文發表數或研究成果不盡理想。但是真的想求知、想滿足好奇心的學生,我想他們不需要尋求建議,就趕快開始動手,馬上設法做實驗吧!
Q:研究基礎科學,設定研究問題時是否該回應特定的「社會需求」呢?
啊,非常難回答的問題。(從地板掃視到天花板,苦思)
從歷史的角度看,生物學的起點其實是依附在帝國主義與殖民活動之下的博物學工作。當時的生物學家目的很明確,就是為歐洲強權搜集海外珍禽異獸、奇花怪木、甚至是異國人類,作為展示或娛樂之用。
現代基礎生物學相對以「求知」為導向,不像過往為了帝國貴族或殖民商人的喜好而做。這樣看來,我會說不必為了任何人的目的,而純為求知而假設研究題目比較好。
不過我在國立大學工作,而且國內大多數研究經費來源都來自政府,確實是奠基在公共資源上進行研究。當然必須要考慮「回饋社會」,但哪一群人的需求可以代表「社會需求」?或是說生物學家應該優先在意誰的需求呢?這是每個學者自己必須拿捏的。
對我來說,在基礎科學領域,以自己的知識與好奇心出發,進行實驗設計就好。但是基礎科學研究者在挑選主題、進行實驗時,心中抱持著「以研究成果回饋社會」的期待與信念是非常重要、而且必要的。要放在心裡的是,違背科學倫理、甚至虛假的實驗就遠低於這個基本要求。
延伸閱讀:
- 詹世鵬的個人網頁
- 詹世鵬,2010。〈小兵立大功─ 微小核醣核酸與小干擾核醣核酸〉,《化學》,68 (4),303 – 312。
- 陳俊宏、鄭竹雅,2014。〈不「容」小覷的隱藏角色——微核醣核苷酸〉,《科學發展》,498,40-45。
- Chan, S.P., Kao, D.I., Tsai, W.Y., and Cheng, S.C. (2003). The Prp19p-associated complex in spliceosome activation. Science 302, 279-282.
- Chan, S.P., and Cheng, S.C. (2005). The Prp19-associated complex is required for specifying interactions of U5 and U6 with pre-mRNA during spliceosome activation. J Biol Chem 280, 31190-31199.
- Chan, S.P., Ramaswamy, G., Choi, E.Y., and Slack, F.J. (2008). Identification of specific let-7 microRNA binding complexes in Caenorhabditis elegans. RNA 14, 2104-2114.
- Chan, S.P., and Slack, F.J. (2009) Ribosomal protein RPS-14 modulates let-7 function in Caenorhabditis elegans. Dev Biol 334, 152-60.
- Gan, J., Qu, Y., Li, J., Zhao, F., & Mu, D. (2015). An evaluation of the links between microRNA, autophagy, and epilepsy. Reviews in the neurosciences, 26(2), 225-237.
本著作由研之有物製作,原文為《從「高中生」到「分子生物學家」 專訪詹世鵬》以創用CC 姓名標示–非商業性–禁止改作 4.0 國際 授權條款釋出。
本文轉載自中央研究院研之有物,泛科學為宣傳推廣執行單位
在網站上看不過癮?研之有物出書啦!
《研之有物:穿越古今!中研院的25堂人文公開課》等著你來認識更多中研院精彩的研究。




















《運動基因》立體封面72dpi.jpg)