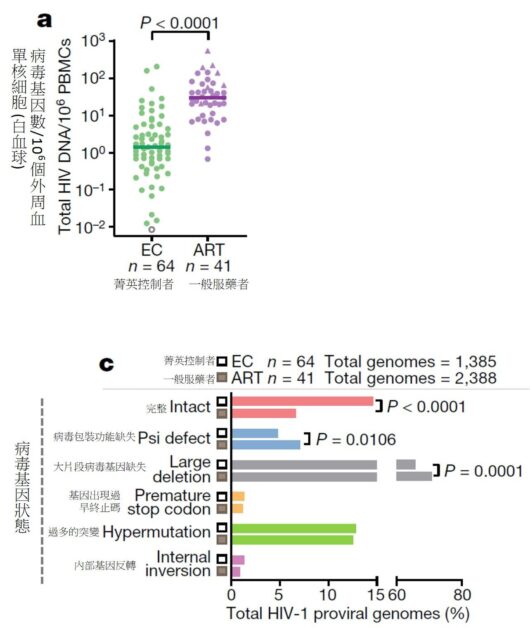
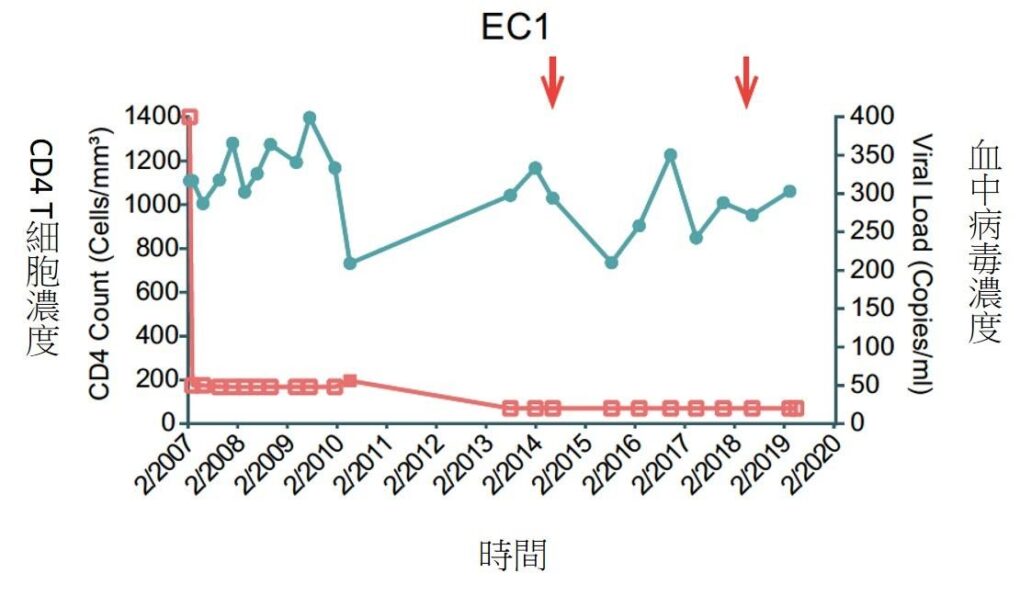
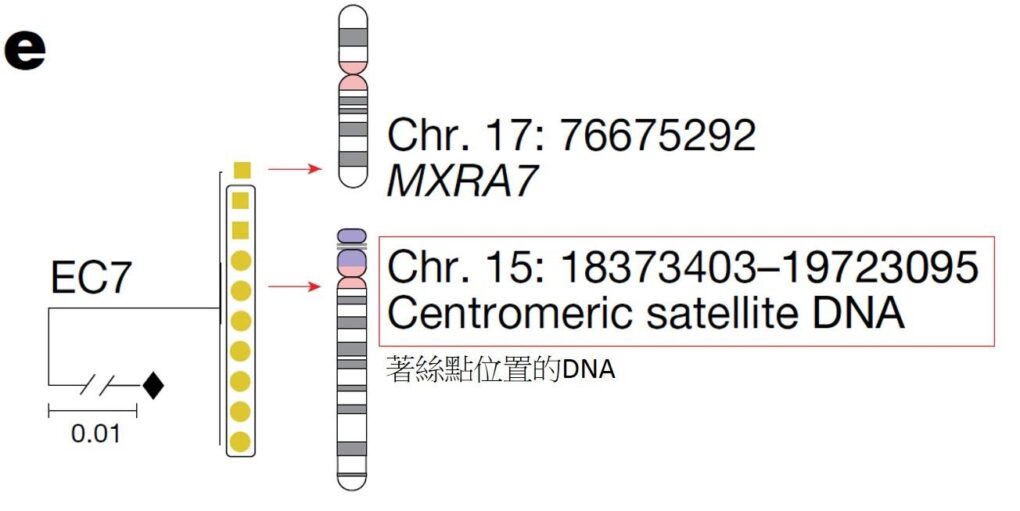
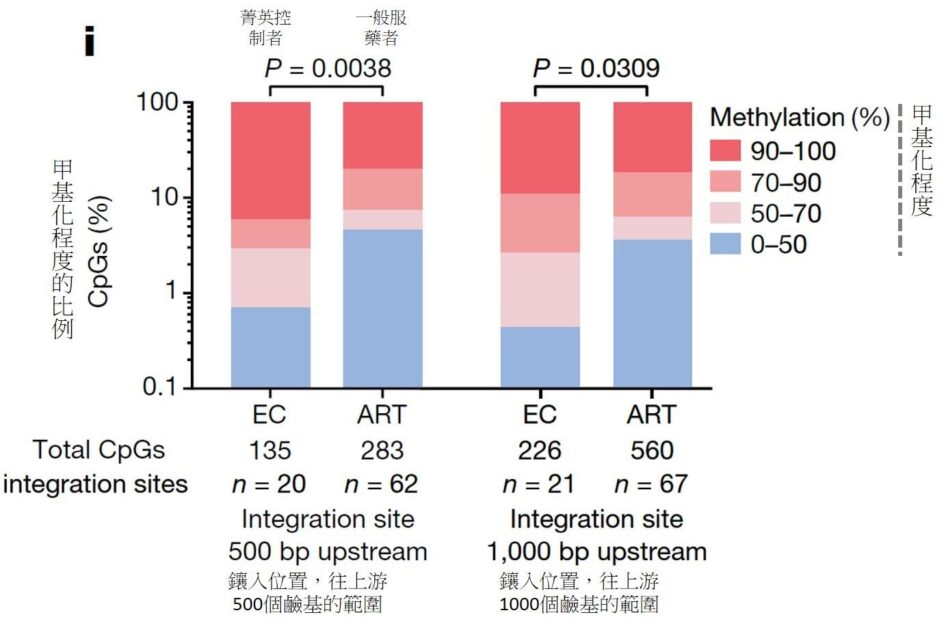
文/陳弘之|台大醫學系四年級

1911年,洛克菲勒醫學研究所(洛克菲勒大學前身)的裴頓.勞斯(Peyton Rous)教授發表了一篇論文,帶給了生醫界一個新的想法:
病毒感染有可能導致癌細胞生長。
根據論文的實驗方法,勞斯教授取出了母雞的胸部癌細胞,並經研磨、離心和過慮後,將濾液注入健康的母雞體內,發現實驗的母雞有很高的比例都誘發癌細胞的生長;又因為實驗使用過濾器材的孔徑比細菌還小,所以癌症的誘發可能是經由濾過性病毒傳染。

但勞斯教授的論文當時並沒有立即在學界引起廣大的迴響,一直要到 1960 年代,科學家才終於發現和鼠類乳癌與白血病(血癌)息息相關的 RNA 病毒。特定品系的實驗鼠有很高的比例會罹患相同的癌症,而且還能在電子顯微鏡中觀察到 RNA 病毒從癌細胞表面出芽生長;很顯然的,這種 RNA 病毒會經由垂直傳染,而致癌因子在不妨礙細胞基本機能的情況下由親代傳給子代,如此造就了高比例的同品系實驗鼠產生相同的癌症。
但究竟癌症傳染的機制為何?致癌的機轉又是怎麼一回事?是否了解了致癌的病毒就可以一勞永逸地治療癌症?本文將帶領讀者看看科學家們是如何一步一步的回答這些問題。
反轉錄病毒的發現
既然先前觀察到從癌細胞表面出芽生長的是以 RNA 為遺傳因子的病毒,很直觀的就會認定造成垂直遺傳的致癌因子就是該病毒的 RNA,但科學家發現這種 RNA 病毒的生活史當中存在著合成的病毒 DNA,那麼致癌的因子到底是病毒的 RNA 還是 DNA,就需要進一步的驗證了。

威斯康辛大學的霍華德.特明(Howard Temin)教授提出了一個可能:
- 這種 RNA 病毒會先以 RNA 為模板合成互補的 DNA 序列
- 合成的病毒 DNA 會嵌入宿主的 DNA 中
- 嵌入後的病毒 DNA 成為 RNA 合成的模板並進行病毒複製
雖然看起來合理,但這樣的假說在當時面臨一個很大的問題:「以 RNA 作為模板合成 DNA」在整個生物界中是前所未聞,也和弗朗西斯.克里克(Francis Crick)所提出的細胞中心假說(central dogma/遺傳訊息是由 DNA 到 RNA 到蛋白質)相違背,更重要的是具有「以 RNA 為模板的 DNA 合成酶」從來就沒有被發現過!
但就在 1970 年,麻省理工學院的戴維.巴爾的摩(David Baltimore)教授發現了催化「以 RNA 作為模板合成 DNA」的酵素。
巴爾的摩教授選擇鼠類白血球增生性腫瘤病毒(Rauscher mouse leukemia virus/R-MLV)與勞斯肉瘤病毒(Rous sarcoma virus/RSV)兩種 RNA 病毒來做實驗,他將病毒株純化並加入鎂離子、氯化鈉、二硫蘇糖醇(dithiothreitol/可避免酵素中的硫醇根氧化)和去氧核苷三磷酸(dNTP/其中 dTTP有做放射線標定)創造出有利於 DNA 合成的培養環境,結果產生了分子量大且具有放射性的 DNA 產物。

為了證實該DNA的合成是源自於病毒的 RNA,巴爾的摩教授又更進一步做了兩組對照的實驗:
- ※已知僅 RNA 會被胰核糖胰核酸酶(pancreatic ribonuclease)破壞,DNA 則否
1-1一般病毒培養進行 DNA 合成做為實驗對照組
1-2病毒培養的環境中加入胰核糖核酸酶
2-1靜置純化過的病毒株 20 分鐘再進行DNA合成反應
2-2預先用胰核糖核酸酶處理純化的病毒 20 分鐘再進行DNA合成反應
經過與對照組 1-1 產率的比較後發現,1-2 在加入胰核糖核酸酶會使得 DNA 產物下降,2-2 預先用胰核糖核酸酶處理的病毒株其DNA 產率更低,2-1 單純靜置 20 分鐘後則還有相當的產率。
此實驗結果證成了「以 RNA 作為模板合成 DNA」的假說,而這種僅在特殊 RNA 病毒上發現的「以 RNA 為模板的 DNA 合成酶」後來被稱作反轉錄酶;反轉錄病毒在將 RNA 反轉錄成 DNA 後,病毒的 DNA 會嵌入宿主的DNA,經由轉錄、轉譯合成病毒的蛋白質,使得宿主細胞病變(例如癌化),也因為病毒帶有的致癌基因在感染後已成為宿主 DNA 的一部份,所以當生殖細胞也受到病毒感染時,減數分裂後的配子也就理所當然的帶有病毒的致癌基因,造成癌症的垂直傳染。
Src 基因的發現
了解了病毒如何將致癌基因帶給宿主後,科學家的下一個目標就是要研究到底反轉錄病毒中的哪一段基因具有致癌性。1970年代,某些突變後的致癌性反轉錄病毒被發現,這種突變的反轉錄病毒雖然可以感染宿主,卻沒有致癌能力,顯示致癌與否的關鍵就存在於變種與原病毒株之間的基因體差異。
加州大學舊金山分校的哈羅德.瓦慕斯(Harold Varmus)、米高.畢曉普(J.Michael Bishop)和多明尼克.施特赫林(Dominique Stehelin)教授設計了以下的實驗,用鳥類白血病性肉瘤性病毒(avian leukosis-sarcoma virus)找出了一種致癌基因 src(命名由來為肉瘤 sarcoma):
- 分離出基因突變後不具致癌性的反轉錄病毒並取其 RNA,經基因分析和比對,發現其亡失了10-20%的基因體。
- 取出原病毒株的完整 RNA,在反轉錄酶的催化下合成單股的互補 DNA(cDNA),並用放射線標定 DNA產物。
- 將突變病毒的 RNA 與具有放射性的 cDNA 進行鹼基配對,沒有 RNA 配對的 cDNA 為突變病毒亡失的基因體,含有致癌基因。
- 用管柱層析法分離出帶有致癌基因的 cDNA,並命名為 cDNAsrc。
從病毒中找到 cDNAsrc之後,科學家又有了新的發現:原來在許多種健康的鳥類(包括:雞、火雞、鵪鶉、鴨和鴯鶓)細胞當中也可以找到和 cDNAsrc 鹼基互補的 DNA 序列,這表示反轉錄病毒所帶的致癌基因,很有可能是鳥類原有的 DNA 序列,只是在反轉錄病毒的生活史中,和嵌入的病毒 DNA 一同被轉錄,並且成為新的病毒基因體的一部分,而帶有 src 基因的病毒在感染後可以促使宿主細胞大量分裂(癌化)所以在演化過程中被保留了下來。

但更驚人的還在後頭,科學家接著發現源來不只是鳥類,所有脊索動物門的動物細胞內都能找到和 cDNAsrc 互補的 DNA 序列!既然 src 基因存在於所有的脊索動物,則其必然具備某種重要的細胞生理機能。所以科學家接著所要解決的問題是:
- Src 基因所轉譯的蛋白質具有什麼細胞機能?
- 嵌入病毒src基因(v-src)後的宿主細胞究竟產生了怎樣的病變?
Src基因的細胞生理機能
科羅拉多大學的雷蒙.艾瑞克森(Raymond Erikson)教授率先找出 src 基因的功能。
他從感染勞斯肉瘤病毒(RSV)的實驗動物中萃取出專一的抗體,並使用免疫沉澱法分離出 src 基因轉譯出的蛋白質,經過分析,這種蛋白質的分子量約為 60,000 道爾頓,故稱之為 pp60src;又將受感染的動物細胞進行固定和組織切片後,再用鐵蛋白(ferritin)標定與 pp60src 結合的抗體,發現 pp60src 皆附著於細胞膜的內側面,尤其集中在細胞的隙型連結(gap junction)。
艾瑞克森教授接著將 pp60src 與抗體的複合物加入含有 [32P]ATP 的培養液中,放置一段時間後,發現 ATP 上帶有放射性的磷酸根被轉移到與 pp60src 複合的抗體的重鏈(heavy chain)上,顯然 pp60src 具有催化蛋白質磷酸化的功能,而這也是科學家第一次了解到致癌基因的致病機轉:
細胞生理的控制很大一部分倚靠著蛋白質的磷酸化/去磷酸化,如 pp60src 在接受到細胞外的分子訊息後活化,磷酸化下游蛋白質,下游蛋白質再進行一連串的訊息傳遞與放大,最後活化轉錄因子,產生蛋白質並改變細胞生理狀態;當磷酸化/去磷酸化沒有受到精準的調控,細胞內複雜的代謝途徑就會受到影響,若其中牽涉到細胞生長的訊息傳遞途徑,就可能造成細胞不正常的增生,也就是細胞的癌化。
Src 基因的磷酸化功能雖有重要的生理意義,但在之前學界中都沒有被發現,這是因為不同於一般的磷酸化酵素會作用在蛋白質序列中的絲胺酸(Serine)和蘇胺酸(Threonine)上,pp60src則是將磷酸根轉移到酪胺酸(Tyrosine)上,而細胞中磷酸化絲胺酸(phosphorylated serine)和磷酸化蘇胺酸(phosphorylated threonine)的數量大概是磷酸化酪胺酸(phosphorylated tyrosine)的3,000 倍,所以早期並沒有發現酪胺酸磷酸酶的存在。
經過比較後發現,受到勞斯肉瘤病毒感染的動物其癌細胞內磷酸化酪胺酸的數量約為一般動物細胞的 8 倍,是 v-src 的高度磷酸化表現造就了宿主細胞的不正常增生。
核苷酸序列的改變―另一種致癌的機制

正當科學家們高興找到的 src 的致癌機轉,以為克服了癌症的難關,麻省理工學院的羅伯特.溫伯格(Robert Weinberg)教授提出另一種不同於病毒感染的致癌機制:
核苷酸序列的改變會活化致癌基因並造成細胞癌化。
其實實驗過程簡單整理如下:
- 用 3-MC、BP 等致癌化學物使得實驗鼠細胞癌化,產生15種不同的細胞株(cell line)
- 萃取出不同細胞株的 DNA 並轉染纖維母細胞(fibroblast/NIH3T3)
- 觀察轉染後的 NIH3T3 是否有癌化的徵兆,產生凝塊(clump)
- 萃取一般動物細胞 DNA 作為對照組,轉染 NIH3T3 觀察是否造成細胞癌化
結果在 15 種細胞株當中,有 5 種萃取出的 DNA 在轉染後會造成 NIH3T3 的癌化,而一般動物細胞則沒有造成癌化的能力,顯然一開始的化學分子操作改變了細胞的 DNA 序列,並使之擁有造成其他細胞癌化的能力:
病毒感染不再是唯一的致癌途徑。
在 1981 年,科學家改採用人類的癌細胞進行相同的實驗,在 26 種膀胱癌(bladder carcinoma)細胞株當中,有兩種萃取出的DNA(EJ和J82)具有使細胞癌化的能力,再經過一番研究,EJ 和 J82 的細胞株當中並不含病毒嵌入的 DNA 序列,可見人類本身的DNA當中就存有某種致癌基因,當該基因被(不正常)活化的時候,便會造成細胞的癌化。
於是科學家的目光開始聚焦在找出人類 DNA 序列中的致癌基因,很快的在 1982 年就從 EJ 和 J82 中分離出具有致癌能力的 DNA 片段,而經過 DNA 比對,該序列和哈威肉瘤病毒(Harvey sarcoma virus)所帶有的致癌基因(ras)基本上是一致的(儀器檢測不出差異);科學家便推測:
人類的 ras 基因在某種機制的活化(突變)後,或許和哈威肉瘤病毒造成的癌化有相同的致病機轉。
在同年年底,科學家分析膀胱癌細胞突變後的ras基因的核苷酸序列後發現,ras 的突變僅僅是由於單一的鹼基置換:
序列中有固定一個鳥嘌呤(Guanine)被換成了胸腺嘧啶(Thymidine),而該點突變改變了密碼子的遺傳訊息,使得原本 ras 蛋白質上的甘胺酸(Glycine)被纈胺酸(Valine)取代。
這又與哈威肉瘤病毒所帶有的 ras 基因有相同的特徵:
受病毒感染的細胞轉譯出的 ras 蛋白質當中的同樣一個甘胺酸,被精胺酸(Arginine)取代,顯然此甘胺酸對於 ras 蛋白質的構形與功能有重大的影響。
更有甚者,由於哈威肉瘤病毒感染後會導致鼠類的肉瘤(sarcoma/癌細胞起源於軟組織)與白血病(leukemia/癌細胞起源於骨髓),與膀胱癌(carcinoma/癌細胞起源於上皮組織)的癌症分類並不同,這是因為 ras 屬於小分子量 GTP 水解酶(small GTPase/ small G protein),調控著細胞內的蛋白質訊息活化,所以當 ras 被大量轉譯容易造成細胞癌化,而 ras 也是科學家首次發現會造成不同種類癌症的單一基因突變。
為了攻克癌症這個難題

為了攻克癌症這個難解的疾病,科學家們從癌症的起源著手,發現了有致癌性的反轉錄病毒,之後又了解到許多致癌基因本來就存在於人類的 DNA,像 src 和 ras,所以又將它們稱做原致癌基因(proto-oncogene),當不正常表現時會造成細胞的癌化。
但癌症的發生機轉非常複雜,每當科學家找出一種致癌途徑卻總發現沒能窮盡所有可能,於是即使研究向前了一步也不得停下追尋答案的腳步,也是在研究癌症的過程中,漸漸拼湊出細胞內各種訊息活化的途徑,當我們現在看著一張張清楚的細胞機制圖時,可別忘了科學家們努力不懈的斑斑足跡啊!
- 翻譯並改寫自 Cell Biology, Gerald Karp 7th edition P.694-697 The Discovery of Oncogenes
- 本篇文章已取得授權編譯,若有疑慮或是希望取得授權請聯絡Wiley Press。
- 本書亦有中文版本:細胞生物學-結合了理論與實驗,帶您一窺生命的奈米世界,合記圖書出版社。