藏在哪裡?將近四十年來,伊波拉病毒儲存宿主的身分,始終是傳染病界最隱密的小謎團。這個謎團,連同投入解謎的努力,都可以追溯至一九七六年首次確認伊波拉病毒症浮現之時。那一年病毒在非洲兩度爆發,彼此獨立,不過幾乎同時出現:一次在薩伊(如今稱為剛果民主共和國)的北部,一次在蘇丹西南部(位於如今南蘇丹共和國境內一區),兩場爆發相隔三百英里。儘管蘇丹的疫情開始得稍早,薩伊事件卻比較著名,部分是由於那裡有一條小水道,稱為伊波拉河(Ebola River),最後那種病毒就以此命名。

薩伊爆發事件的聚焦點是一所小型天主教會醫院,院址設於本巴區 (Bumba Zone)地帶一處名叫 揚布庫(Yambuku)的村落裡面。九月中,那裡的一位薩伊醫師通報了二十四起案例,患者都罹患了一 種引人矚目的新型疾病—那並不是普通瘧疾,它比瘧疾更恐怖、更血腥,典型特徵為血性嘔吐、流鼻 血和血性腹瀉。那位醫師拍電報向薩伊首都金夏沙(Kinshasa)當局示警時,患者群中已經有十四位死亡,其他人也岌岌可危。到了十月初,揚布庫教會醫院已經關閉,理由很悽慘,因為院內人員大半都死了。
幾個星期之後,世界各國的科學家和醫師因應情勢組織起來,遵照薩伊衛生部指示來到這裡會師,針對這種未知疾病進行一次緊急研究,並就疾病管控提出建言。這支應變團隊的成員分別來自法國、比利時、加拿大、薩伊、南非和美國,其中九位來自亞特蘭大的疾病控制與預防中心,後來這支團隊就稱為國際委員會(International Commission)。他們的領導人是卡爾.約翰遜,也就是當初一九六三年在玻利維亞處理馬丘波病毒事件的那位美國醫師暨病毒學家。那時他自己也染上了那種疾病,險些喪失性命。十三年後,他當上了疾病控制與預防中心特殊病原體部(Special Pathogens Branch)的負責人,卻熱情依舊,仍然致力奉獻,那次瀕死經驗或者攀登專業顛峰一點也沒讓他變得圓滑世故。

約翰遜應付馬丘波事件時,把焦點集中在生態面向,協助解除了那場危機。他關注的是,病毒沒有出手殺害玻利維亞村民時都待在哪裡?就那次的事例,儲存宿主的問題有跡可尋,答案也很快就找到了:有種本地小鼠把馬丘波病毒帶進人類的住所和糧倉。靠著陷阱捕捉滅除小鼠,有效終止了那場爆發。如今進入了一九七六年十月和十一月那段絕望、惶惑的時期,約翰遜在薩伊北部遇上了另一種不知名的隱形殺手,這時死亡數字攀升到好幾百人,他和同行的研究人員抽出時間來揣摩伊波拉病毒的狀況,就如同當初他針對馬丘波病毒探究的問題:這個東西是從哪裡來的?
當時他們已經知道,薩伊病原體是種病毒。這項認識歸功於海外各實驗室(包括疾病控制與預防中心)收到臨床樣本之後,迅速完成作業,分離出病毒。(約翰遜飛往薩伊之前,便親自領導疾病控制與預防中心進行分離作業。)他們知道,這種病毒很像馬堡病毒,那是九年之前業已確認的另一種致命病原體;電子顯微圖像顯示,它同樣呈絲狀扭曲構造,像一條痛苦至極的絛蟲。不過實驗室檢測也披露伊波拉病毒和馬堡病毒明顯不同,足以判定這是種新的類型。到最後這兩種蠕蟲狀病毒,伊波拉和馬堡病毒,都經判歸新的一科:線狀病毒科。

約翰遜的團隊還知道,那種新的病原體(伊波拉病毒)必須寄宿在某種人類以外的活動物體內,它在那裡生活時,比較不會造成破壞,能長久存續下來。不過就他來講,儲存宿主是誰的問題,還不如其他要項那般急迫,好比如何截斷人傳人感染通路、如何保住患者的生命,還有如何遏止爆發情勢等。後來團隊的報告指出,「生態調查做得相當有限,」而且調查結果也全都是否定的。伊波拉病毒只出現在人類身上,其他完全無跡可尋。
不過事後回顧,反面的資料卻很有趣,起碼記錄了早期研究人員檢視了哪些地方。他們從遭受伊波拉感染的村莊採集了八百一十八隻臭蟲,搗成蟲漿,完全沒有找到絲毫病毒證據。他們研究過蚊子,什麼都沒有。他們從十隻豬和一頭牛身上抽血—全部證實沒有伊波拉病毒。他們抓了一百二十三隻齧齒類動物,包括六十九隻小鼠、三十隻大鼠和八隻松鼠,沒有一隻是病毒帶原者。他們還檢視了六隻猴子、兩隻遁羚和七隻蝙蝠的內臟,這些動物也都是清白的。國際委員會的成員見此都更為審慎了。
「過去三十年來,全世界從來不曾出現這麼富戲劇性,或者這麼可能爆發疫情的新型病毒性急症,」
他們在報告中提出警告。文中指出,病案致死率高達八八%,這是除狂犬病之外的最高紀錄。(狂犬病患者若是沒有在症狀出現之前予以治療,死亡率幾達百分之百)。委員會向薩伊官方提出六點緊急建言,其中包括地方層級的保健措施和全國性的偵測監控。不過裡面並沒有提到伊波拉病毒的儲存宿主是誰,那屬於科學事務,比起向莫布杜總統(President Mobutu)的政府提出的行動事項稍微抽象了一些,所以還得再等等。
結果一直等到現在。
揚布庫事件過後三年,約翰遜和委員會的其他幾位成員,依然在揣摩儲存宿主問題。他們決定再試一次。由於欠缺資金,無力籌組專門尋找伊波拉藏身處的探勘行動,於是他們決定搭便車,掛在世界衛生組織負責協調的薩伊猴痘長期研究計畫底下進行。猴痘是種重症,雖然並不像伊波拉病毒症那麼搶眼,不過也是由潛伏在(當時依然尚未確認的)單一或多種儲存宿主身上的病毒引發的病症。因此這樣結合起來進行研究,似乎很自然,也很經濟,他們可以動用兩套分析工具,來篩檢採集來的同一批檢體。這次田野小組同樣從本巴區各村落和周圍森林採集動物,此外也兼及薩伊北部和喀麥隆東南部的其他地區。
這次他們藉由陷阱、狩獵行動,還提供賞金鼓勵村民帶來活動物,最後總共獲得超過一千五百隻動物,分屬一百一十七個物種。收穫有猴子、大鼠、小鼠、蝙蝠、獴、松鼠、穿山甲、鼩鼱、豪豬、遁羚、鳥、陸龜和蛇。小組人員首先為每隻動物採集血液樣本,接著剪下小片肝、腎和脾。這所有樣本都分別裝進小瓶,超低溫冷凍,隨後便運回疾病控制與預防中心進行分析。樣本組織所含的活病毒,可不可能繼續滋長?血清中能檢測出伊波拉抗體嗎?約翰遜和協同作者在《傳染病期刊》( The Journal of Infectious Diseases)文章中坦承,最後結果是否定的:「沒有發現伊波拉病毒感染的證據」。
追捕伊波拉病毒儲存宿主之所以特別困難,又特別難以聚焦,其中一項因素就是,這種疾病在人類族群瞬息變化的特質。它有時會消失,接連多年不見蹤影。這對公共衛生來講相當幸運,對科學而言卻是種拘束。病毒生態學家可以前往任何地方,探進任何物種生物體內,深入非洲任何森林來尋找伊波拉,但是這些都是很大「大海」,要撈的病毒這根「針」卻又很小。就空間和時間來看,最有希望的搜尋目標是有人染上伊波拉病毒症、性命垂危的當地和當時。結果在一段很長的間歇時段,也沒有人因為那種疾病而瀕臨死亡—至少沒有哪個人的死亡事件引起醫療主管機關的注意。
一九七六年揚布庫爆發事件之後,接著在一九七七年和一九七九年間,薩伊和蘇丹又爆發了兩起小型疫情,隨後伊波拉病毒屬就銷聲匿跡十五年,期間非洲全境幾乎都不曾見到它們現身。回顧一九八○年代早期,當時說不定也零星出現了幾起病例,不過那只是種猜想,並沒有確認疫情,也沒有觸動緊急應變措施;在那幾次不嚴重的事例當中,感染鏈似乎都自行「耗竭」而消失了。這個概念和致命性很高而且具有中等接觸傳染強度的病原體特別有關。
病原體耗竭的意思是指,有一些人死亡,另有一些人受了感染,但其中少數死了,其他人則全都康復,而病原體也不再繼續蔓延。事態自行平息,於是世界衛生組織、疾病控制與預防中心和其他專家機構,也就不再需要召集特別行動小組。然後過了一段時期,它回來了—這次疫情發生在梅依波特二村和加彭其他地方,甚至還出現在一處更令人心驚的地方,那裡叫做基奎特(Kikwit)。
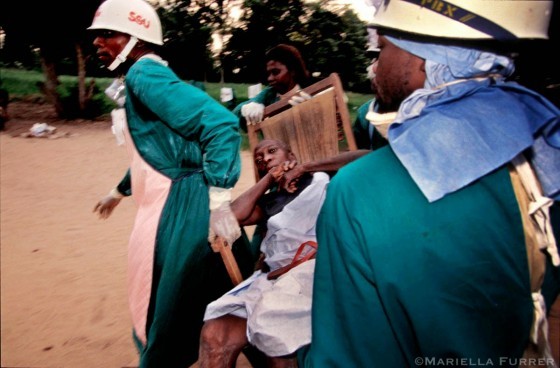
基奎特在薩伊境內,位於金夏沙以東約三百英里處。有別於揚布庫、梅依波特二村以及帛威鎮外的伐木場,有個非常重要的特點:那是一座擁有二十萬居民的城市。城裡有好幾所醫院,它和更廣大世界的聯繫程度,其他爆發地點都無法與之相提並論。不過基奎特四周同樣有森林環繞。基奎特爆發的第一起確診病例是一名四十二歲男子,他在林間或鄰近地區工作,對森林說不定也造成了小幅破壞。他清出幾片土地來從事農耕,種植玉米和木薯,還採集林木來燒製木炭,整個活動範圍位於城市東南五英里處。他如何取得木材原料?他怎樣為菜園引進日光?大概都是靠砍樹吧。這個人在一九九五年一月六日病倒,一週之後死於一種出血熱。
在那時候,他已經直接感染了至少三個家人,這些人全都因病喪生,還把這種傳染病散播到更廣的社交圈,其中有十個人在之後幾週死亡。他有些往來親朋顯然把病毒帶進了市內的婦產科醫院,感染了一位實驗室技師,接著又從那裡傳進了基奎特綜合醫院(Kikwit General Hospital)。那位技師在基奎特綜合醫院接受治療時,感染了好幾位幫他動手術的醫師和護理師(他們懷疑那是種傷寒性腸穿孔,因此切開他的腹部),還波及幫忙看護他的兩位義大利修女。技師死了,修女死了,地方官員設想這是流行性痢疾(epidemic dysentery),這次誤診造成病毒進一步在基奎特地區其他醫院的患者和醫務人員之間傳布。
有關痢疾的假設並不是所有人都能接受。衛生部一位醫師認為,那其實很像是種病毒性出血熱,暗指那是伊波拉。這個合理猜測不久就在五月九日確認,證據出自送往亞特蘭大亞疾病控制與預防中心的血液樣本。是的,沒錯:那是伊波拉病毒。到了八月,疫情進入尾聲,已經死了兩百四十五人,包括六十名醫務人員。一旦誤以為伊波拉病人患的是其他疾病(好比潰瘍引發的胃腸出血),為他施行腹部手術就是種非常危險的工作。
這時另一支國際團隊也出發搜尋儲存宿主,六月初來到基奎特城會合。團隊成員分別來自美國疾病控制與預防中心、薩伊一所大學和馬里蘭州的美國陸軍傳染病醫學研究院(US Army Medical Research Institute of Infectious Diseases, USAMRIID,先前為生物武器實驗室,如今專門從事疾病研究和生物防護,以下簡稱「陸軍傳染病研究院」),還有一位團員是丹麥害蟲侵害實驗室(Danish Pest Infestation Laboratory)研究員,這個人想必對齧齒類了解很深。
他們來到疑似溢出現場開始工作,這裡就是第一個受害者,那位四十二歲不幸男子的木炭坑和農田所在地,位於城市東南方。往後三個月間,他們在那處地點和其他位置設陷阱、架捕網,捉到了數千隻動物。其中多數屬於小型哺乳類和鳥類,加上幾隻爬蟲類和兩棲類動物。所有陷阱都設在市界之外的林間或熱帶草原區。就基奎特城內地區,團隊在一處聖心佈道所(Sacred Heart mission)用網子捕捉蝙蝠。他們把捕獲的動物逐一殺死、抽血,解剖取出脾臟(有時也取出肝、腎等其他器官),冷凍貯藏起來。他們還從狗、牛和寵物猴子身上採得血液樣本。
整個成果包括三○六六份血液樣本和二七三○件脾臟,全都運回美國疾病控制與預防中心進行分析。血液樣本先經輻射殺滅病毒,接著就使用當時最好的分子試驗法來進行伊波拉病毒抗體檢測。脾臟轉送到一處生物安全第四等級(BSL-4)實驗室,這是約翰遜早期工作時所建立的新型設施(他還列名這種設施的先驅設計師之林),裡面裝設有多重密封、負壓和精密的過濾裝置,而且實驗室人員工作時都身著太空服—形成一處密封防護隔間,人在裡面安全處理伊波拉病毒,無虞意外釋出(理論上)。沒有人知道,這批薩伊脾臟有沒有哪件含有病毒,為防萬一,全都當成有病毒來處理。實驗室人員取得脾臟原料,細密碾磨之後添進細胞培養液裡面,試行培養病毒。

沒有一個培養出病毒來。細胞培養基依然無憂無慮,看不出病毒滋長的斑點。抗體檢驗也沒有查出陽性反應。於是伊波拉病毒就這樣再次溢出,釀出軒然大波,接著消失不見。它只在一群病人和垂死患者體內現形,此外完全無跡可尋。它是蒙面客蘇洛,是沼澤之狐,是開膛手傑克—危險、來無影、去無蹤。
基奎特城這次為期三個月的大陣仗團隊努力,不該算是徹底失敗;一項研究設計得好,就算得出負面結果,往往都能縮小可能範疇,但畢竟還是多了一次落得失敗下場的艱苦嘗試。說不定基奎特團隊去得太晚,燒炭工生病之後隔五個月才來到現場。說不定從雨季轉變成乾季,導致儲存宿主(不論那是誰)遷往別處,或躲藏起來,或者族群數量減少。說不定病毒本身的數量減至最低,只殘留稀少族群,在這段淡季時節,就算寄宿儲存宿主體內,也無從偵測。基奎特團隊說不出所以然。最後他們還是寫出報告,裡面除了羅列不含伊波拉病毒的冗長動物清單之外,最值得注意的層面就是,內容清楚陳述當初引導他們這項研究的三項關鍵假設。
第一,他們(基於較早期研究)猜想,儲存宿主是種哺乳動物。第二,他們指出,伊波拉病毒症在非洲幾度爆發,總是與森林有連帶關係。(就連發生在基奎特的都市疫情,也是從市外林間的燒炭工開始。)因此似乎可以穩當假設,儲存宿主是住在森林的動物。第三,他們也指出,伊波拉病毒爆發事例都不定時零星出現—有時在兩起事件當中間隔了好幾年。這種間隙意味著,人類從儲存宿主染上疾病是種罕見的事例。接著溢出稀有性又暗示了兩種可能性:要麼儲存宿主本身就是種罕見的動物,不然就是那種動物很少和人類接觸。
除此之外,基奎特團隊就說不出什麼道理了。他們在一九九九年發表他們的論文(同伊波拉病毒完整系列報導一併刊載在《傳染病期刊》的一份特別增刊),以權威語調載明這次負面結論。過了二十三年,儲存宿主依然深藏不露。
本文摘自泛科學2016年2月選書《下一場人類大瘟疫》,漫遊者文化出版。