- 作者/照護線上編輯部
- 本文轉載自 Care Online 照護線上《瀰漫性大型B細胞淋巴癌完全緩解率提高有望! 突破性機轉治療問世:雙特異性抗體藥物&抗體複合體藥物全解析,專科醫師圖文懶人包》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接

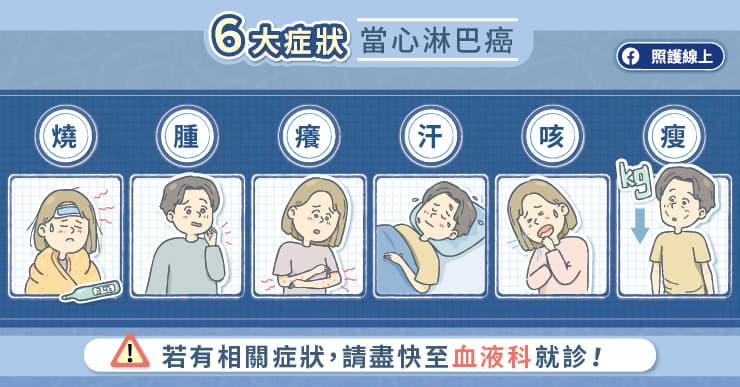
「有位七十多歲的瀰漫性大型 B 細胞淋巴癌(Diffuse large B-cell lymphoma,DLBCL)患者,接受第一線治療後一年多又復發,二線治療的效果也不佳。淋巴結腫大到壓迫靜脈,導致血液無法回流,兩隻腳腫得非常嚴重,偏偏當時患者的身體狀況又已無法承受更高強度的化療,情況十分不樂觀。」高雄醫學大學附設中和紀念醫院血液腫瘤內科蕭惠樺醫師回憶,「當時剛好有一款突破性機轉的新藥問世,與患者討論後決定試試,結果才打第一個療程,腫瘤就縮小一半,第二個療程後更是幾乎全消,很快速就將淋巴癌控制住!」

瀰漫性大型 B 細胞淋巴癌治療新利器:雙特異性抗體藥物扭轉復發命運
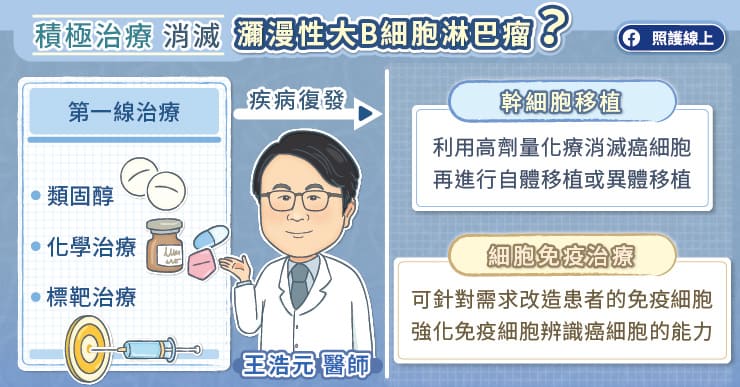
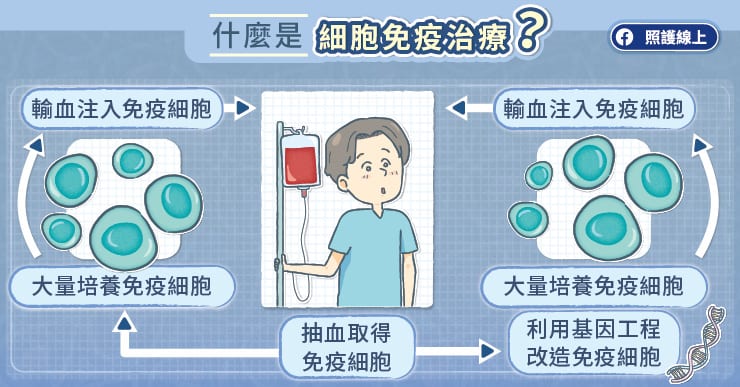
此款突破性機轉的新藥就是『雙特異性抗體藥物』 (Bispecific Antibody,BsAb)。蕭惠樺醫師表示,雙特異性抗體藥物是淋巴癌最新的治療利器,抗體能夠同時識別兩種抗原,一端能與免疫 T 細胞接合,另一端則能與病變的 B 細胞接合,藉此引導免疫 T 細胞直接攻擊病變 B 細胞,機轉十分創新。
雙特異性抗體藥物的出現,對瀰漫性大型 B 細胞淋巴癌治療極具意義。蕭惠樺醫師解釋,瀰漫性大型 B 細胞淋巴癌是源於淋巴球病變的惡性腫瘤,成人最常見的非何杰金氏淋巴癌,惡性度很高、病程進展快速,容易危及性命,許多患者確診時,就已經是第三期、第四期,必須盡快接受治療;而在第一線治療後,仍有四成多、近五成的患者,無法達成完全緩解或之後復發,且隨著治療越後線,緩解率越低,此時雙特異性抗體藥物就扮演扭轉命運的關鍵角色。

精準引導自身免疫 T 細胞打擊淋巴癌病變 提升完全緩解率達 2 倍!
為何雙特異性抗體藥物對復發或難治型瀰漫性大型 B 細胞淋巴癌會如此有效果呢?蕭惠樺醫師分析,首先是藥物設計,保持抗體專一性的同時,又能與兩個抗原分別結合,此為很具突破的想法和成果;再者是療效與副作用的平衡,藉由引導自身免疫T細胞攻擊病變淋巴癌細胞,除了讓毒殺更精準,大幅提升療效外,也不同於傳統化療好壞細胞皆殺,故可同時降低副作用,維持患者生活品質。
談到雙特異性抗體藥物的臨床試驗數據,蕭惠樺醫師指出,最引人注目、同時也是對患者最重要的預後指標–完全緩解率的大幅提升。根據臨床試驗顯示,在原本的 CD20 單株抗體與化學治療外,再加上雙特異性抗體藥物,可將復發瀰漫性大型 B 細胞淋巴癌的完全緩解率由 17.5% 提升到 40%,達兩倍以上,並顯著延長整體存活期。基於雙特異性抗體藥物對於復發或難治型瀰漫性大型 B 細胞淋巴癌展現的優異療效結果,蕭惠樺醫師也進一步分析,認為雙特異性抗體藥物未來有很高機會成為瀰漫性大型 B 細胞淋巴癌復發後的標準治療,也期盼可獲得我國健保給付,讓患者能在無經濟壓力下,接受最新的突破治療。

健保開放後線給付新選擇:抗體藥物複合體 ADC 精準毒殺淋巴癌
若患者有經濟上的考量,目前健保也已有開放給付另一款新機轉的選擇–抗體藥物複合體(antibody-drug conjugate, 簡稱 ADC 藥物)。蕭惠樺醫師表示,ADC 藥物是將單株抗體標靶與化療藥物結合,藉由抗體與淋巴癌細胞抗原接合,將化療藥物精準送達,直接毒殺淋巴癌細胞。這樣的機轉也能降低對正常細胞的影響,大幅減少患者不適。
根據研究,針對復發或難治型瀰漫性大型 B 細胞淋巴癌患者,加入 ADC 藥物的治療組合,能提升超過 2 倍的完全緩解機會,增加整體存活率近 3 倍。蕭惠樺醫師提醒,目前 ADC 治療已納入瀰漫性大型 B 細胞淋巴癌第三線健保給付,符合給付條件的患者,都有機會在醫師的協助下申請給付,病友們切記要多主動與醫師討論,把握用藥權益。
瀰漫性大型 B 細胞淋巴癌治療貼心小提醒
瀰漫性大型 B 細胞淋巴癌復發後,第二線化療的副作用通常比第一線強,較容易產生噁心、嘔吐、血球降低等副作用,肝與腎功能也可能受到影響。蕭惠樺醫師說,如果患者的年紀較大、身體狀況較差,便可能無法承受高強度的化療。如今,雙特異性抗體、抗體複合體 ADC 藥物等重大突破治療問世,逐漸打破以往治療與復發的困境,因此鼓勵病友切勿放棄希望,抱持正向積極的心態,避免治療空窗期,才能及早控制病情,迎向淋巴癌治癒之路。
- 本文轉載自 Care Online 照護線上《瀰漫性大型B細胞淋巴癌完全緩解率提高有望! 突破性機轉治療問世:雙特異性抗體藥物&抗體複合體藥物全解析,專科醫師圖文懶人包》,歡迎喜歡這篇文章的朋友訂閱支持 Care Online 喔
- 加入照護線上 LINE 官方帳號,健康資訊不漏接















-200x200.jpg)