- 本文轉載自科技大觀園,原文為《歲歲有今朝但年年不一樣?狡猾的流感病毒與它的疫苗——台灣疫苗推動協會榮譽理事長 李秉穎醫師 專訪》
- 作者 / 科技大觀園特約編輯|蔣維倫
你每年都有打流感疫苗嗎?幹嘛不作個「長效型」的流感疫苗呢?
各種流感病毒的困惑,就讓台大醫院小兒科醫師、暨台灣疫苗推動協會榮譽理事長 李秉穎醫師,來幫大家上一門「狡猾的流感病毒與它的疫苗」吧

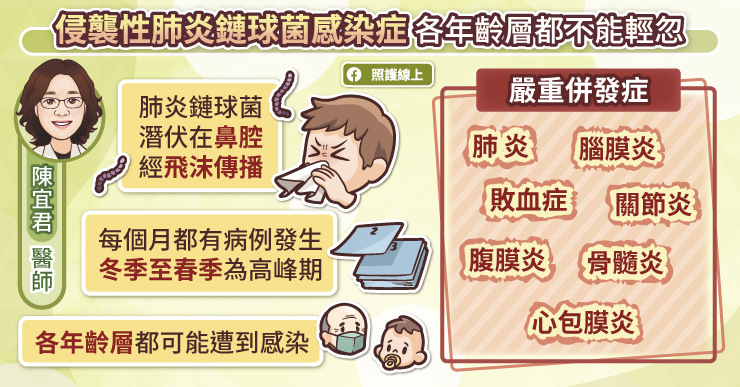
流感病毒感染細胞的關鍵蛋白-血凝素/HA
流感病毒長的像顆圓圓的球型水雷,而球體上的引信就是血凝素(hemagglutinin, HA)和神經氨酸酶(neuraminidase, NA)這兩種表面抗原;這兩個表面蛋白,可刺激人體白血球產生可以對付流感病毒抗體,換言之,它們是疫苗的最重要素材 。而流感病毒尚有其他蛋白質,如:M2離子通道蛋白等,可協助病毒釋出RNA等功能。
李秉穎醫師表示,在疫苗設計裡,科學家最關注血凝素/HA,因為它跟細胞表面的唾液酸受器(sialic acid receptors)結合,進而誘使細胞吞下病毒、感染細胞。換言之,流感病毒的血凝素/HA,如同新冠病毒/SARS-CoV-2的棘蛋白(spike protein),是感染細胞的鑰匙、同時也是製作疫苗的最佳素材。
因此,如果體內有充足的抗體可以咬住血凝素,病毒就無法接觸唾液酸受器,也就無法侵入細胞(此類能阻止病毒進入細胞的抗體,被稱為中和抗體)。所以流感疫苗所含的抗原,都至少有血凝素,試圖刺激白血球產生中和抗體 ;而在實驗室裡,預估每年新的季節性流感疫苗效力的方式,也用中和抗體效價進行評估。
為何每年都要打流感疫苗?
「主要原因是『流感病毒非常容易突變』,而且更麻煩的是,一旦變異、突破免疫系統後,『在脆弱族群裡容易引起重症』。」 李秉穎醫師這麼說道。
流感病毒是RNA病毒,生存策略是「不限制變異,盡可能產生基因多樣的子代」。所以它缺乏校正機制,突變的速度遠比其他病毒(如:水痘病毒)更加快速 。
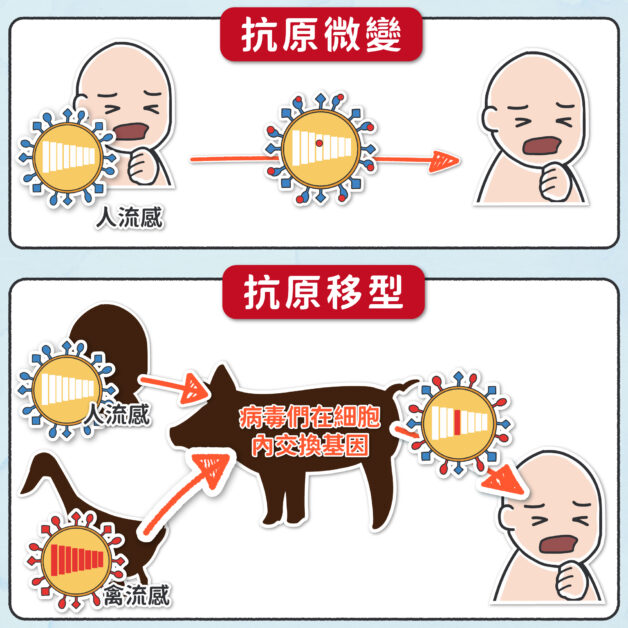
流感病毒在複製時,常出現微小的錯誤,有時會導致蛋白質的胺基酸產生改變,被稱為「抗原微變(antigenic drift)」。若變化發生在抗體所辨識的關鍵部位,就可能影響抗體辨認血凝素/HA,使疫苗誘發的保護力降低。
而有別於上述單點胺基酸的突變,另一種變異是巨大、劇烈地改變,被稱為「抗原移型(antigenic shift)」-不同流感病毒株、互換彼此 8 段 RNA 中的任意數段 RNA,產生巨大改變的新病毒、甚至獲得跨物種傳染的能力。如:2009年於墨西哥暴發的豬流感大流行,就是人流感和禽流感在同一個細胞裡發生了基因互換,進而產生了全新、極危險的流感病毒。
流感病毒的高突變速度,對人類有很大的威脅,不僅是非結構性病毒蛋白質的突變,可能會改變病毒對細胞的毒性,可能引起更多細胞凋亡、更劇烈的體內發炎等,對脆弱族群的殺傷性更增。而突變位置若在血凝素/HA等表面抗原,將使前一年的疫苗誘發的抗體難以辨認、保護力降低。
李醫師也提醒,像流感病毒的這種特性,對年長者等族群的威脅甚大。疫苗在銀髮族誘發的抗體濃度、效力本來就比青壯年低,而血清抗體隨時間逐步衰退的情況下,流感對年長者的威脅更劇。一篇來自《傳染性疾病雜誌/The Journal of Infectious Diseases》的回顧性研究發現,大於60歲以上的族群,流感疫苗誘發的抗體保護力,約僅維持四至五個月。此時若病毒透過突變,獲得穿透抗體保護網的能力,就更可能侵犯這些脆弱族群(所以高風險族群,記得每年都要打流感疫苗喔)。
流感病毒的狡獪之處
而除了病毒的高突變速度外,李秉穎醫師還提出一種假說,來解釋「流感疫苗的保護力,似乎比其他疾病的疫苗短?」和「1976年流感疫苗疑似引發多發性神經炎(GBS, Guillain-Barre syndrome)」
李醫師說:「對人體而言,流感病毒是種『想揍它,但又不敢出全力』的奇特敵人。」
人體有種保護機制,稱為免疫耐受性(immune tolerance),指病原雖然存在於人體,但某些機制使身體不發揮足夠的免疫力來攻擊病原。這類機制在正常情況下,可避免母體攻擊胎兒、降低自體免疫疾病發生 。
但部分病毒似乎能借道此機制,躲避白血球的攻擊,流感病毒可能是其中的佼佼者。目前推論,流感病毒透過分子類似(molecular mimicry),模仿人體組織。流感病毒的蛋白質,和人體神經組織的蛋白質-神經節苷脂 (ganglioside),其立體結構近似。換言之,雖然病毒蛋白質和神經節苷脂,來自不同基因,但部分的立體結構類似,因此在病毒入侵、或接種疫苗後,若產生的抗體,辨認這兩種蛋白質的共同類似結構,就可能出現自體免疫疾病。
所以對人體而言,「想揍流感病毒,但又不敢出全力」,因此疫苗產生的抗體效力衰退速度快。但「想揍病毒,但出了全力」時,其抗體也會攻擊神經節苷脂,此時就會出現免疫失調、多發性神經炎,因此可以看到每年流感季時,罹患多發性神經炎的人數可能會變多,這同時也可能是1976年x, 流感疫苗有多發性神經炎副作用的原因 [9](註:目前僅有1976年豬流感疫苗在動物實驗、流行病學上有證據顯示疫苗會誘導多發性神經炎,但不可擴大推論所有的流感疫苗都會誘導多發性神經炎)。
更精細說明,免疫系統為了避免錯誤地攻擊自我組織,本身就有「敵我辨識系統」,但流感病毒的分子,和人體正常組織的分子過於類似,反而鑽了系統的漏洞,免疫系統在自我克制的情況下,無法發揮全力。所以流感病毒對人體來說,是種很特別、難以對付的病毒。
WHO怎麼知道那些病毒株會流行?
各國的科學家會從流感病人收集檢體,透過解析基因序列、和血球凝集抑制試驗(HI, The Hemagglutinin Inhibition Assay)結果,作為推薦未來一季流感疫苗的依據。
而世界衛生組織(WHO, World Health Organization)會和重要的國家級衛生單位合作,如:美國疾病控制與預防中心(US CDC, Centers for Disease Control and Prevention)、澳洲維多利亞傳染疾病實驗室(Victorian Infectious Diseases Reference Laboratory)等,透過她們的資訊,預測秋冬的流行病毒株。因為疫苗的製程至少需6個月,所以世界衛生組織在每年2月召開會議,推薦北半球的疫苗抗原(預測年底北半球流行株);而9月的會議,推薦南半球的疫苗抗原(預測隔年年中南半球流行株)。

而血球凝集抑制試驗,主要目的是測試前文所述的「中和抗體」。流感病毒表面的血凝素/HA,會黏住紅血球們,將血球們凝集在一起。若抗體能有效辨認病毒的血凝素、阻止其作用,就能抑制凝血作用,證明該濃度下,疫苗誘發的抗體能中和病毒、避免感染 。
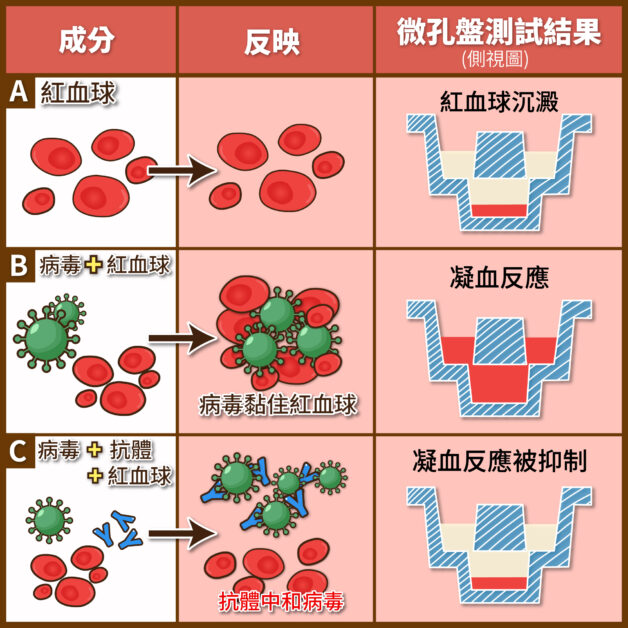
如前文所述,透過收集各地病人檢體,並排出候選病毒株,將和去年流感疫苗的病毒株進行比較。研究者用接種過疫苗的動物(如:雪貂)血清做實驗,觀察中和抗體對抗候選病毒株,其中和效價是否大幅降低,若降低4倍以上,就會被定義為該候選病毒株,和去年流行的病毒已不類似;換言之,過去使用的疫苗可能無法保護該候選病毒的感染 ,因此會被認為「需被關注的病毒株」,而科學家再進一步檢視候選病毒流行範圍等資訊,推測是否將成為「優勢流行」病毒株,綜合判斷下,決定是否推薦給藥廠。
世界衛生組織透過各種數據,預測秋冬來臨時,那些病毒株最可能流行,或最需疫苗防治的病毒株。儘管有時會失準,因為2月時的資訊,無法完全反應病毒在未來的演化,但這種推測,仍是絕大多數藥廠製備疫苗的重要依據。
為什麼不選擇不易突變的蛋白質作為抗原呢?
如前文所述,現行流感疫苗誘發的抗體,都是辨認血凝素的特定部位HA淺藍色部件,通常被稱為血凝素「頭部」)。然而,由於病毒的高突變速度,且血凝素並非病毒複製、生存過程中,極度必須的蛋白質,所以有較高的變異容忍度,所以病毒可以產出大量、血凝素頭部略有差異的多樣子代病毒。也因此疫苗帶來的保護力,隔年效果就不盡理想。
有鑑於此,部分團隊想發展長效型疫苗,例如:抗原選用血凝素/HA、但不和受器結合的部位。選用該處作為抗原,有理論之優勢。該處靠近病毒核心,不易出現突變(因為若產生突變,可能對病毒結構產生致命性的破壞,故在演化上,越靠近病毒核心的部位,突變的可能性越低)。理論上,若疫苗誘發的抗體,是針對病毒不易突變的蛋白質(如:血凝素「莖部」),就能做出長效、甚至廣譜型的流感疫苗。
但此概念有個致命的問題。流感疫苗的目標是「避免感染」,而病毒入侵細胞的鑰匙就是血凝素「頭部」。選用其他部位當作疫苗抗原,誘發的抗體將無法直接卡住血凝素和唾液酸受器,等同打蛇不打七吋,阻止感染、中和病毒的效果有先天的缺陷。研究團隊試圖透過其他方式彌補此缺陷,如:添加佐劑等提高抗體濃度,如同幫疫苗打超級士兵血清、期待變成美國隊長,但目前尚未看到有效的研究成果,都仍停留在實驗室階段。
聽說有種新製程的流感疫苗,保護力比較好,真的嗎?
美國在研究歷年的流感疫苗時,發現有時疫苗的病毒株,雖然和真實流行的病毒株相符,但效果不如預期。進一步研究發現,疫苗內的抗原,其胺基酸序列和原始設計稍有差異。深入研究後,科學家觀察到,用雞胚培養的流感病毒,在培養過程中會自然突變。
人類使用雞蛋培養病毒,作為疫苗抗原的技術,已有七十多年的歷史。科學家使用特製的疫苗用無菌蛋,將候選病毒注入已受精的雞蛋,培養數天、讓病毒大量繁殖後,再萃取病毒後製成疫苗。然而,本質上習慣人類環境的流感病毒,在雞胚裡生長時,有時會突變、適應鳥類細胞環境(egg-adaptive mutations),因此最終收集的疫苗抗原和原始預期有差距。目前已知A型流感的H3N2病毒株,在雞胚的生長效率較差,也較容易發生雞蛋適應性突變。
因此科學家發展出另一種技術,改採用哺乳類細胞培養病毒。由於病毒生活的細胞和人體類似,病毒不用特別突變去適應生長環境,所以最終製出的抗原將和預期相符,理論上疫苗的保護效果較雞胚培養的疫苗稍高;但需注意,此為新技術,目前的數據尚不夠充分。
除了理論的優點外,細胞培養疫苗也有製程上的優勢。雞胚培養需要特殊的疫苗蛋,製程耗時較長。若改採細胞培養生產,將無須選購、等待大量的疫苗蛋,可擁有更快的速度和彈性。由於上述的優勢,未來流感疫苗可能會慢慢轉向細胞培養技術。
為什麼季節性流感疫苗,每年都更換抗原,但似乎不需要做三期試驗就可上市?
主要是沒有辦法做,來不及(啊2月才知道病毒株,9月流感季就開始了,怎麼作三期試驗?)。因為現實面有困難,所以各國的共識是用血球凝集抑制試驗/HI,測試中和抗體效力,作為驗證疫苗效力的標準。試驗結果也許和實際保護力略有落差,但現實上流感病毒的突變速度過快,藥廠製造時間僅有六個月,因此,這是必須的取捨。
以我國疫苗廠-國光生技製作流感疫苗為例,藥廠在第一次申請流感疫苗藥證之前,徵招數百人進行實驗,測試中和抗體效力等數據,確認疫苗各項條件皆符合預期。食品藥物管理署確認各數據都合於規範,就會發給當年的流感疫苗藥證。而之後,每年重新申請季節性流感疫苗藥證時,由於僅調整抗原內容,未改變製程,政府認為效力和安全性不會因此大幅度改變,所以無需再進行人體試驗。這種審核流程,是因為流感病毒變異太快,人類必須在理想和現實中進行取捨。
雖然無法在上市前、透過人體試驗了解疫苗效力,但政府會透過上市後的監督和追蹤,檢視流感疫苗的效果。以美國為例,該國曾回溯分析後發現,鼻噴劑減毒流感疫苗在2013-14和2015-16的流感季,保護力表現不佳,因此停止核發2016-17和2017-16的藥證,直到藥廠更換病毒株、重新證明保護力不劣於其他疫苗,美國才重新核發藥證。
參考文獻
- 台灣疫苗推動協會榮譽理事長 李秉穎醫師專訪。2021/07/07
- How the Flu Virus Can Change: “Drift” and “Shift”. US CDC, Centers for Disease Control and Prevention. 2019/10/15
- 流感防治(含H7N9流感)。衛生福利部疾病管制署。2013/08/02
- Wenzhuo Hao, Lingyan Wang and Shitao Li (2020) Roles of the Non-Structural Proteins of Influenza A Virus. Pathogens.
- Danuta M. Skowronski, S. Aleina Tweed, S. Aleina Tweed, Gaston De Serres Author Notes (2008) Rapid Decline of Influenza Vaccine—Induced Antibody in the Elderly: Is It Real, or Is It Relevant? The Journal of Infectious Diseases.
- Immune Tolerance. National Institute of Allergy and Infectious Diseases (NIAID). 2014/01/17
- Nobuhiro Yuki, Keiichiro Susuki. et.al. (2004) Carbohydrate mimicry between human ganglioside GM1 and Campylobacter jejunilipooligosaccharide causes Guillain–Barré syndrome. PNAS.
- M. B. A. Oldstone (2005) Molecular Mimicry, Microbial Infection, and Autoimmune Disease: Evolution of the Concept.
- Helmar C Lehmann, Hans-Peter Hartung, Bernd CKieseier, Richard ACHughes (2010) Guillain-Barré syndrome after exposure to influenza virus. The Lancet Infectious Diseases.
- Irving Nachamkin, Sean V. Shadomy. et. al. (2008) Anti-Ganglioside Antibody Induction by Swine (A/NJ/1976/H1N1) and Other Influenza Vaccines: Insights into Vaccine-Associated Guillain-Barré Syndrome. The Journal of Infectious Diseases.
- Selecting Viruses for the Seasonal Influenza Vaccine. US CDC, Centers for Disease Control and Prevention. 2020/10/26
- Antigenic Characterization. US CDC, Centers for Disease Control and Prevention. 2019/10/15
- Nicholas C. Wu, Huibin Lv. et.al. (2019) Preventing an Antigenically Disruptive Mutation in Egg-Based H3N2 Seasonal Influenza Vaccines by Mutational Incompatibility. Cell Host & Microbe. DOI: 10.1016/j.chom.2019.04.013
- 許玉龍,黃高彬 (2020) 綜論-接種季節流感疫苗後的保護效力與抗體漸退之探討。感控雜誌。DOI: 10.6526/ICJ.202006_30(3).0003