什麼是適體?
提到 DNA 與 RNA,大家腦海裡第一個浮現出來的就是生物課的內容吧:
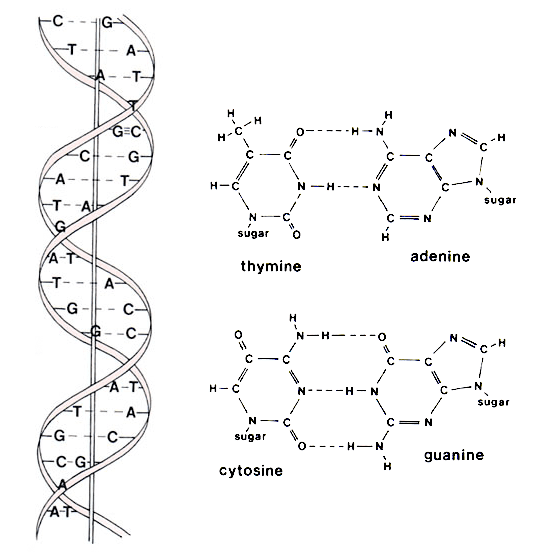
DNA 以具備 ATCG 四種不同含氮鹼基的核苷酸來記載生物遺傳資訊,而 RNA 負責翻譯這些遺傳資訊,進而製造生物體的一切構築原料。
但是 DNA 和 RNA 就只有像字典和翻譯機的功能嗎?如果你把他們想像的這麼簡單,那可是大錯特錯喔。他們可還有精確搜尋出目標的偵探能力呢!

首先,在你認知中的核酸構型長怎樣呢?所聯想到的大概就是那看起來神秘又唯美的雙股螺旋狀。因為許多影視作品的推廣,在大眾的印象中,DNA 的形象和雙股螺旋已經合而為一了。的確,配對後的 DNA 序列經 X光晶體分析是雙股螺旋狀,這在當時還是轟動世人的重要發現呢!
但那只是 DNA 做為遺傳物質時的一種經典樣貌。事實上,單股核酸在不同序列的組合下也是有千變萬化的構型。就如同人體內的 RNA 就根據不同的功能而有著不同構型,甚至也有些特殊構型具備酵素的相似功能,被稱為核酶(ribozyme)。
而不同的核酸序列能產生不同構型,這個特性是不是就跟我們熟知的蛋白質一樣呢?沒錯,蛋白質也透過不同胺基酸組合,產生許多具功能性的構型,並成為所有生物體內生化反應進行的必要推手。於是就有些人想到了,既然如此,我們何不使用核酸的這個特性發展成工具使用呢?
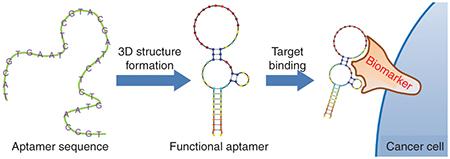
在 1990 年,Szostak 及 Gold 實驗團隊便分別發展出了類似的篩選技術,可在體外篩選、分離並放大特定的 RNA 序列片段。這些序列片段構型可以如探針一樣,專一性地辨識目標物。而這些具辨識能力的 RNA 片段就被 Szostak 實驗室命名為 aptamer,取自拉丁文 aptus,有適合的意思。由 Gold 實驗室提出的篩選方式則被命名為 systematic evolution of ligands by exponential enrichment,可譯為配體的指數增長系統進化技術,也就是後人泛稱的SELEX。
在兩間實驗室發現了 RNA 具備的特殊能力後不久,DNA 也被發現可做為適體的原料。在後續20多年的研究發展更證實了適體在生物檢測與醫療領域上的諸多可能性,也陸續吸引了許多實驗室繼續投入研究。
適體V.S. 抗體
說到適體能專一性辨識目標分子的能力,這聽起來是不是很熟悉?
沒錯,適體跟抗體都能經適當設計後,成為生物檢測的工具。但是抗體的發現早了適體將近百年,無數的研發成果讓抗體早已成為生物檢測市場上的老大哥了。那做為後起之秀的適體,究竟有什麼優勢之處能與抗體一較高下呢?不妨讓我們一同瞧瞧。
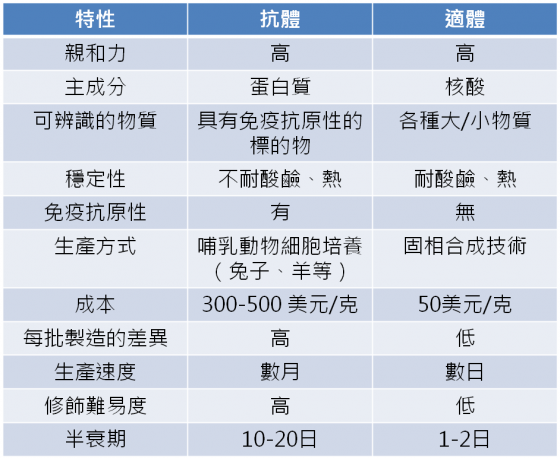
- 適體對於給定的任何目標特徵都有高度的特異度與親和力,範圍從小分子到較大的蛋白質,甚至連整顆活細胞都在他的守備範圍內。使適體具有發展成廣範圍生物感測工具的潛力。而抗體只能辨識具有免疫活性的分子,泛用度上就有相當大的差距。
- 適體被篩選出來後,其後續生產原料來自商業來源,可以固相合成技術在數小時內批量生產,並同時具有高重現度與純度。反觀一般抗體藥物需要由哺乳動物細胞培養,且從生產製造到純化需耗費數天至數月。時間成本上抗體輸了一大截。
- 與蛋白質構成的抗體或酵素相比,DNA構成的適體具有高度化學穩定性,不易因酸鹼熱等環境因子而破壞活性。但是未經過適當化學修飾的適體在血液中將面臨核酸酶的破壞,未能如抗體一般穩定存在。
- 適體在與目標結合後,構型會有顯著的變化。使它可以被設計成更為靈活的生物檢測器,並有高度的偵測特異度與選擇性。
既便宜又多用途,使適體成為十分有潛力的發展目標。然而適體也有其弱點:雖然有好的化學穩定性,但由於其小分子量使其生物穩定性較差。體內半衰期短限制了適體在臨床應用上的發展。且傳統的 SELEX技術無法預測適體和目標分子結合的位置,與結合後的具體作用功能。因此短時間內,適體還不能動搖已經有穩健根本的抗體檢測市場,但相信假以時日,這些技術層面的障礙也將被孜孜不倦的研發人員們突破。
適體的誕生之路—SELEX
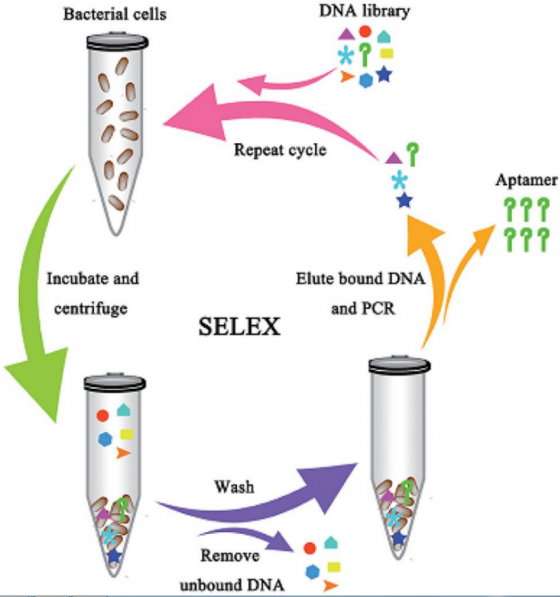
介紹完了適體,那麼回頭來看看SELEX。究竟是經過怎樣的流程,能讓一般的核酸分子大翻身變成大家眼中生物檢測界的明日之星呢?
SELEX可大致分為三個流程:
篩選出可結合目標的配體序列:
目標會與核酸序列庫內各種隨機的單鏈核酸序列作用。藉以找出能與目標物結合的適體。在這個階段,平均可以從 109 到 1013 的隨機序列中找到一條能結合上目標物。
分離出有結合到目標物的適體:
在第一個步驟後,將未結合上目標物的核酸分子分離,再將有結合的適體與目標物分離並收集起來。
放大適體數量:
收集完的那些適體分子,再進一步以聚合酶連鎖反應(PCR)的方式放大其數量。
透過重複這三個步驟的流程,並在每一次循環中,調整培養的時間、溶液的性質、目標分子的數量等方式,使篩選條件更加嚴苛。以篩選出真正具高度專一性與親和力的適體分子。
並且,做為保險機制,會在前期的某次循環中進行反向篩選,即以另一種跟目標物有相似處的不同物質進行篩選。而這次篩選出有結合的那些適體分子會被判定不及格,只留下沒結合上的適體分子。這個步驟的目的是要篩去那些雖然有親和力但是專一性不高的適體。
通過了如此層層關卡後篩出來的極少數核酸分子,才是真正符合我們要求的高品質適體。並進一步應用到生物檢測或其他用途。
適體在臨床與科學應用上有著許多抗體所沒有的優勢,雖然目前市場上適體的相關產品較為罕見,一方面因為過去SELEX的技術受到專利的保護,只有少數公司享有開發產品的權利;另一方面,適體要從實驗室跨足到商業應用也仍有許多問題需要克服。
相較已經熟為人知並有成熟體系的抗體,適體的產品仍舊較為弱勢。但期待隨著各項適體相關專利的解禁,更多的實驗室投入適體的改良與開發,未來適體能夠成為臨床與科研領域發展上的強力推手!
參考資料
- Shiping Song, Lihua Wang, Jiang Li, Chunhai Fan, Jianlong Zhao (2008). Aptamer-based biosensors. Elsevier. doi: 10.1016/j.trac.2007.12.004
- Subash Chandra Bose Gopinath (2007). Methods developed for SELEX. Analytical and Bioanalytical Chemistry.
- Regina Stoltenburg, Christine Reinemann, Beate Strehlitz (2007). SELEX—A (r)evolutionary method to generate high-affinity nucleic acid ligands. Elsevier. doi: 10.1016/j.bioeng.2007.06.001
- DOIT 經濟部技術處(2017)—產業技術評析 核酸適體(Apatamer)新藥研發商機