- 首圖說明:熱休克蛋白90(圖中以辣椒呈現)不僅僅能維持許多細胞內的穩定狀態,最新研究顯示除了它傳統的蛋白摺疊功能之外,更發現熱休克蛋白能促進小泡內體(multivesicular body)和細胞膜(圖中以黃色表示)的融合從而導致外吐小體(exosome)的釋放(途中以彩色珠子呈現),且此功能完全獨立於其原本的蛋白摺疊功能。 藝術原創:王俞鈞
- 文/王俞鈞 │ 現於比利時魯汶大學攻讀生物醫學博士,專長為細胞內蛋白穩態以及神經分子生物學,研究領域橫跨生物化學,分子生物學,神經科學,以及神經退化性疾病。
熱休克蛋白在八零年代被發現,此蛋白會受熱刺激而大量表達,進而維持體內的蛋白穩定。熱休克蛋白90 在體內是一個非常常見的蛋白,佔細胞內蛋白表達量的百分之二,並且可以調控各式各樣的訊息傳導,能與其反應的受體蛋白更高達蛋白質全部種類數的百分之二十。
最新於 2018 年 9 月發表的研究顯示,熱休克蛋白不僅僅可以幫助蛋白質正常的折疊,更可以調節細胞膜的形變。熱休克蛋白90 已經被廣泛研究,許多功能已經被詳盡的報導,但比利時研究團隊近期發現了熱休克白90 的新功能:在原本已知的幫助蛋白摺疊功能外還可以改變胞膜的形變,誘導外吐小體 (exosome)的釋放。
經過近幾十年的研究,我們已經了解到熱休克蛋白90 的許多功能,其中最眾所皆知的就是幫助蛋白摺疊及穩定蛋白的構造,尤其是當細胞遭遇壓力或刺激。當這些損害已超出修補的限度時,熱休克蛋白更可以幫助降解受損或者錯誤折疊的蛋白,而這些無數的功能使得熱休克蛋白90 成為細胞內維持蛋白質狀態穩定極為重要調節因子。
胞膜的形變和外吐小體的釋放
此研究新近發表在分子細胞期刊(Molecular Cell),派翠克教授(Patrik Verstreken)和他在比利時魯汶大學(KU Leuven, VIB, Belgium)的研究團隊發現熱休克蛋白90不僅有協助蛋白摺疊功能,也有助於釋放外吐小體。
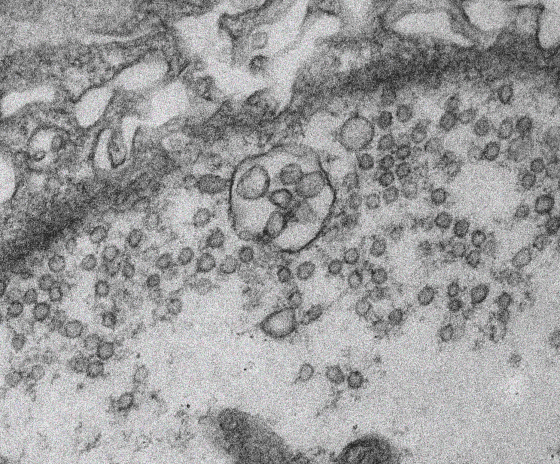
外吐小體(exosome)是一種極小的囊泡狀構造,經由細胞內多小泡內體(multivesicular body)與細胞膜的融合之後,外吐小體會被釋放到細胞外。這些小囊泡不但能攜帶生長所需重要的訊息傳導物質,也能散播致病的毒性蛋白。
研究員王俞鈞(Yu-Chun Wang)解釋:我們發現,熱休克蛋白90 可以直接參與改變胞膜的型態。熱休克蛋白表面的螺旋狀蛋白鍊結構有非常保守的帶正電胺基酸,能幫助多小泡內體和細胞膜的融合,最後促使外吐小泡的釋放。
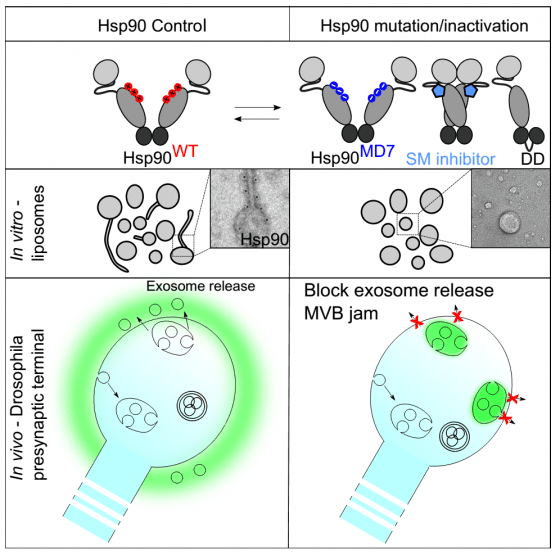
研究員艾爾莎(Elsa Lauwers)補充:這個蛋白與胞膜的交互過程是能被調控的。熱休克蛋白90 通常成對才有功能,而這個成對結構有打開以及閉合的型態。我們可以通過突變前述的胺基酸區段來移除此正電區塊,或者經由藥物改變其蛋白結構的開合狀態來改變其功能,進而影響外吐小體的釋放。
神經退化性疾病和癌症治療
派翠克教授認為,外吐小體對於橫跨細胞的信號傳導十分重要,這些囊泡有可能在細胞間散佈有毒蛋白,此發現可能與許多神經退化性疾病有關。有毒蛋白例如普里昂(prion),突觸核蛋白(alpha-synuclein)或 Tau 都是會影響大腦功能的疾病,其在腦細胞間的傳遞機制就可能與外吐小體有關。普里昂會導致庫茲菲德─雅各氏症(Creutzfeldt-Jakob disease),俗稱的狂牛病(Mad cow disease),而突觸核蛋白或 Tau 沉積則與帕金森氏症(Parkinson’s Disease)或阿茲海默氏症(Alzheimer’s Disease)有關。
熱休克蛋白的另一個已知功能,則是穩定特定的蛋白質來影響腫瘤轉移,目前臨床上的研究方向之一便是應用熱休克蛋白90 的抑制劑於癌症治療。此研究亦發現,前述的某些抑制劑也可能阻斷外吐小體的釋放,因此這項工作成果將可以為這些藥物的作用方式帶來重要的洞見,並且找出潛在的不良反應。

資料來源 :
- Lauwers, E., Wang, Y. C., Gallardo, R., Van der Kant, R., Michiels, E., Swerts, J., … & Rousseau, F. (2018). Hsp90 Mediates Membrane Deformation and Exosome Release. Molecular Cell, 71(5), 689-702.