- 本文與新興科技媒體中心合作,內文經泛科學改寫。
- 詳細專家回應請見:「2021年是阿茲海默症藥物研究的關鍵時間點」之專家意見
- 資料更新至 2021 年 6 月 8 日
去年(2020)年底,國際期刊「自然」《Nature》照例羅列了每年 10 大科學關注議題,其中提到「阿茲海默症藥物來到了關鍵時刻」。
今年 6 月 7 日,由美國製藥大廠百健(Biogen)生產的一種藥物「Aducanumab」,經過長期研發與臨床試驗,終於被美國食品藥品監督管理局(FDA)核准,成為阿茲海默症新藥。(未來可能販售的藥名為 Aduhelm)
這款藥物特別之處為何?是否有其他藥物研發方向也值得關注?目前臨床上已有哪些治療阿茲海默的藥物呢?
阿茲海默症的成因
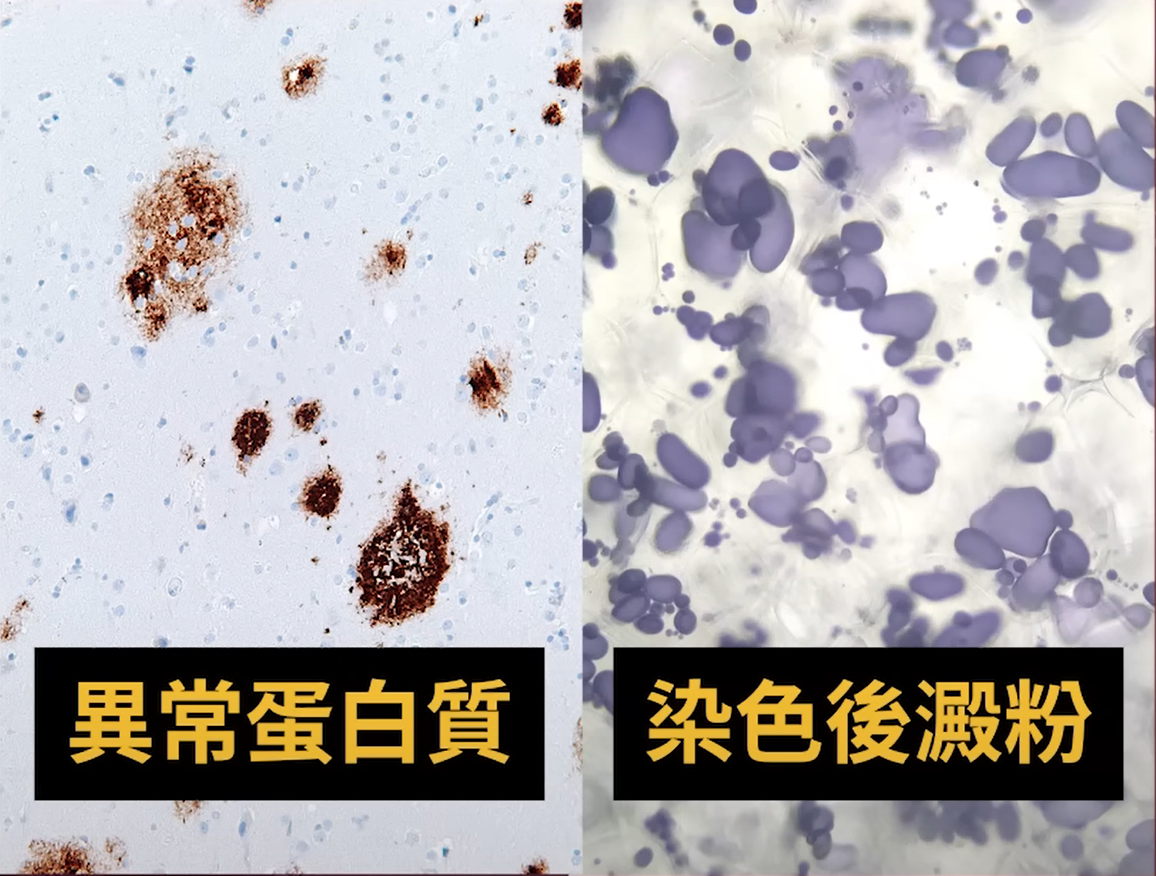
阿茲海默症是一種大腦神經退化的疾病,目前學者認為,引發患者認知功能下降的主因,可能是 β-類澱粉蛋白(amyloid beta, Aβ)在腦中堆積。

除了主要致病因子 Aβ,阿茲海默症的病因還包括「不正常堆積的 Tau 蛋白」[1],和近來在 30-50% 阿茲海默症病人腦中發現的「TDP-43 蛋白堆積」[2][3]。
此外,阿茲海默症也受家族遺傳、腦內發炎反應[1]、高血糖與高膽固醇等慢性病的影響。
目前治療阿茲海默症的藥物與限制
陽明交通大學腦科學研究中心副教授 鄭菡若與中央研究院細胞與個體生物學研究所副研究員 廖永豐說明,目前核准治療阿茲海默症的藥物,主要僅能「減緩部分患者心智功能退化的速度」,但無法阻止或逆轉病程。
病人在服用阿茲海默症藥物初期,的確可顯著改善認知功能,可是在用藥三到五年後,又會出現認知功能急劇下降的情形。
主要原因是目前 FDA 批准的四種阿茲海默症藥物,都是減輕症狀,無法完全阻斷疾病繼續惡化。

為了要突破這類藥物的治療瓶頸,各大藥廠及醫學研究單位都正在盡全力開發「改變疾病藥物」(disease-modifying drugs),藉由阻斷「β-類澱粉蛋白質」或「tau蛋白」這類致病因子的神經毒性,避免神經細胞因此而凋亡,達到真正阻斷疾病繼續惡化的機轉,才有機會開發出能治療甚至能夠預防阿茲海默症的藥物。
新藥 Aducanumab 的誕生
百健藥廠在 2016 年的前期臨床試驗發現 Aducanumab 能結合且清除 β-類澱粉蛋白(amyloid beta, Aβ),可能強化腦內微膠質細胞的功能、避免神經發炎,並改善認知功能[4]。後續的成果令人期待。
中央研究院基因體中心副研究員 陳韻如說明,Aβ 的特性是會累積並從單體聚合成有毒的堆積物,沉積在神經細胞外會造成神經細胞死亡[1]。
過去失敗的 Aβ 抗體藥物,如禮來藥廠(Eli Lilly)的「Solanezumab」,是由小鼠產生針對 Aβ 澱粉蛋白單體的抗體,再用基因工程的方法轉變為人類抗體,在臨床試驗第三期雖然可以降低 Aβ 堆積,但未能顯著改善或延緩病人的認知功能退化[4]。
而 Aducanumab 這款抗體藥物會特別受到青睞,是因為它是直接由健康人的免疫細胞中篩選針對 Aβ 堆積物的抗體而來,與先前由小鼠產生的抗體藥不同,是一株對 Aβ 堆積物有專一性的人類抗體。
廖永豐副研究員也補充,Aducanumab 是過去二、三十年來阿茲海默症藥物開發的歷程中,第一次有藥物能直接顯著的改善受測者的心智功能[5],而且改善的程度與腦中β-類澱粉蛋白沈積物下降的幅度成正相關,代表 Aducanumab 的療效是藉由清除腦中類澱粉蛋白沈積物所達成的。

這結果也同時支持「β-類澱粉蛋白」的確在阿茲海默症的致病機轉中扮演一個非常重要的角色。
Aducanumab 峰迴路轉的臨床試驗結果
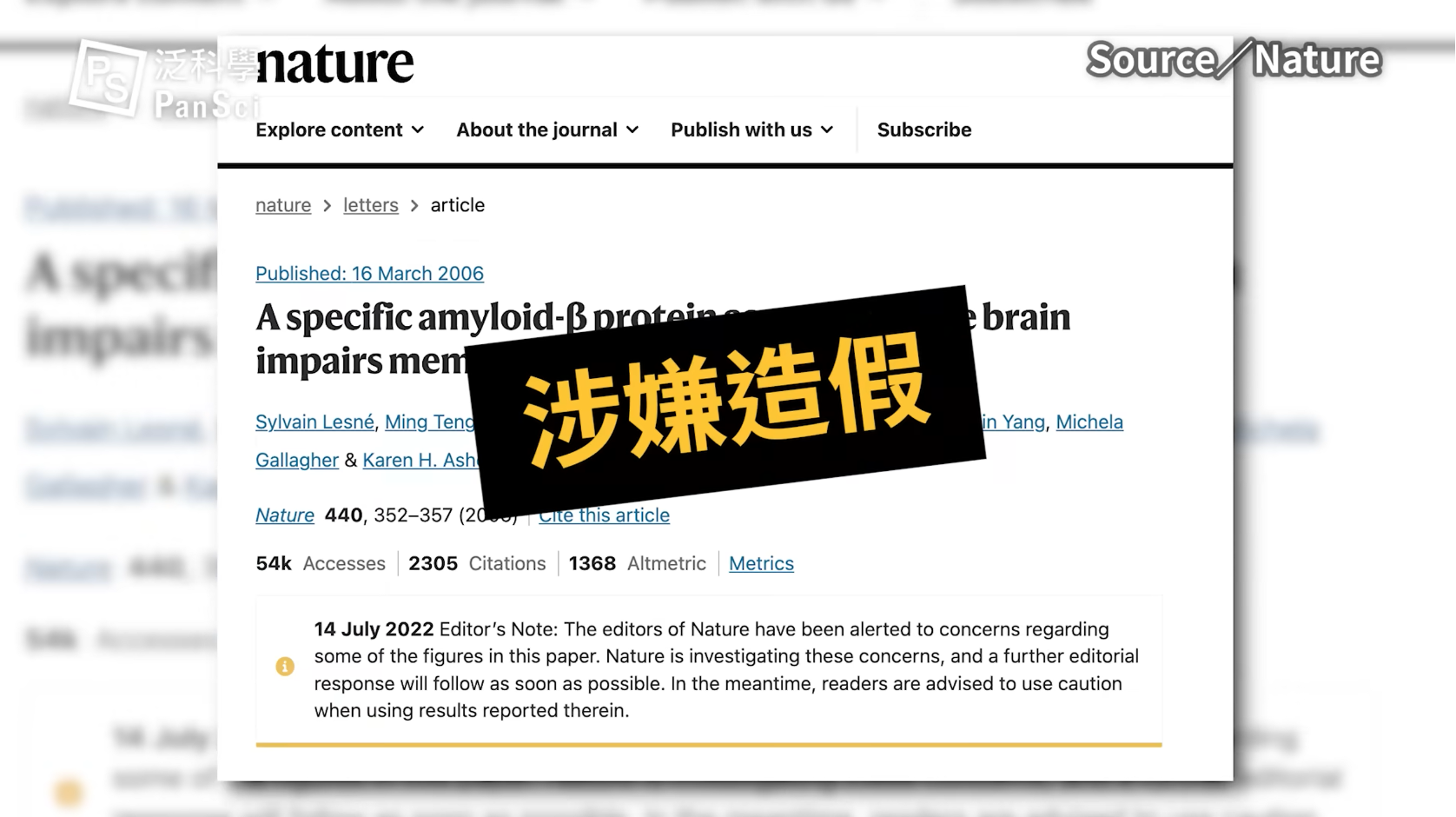
Aducanumab 臨床試驗第一期結果是,給藥組顯示出前所未見的、改善認知功能退化的效果。然而後來的臨床試驗第三期卻因看不出顯著改善而一度停止。
百健藥廠在 2016 年發表了 Aducanumab 於 164 例阿茲海默輕症患者的臨床研究,指出依投藥時間與劑量的多寡,Aducanumab 能減少患者腦中β-類澱粉蛋白並改善認知功能[4]。

之後 78 週的臨床第三期期試驗中,分為 EMERGE 與 ENGAGE 兩組,2019 年初,因獨立監管委員會的期中分析評估認為可能無法達到主要臨床指標[6],百健宣布停止試驗。
然而同年十月因為加入更多數據,百健指出 EMERGE 組接受高劑量 Aducanumab 的患者,認知能力比接受安慰劑者好[7]。雖然 Aducanumab 在 ENGAGE 組整體中沒有顯著的改善效果,但採最高 Aducanumab 劑量時,對 ApoE4 基因型的阿茲海默輕症患者有療效,他們的認知能力比接受安慰劑的好[8]。
因此,目前 Aducanumab 已被加速批准用於治療阿茲海默症引起的「輕度認知障礙」及「早期失智症」,但日後仍需進行第四期臨床試驗,證明其臨床成效。
新藥為阿茲海默治療帶來更多可能
由於阿茲海默症的致病機轉複雜,不同藥物的作用機轉皆不相同,鄭菡若副教授認為,未來若有多種藥物通過許可,可能會採取合併療法。
中研院副研究員陳韻如也補充,加上每個病理特徵可能在不同的年紀出現[9],將來的藥物可能無法只控制單一因子,必須朝多目標研發藥物,未來治療方向亦需將病人細分成不同的階段及種類,全方面依病人基因型[10]及病理特徵來考慮調控的方法。
廖永豐副研究員根據 Jeffrey Cummings 及幾位在克利夫蘭臨床醫學研究中心(Cleveland Clinic)的阿茲海默症專家合著的一篇論文中指出,從臨床試驗註冊網站 ClinicalTrials.gov 截至 2020 年 2 月 27 日止的統計資料顯示,目前仍然有 121 種阿茲海默症的候選藥物在人體臨床試驗的階段[11]。

有 17 種屬於緩解病程的藥物已進入到臨床試驗的第三期,其中占大宗的是屬於抑制 β-類澱粉蛋白毒性的藥物,有 6 種。其它 11 種不同藥理機轉的藥物也已順利進入第三期試驗,代表抗 Tau 蛋白[12] 沈積的藥物、抗神經發炎反應的藥物、提升能量代謝活性的藥物、以及活化神經傳導提供神經保護效果的藥物,都將有機會在未來五年內被證實對阿茲海默症的療效。
若分析臨床第一、第二期試驗階段的藥物之藥理機轉,的確可看出過去五年來開發阿茲海默症藥物的重點已從抑制 β-類澱粉蛋白神經毒性,轉移到其它致病機轉上,這些非 β-類澱粉蛋白致病機轉的藥物已占近八成的比例。
這個趨勢也反映,近年來轉譯醫學及臨床研究對阿茲海默症致病機轉的結論,都指向 Tau 蛋白沈積的神經毒性、異常的神經發炎反應、能量代謝的失恆、以及神經傳導的缺陷,可能在阿茲海默症致病機轉的不同階段,與 β-類澱粉蛋白的神經毒性以協同作用或獨立作用,加速阿茲海默症的病程。
所以持續開發這些「非 β-類澱粉蛋白致病機轉」的藥物,將可能達到阿茲海默症個人化精準醫療的目標。
回過頭來,Aducanumab 開發成功的經驗,也帶動了各大藥廠持續投注可觀的資源,繼續推動阿茲海默症新藥研發。
近期也終於有其它成功的臨床試驗結果,包括羅氏藥廠(Roche)的「Gantenerumab」及衛采藥廠(Eisai)的「BAN2401」,兩個抗體藥物都可以有效減低阿茲海默症輕症患者或無症狀者腦部β-類澱粉蛋白沈積物的堆積量。
這也說明 Aducanumab 在阿茲海默症藥物開發的歷史意義,可以審慎樂觀地期望未來阿茲海默症藥物開發的前景,也可實質鼓舞阿茲海默症患者及照護者。

註釋
- [1] Pomara, N. & Sidtis, J.J. (2010). “Alzheimer’s disease.” N Engl J Med 362(19), 1844; author reply 1844-5.
- [2] Josephs, K.A. et al. (2014). “Staging TDP-43 pathology in Alzheimer’s disease.”Acta neuropathologica, 127(3), 441-450.
- [3] Shih, Y.H. et al. (2020).“TDP-43 interacts with amyloid-beta, inhibits fibrillization, and worsens pathology in a model of Alzheimer’s disease.” Nature communications, 11(1), 1-17.
- [4] Sevigny, Jeff, et al. (2016). The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease. Nature, 537(7618), 50-56.
- [5] 編註:這裡的心智功能,是指包含語文能力、記憶能力、空間辨識能力,以及思覺感官功能。
- [6] 編註:此主要臨床指標依照臨床失智評估量表(Clinical Dementia Rating-Sum of the Boxes, CDR-SB),量化阿茲海默症患者的認知功能以及藥物治療成效,並據此支持法規審查核准上市。
- [7] Knopman, David S., et al. (2019). Failure to demonstrate efficacy of aducanumab: An analysis of the EMERGE and ENGAGE trials as reported by Biogen. Alzheimer’s Dement. 2020;1-6.
- [8] Massie, Tristan. (2020) BLA 761178 Statistical Review Aducanumab in Alzheimer’s.
- [9] Jack, C.R., Jr. et al. (2013). “Tracking pathophysiological processes in Alzheimer’s disease: an updated hypothetical model of dynamic biomarkers.” The Lancet Neurology, 12(2), 207-216.
- [10] 編註:基因型是指生物體中所有遺傳訊息的集合。基因型的相關研究可以幫助診斷遺傳疾病、鑑定親緣關係、預測得到疾病的風險等。
- [11] Cummings, J., Lee, G., Ritter, A., Sabbagh, M., & Zhong, K. (2020). “Alzheimer’s disease drug development pipeline: 2020.” Alzheimer’s & Dementia: Translational Research & Clinical Interventions, 6(1), e12050.
- [12] 編註:正常的Tau蛋白(tau protein)能協助維持神經元功能的完整,不正常磷酸化的tau蛋白會形成神經纖維纏結(neurofibrillary tangles),破壞細胞的維生運輸系統,使細胞死亡,促使阿茲海默症發生及惡化。
其它參考文獻
- Alzheimer’s Disease International. (2021).“About Alzheimer’s & Dementia.”Retreval Date: 2021/2/5
- Sevigny, J. et al. (2016). “The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease.”Nature, 537(7618), 50-56.
- Long, J. M., & Holtzman, D. M. (2019). Alzheimer disease: an update on pathobiology and treatment strategies. Cell, 179(2), 312-339.
- Linse, Sara, et al. (2020). Kinetic fingerprints differentiate the mechanisms of action of anti-Aβ antibodies. Nature Structural & Molecular Biology, 27(12), 1125-1133.
- Uhlmann, Ruth E., et al. (2020). Acute targeting of pre-amyloid seeds in transgenic mice reduces Alzheimer-like pathology later in life. Nature Neuroscience, 23(12), 1580-1588.
相關資料
- Holly Else (2020). “The science events to watch for in 2021”Nature News, December 22.
- 陳祈典(2020)〈阿茲海默症新藥前景未卜〉,工商時報,11月30日。
- Aducanumab 前期試驗報告:Sevigny, Jeff, et al. (2016).“The antibody aducanumab reduces Aβ plaques in Alzheimer’s disease. ”Nature, 7618: 50-56.
- Aducanumab 試驗第三期分為 Emerge 與 Engage 兩組,分別招募了 1,600 位 50 歲至 85 歲的患者,與對照組比較靜脈注射低、高劑量 Aducanumab 的結果。



















-200x200.jpg)