衛生福利部食品藥物管理署在《聯合報》等發佈廣告〈基改食品致癌?證據不足!〉後, 主婦聯盟環境保護基金會也發明了〈 「假科學之名行廣告之實」-本會針對食藥署0618廣告之聲明〉回應。
雖然我個性內向害羞不好爭論,不過想想這也算是我的專業領域之一,我的研究主題之一是演化基因體學,還是來談談小弟對這個議題的淺見。不過,誠如我過去一 直秉持的立場,我一定還是要兩邊都不討好。如果想從這裡找到支持不支持基改食品和作物明確的好壞優劣,我擔心您會失望了。只是我和衛福部、食藥署及主婦聯盟沒有直接關係就是了,算是盡量客觀中立了吧。
首先,我認為支持不支持基改作物,其實說穿了,也只是一個風險的概念,因為基改作物本身並無所謂絕對的好壞,高收益可能伴隨著高風險,高風險也可能有高獲益。如果只要有壞處就捨棄,容我很不客氣地建議,我們乾脆把全世界的作物,無論有沒有基因改造,全都燒光光,讓大部分人類餓死,剩下的回到田野過狩獵採集的生活。不過這麼做很顯然是弊大於利的蠢事!
我們人類在非洲草原長達幾百萬人演化出來的腦袋,是為了趨吉避兇和繁衍後代用的,要用它來理性地判斷風險,是不容易但還是可以做得的。我們害怕一些事物, 不是因為它有多糟糕和恐怖,有時候僅是因為不熟悉而已。如果說基因作物能有多壞,那麼比基因作物更壞的東西是否也要消滅?
如果如此,我建議立法把「糖」比照菸酒類作管制。我這麼說已經算標準很寬鬆了,因為抽菸,不管一手還是二手,都有高度致癌風險,基改作物根本無法超越吧? 擁有和吸食菸草違法了嗎?那糖呢?不管是蔗糖還是高果糖糖漿,都是加工食品和居家必備的,可是我們人類無法直接把果糖作為燃料(蔗糖是一分子的果糖加一份子的葡萄糖聚合而成的雙糖),簡單來說,大部分吸收的果糖是在肝臟代謝成脂肪的前驅物,這也是現代人脂肪肝和肥胖盛行的元兇之一, 詳情可參閱美國加州大學舊金山分校教授羅伯.魯斯提(Robert H. Lustig)的《雜食者的詛咒:當一卡路里不是一卡路里,食品工業的黑心糖果屋》(Fat Chance : Beating the Odds Against Sugar, Processed Food, Obesity, and Disease)。
「糖」對人類健康的戕害,威力恐不下於基改作物,可是沒幾個正常人會想提案把「糖」比照「菸酒」來管制吧?我們不怕「糖」卻擔心基因作物,不是因為基因作 物已經造成了大規模的健康問題,如果是的話,請立法管制「糖」的攝取吧,而是因為我們早就對「糖」熟悉得再不能熟悉了,「糖」已經成為我們日常生活常用的食材,我們不會害怕「糖」,不是因為它對我們的健康無害,而是因為我們太習慣了使用「糖」。
基改食品致癌的證據確實是不足的。基改作物或許有其他壞處,基改作物可能會造成一些生態問題 [1-28],影響一些野生植物和昆蟲的生態,可是對人類的害處,始終沒有直接證據 [29-35]。美國超市粗估有高達七八成的加工食物都含有基因作物的成份。由於美國法律沒有要求標示基改作物的成份,因此幾乎只再沒有標「Non-GMO」,就一定含有基因作物的成份。美國消費者吃了這些食品已有廿年了,還未發現有增加疾病的風險。科技也在進步,我們可以利用來探討基改作物有無有害 成份的工具也比過去還多,我看不出有任何需要增加擔憂的理由。
然而,我還是無法告訴你,基改作物一定無害,因為沒有找到證據證實基因作物有害,和找到證據證實基因作物無害,這兩句話看似沒啥不同,可是邏輯完全不同。 沒有找到證據,不代表沒有,也就是說沒有找到證據說基改作物致癌,不代表基因作物就一定不會致癌。只要找到一隻天鵝是黑的,那麼天鵝就不會只有白的,只是沒有找到黑天鵝,並不代表天鵝就一定是白的。在科學上,要證實「沒有」這件事,比證實「有」這件事難很多。
所以,我們是要作「有罪推定」還是「無罪推定」呢?這關係到的,並非是科學問題,而是價值觀取捨。美國這個相對新興的國家,比較願意接受新事物,冒險創新 的精神高,他們對新事物在態度上採取「無罪推定」,也就是說沒有證據顯示有害,先假設無害,所以他們創新性高,可是有些東西多年後卻發現有害;而歐洲在態度上比較採取「有罪推定」,還未證實無害前,先假定有害,所以創新性低,可是比較不容易出大錯。
我要再次強調,像基改作物這種高度爭議的議題,甚至在學界都還未有共識前,有立場並不是問題,但是要能適當地陳述什麼是已知的事實,還有什麼是未知的,憑什麼已知的事實做出決策。在決策過程中,就要涉及價值觀判斷,因為這些事物無所謂完全的好壞,我們會根據自己的信念,在價值的取捨上對不同參數做輕重的加權,綜合評估而得出支持或反對的決定。這世界上很少有完全無害的事物,高收益伴隨著高風險,只是我們要能準確判斷風險,再依價值觀和承受能力作出選擇。只是科學的態度是一分證據說一分說,我看不出食業署的廣告內存在任何重大科學問題,除了幾句表達不清確的話–例如基改和傳統育種還是有差的,並非沒有不同。
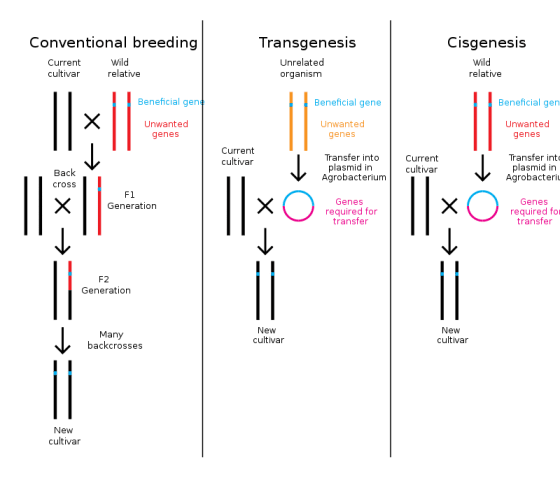
很多人反對基改作物,是因為基改作物不是天然的,可是我們人類文明社會現在吃的主食,其實沒幾樣是天然的。我們吃的食物,就算沒有用基因工程作基因改造,也早已影響了我們的健康,道家氣功就有門派就主張要長生不老就是不吃不喝,不過還沒有人辦到吧?這世界上並不存在完美的食物,食物之間對健康來說只有相對好壞的差別。
演化生物學家賈德.戴蒙(Jared Diamond)成功地在《槍炮、病菌與鋼鐵:人類社會的命運》(Guns, Germs and Steel: The Fates of Human Societies) 用生物地理學的概念解釋了為何人類的文明之起源即罕見又特殊。無論理由為何,人類進入農耕時代後,食物的種類就大量減少,我們人類的主要糧食作物就手指也就數得出的幾種而已,例如小麥、大麥、燕麥、黑麥、稻米、玉米、馬鈴薯、高粱、小米,蔬菜水果等也佔了所有植物的冰山一角的一角而已,馴養的動物也寥寥無幾,就牛、羊、豬、雞、鴨、鵝。相較我們十萬年前演化出來的智人祖先相比,人類文明在大約一萬年後進入農耕社會後,我們的食物種類和營養就異常的貧乏。
人類自從有農耕時代開始,就已經改造了所有作物了,沒有任何農作物是純天然的。農耕本身就不是多麼「正常」的行為,詳細的論述可讀人類演化遺傳學家史賓賽.韋爾斯(Spencer Wells)的《潘朵拉的種子:人類文明進步的代價》(Pandora’s Seed: The Unforeseen Cost of Civilization)及賈德.戴蒙的《昨日世界:找回文明新命脈》(The World Until Yesterday: What Can We Learn from Traditional Societies?)和歷史學家菲立普.費南德茲─阿梅斯托(Felipe Fernandez-Armesto)的《食物的歷史—透視人類的飲食與文明》(Food: A History)(請參見〈潘朵拉的種子之代價〉、〈昨日世界的是是非非〉和〈食物的歷史-吃的意義〉)。不過人類也非唯一會農耕的動物,居住於中南美洲亞馬遜雨林的切葉蟻(Leafcutter Ant)會把切下的葉子被搬進蟻穴,還會被弄碎成黏糊狀的葉糊,並用來培養真菌,而這些真菌會成為切葉蟻的食物來源,這也算是農耕哦!
我們和切葉蟻最大的差別,可能是我們不僅只能選擇少數動植物來耕作和馴養,我們也利用各種選汰和育種的方法來改造了農作物的基因體,使得它們的遺傳背景和祖先相差不少。沒有任何農作物在自然界是正常的,它們不是要結實結得又多又飽滿來讓人類吃的。就我研究的家雞演化而言,不需要基因改造,人類就育出年產約 200-300 顆蛋的蛋雞,而牠們的祖先紅色叢林雞一年只生約 12 顆蛋而已。還有只要醒著就吃個不停的肉雞,因為牠們已搞不清楚自己究竟飽了沒。
我們不僅改造了農作物的基因體,甚至也改造了我們部分的基因體,我們人類為了適應農耕社會,我們增加了分解澱粉的酵素的基因數 [36, 37],一些族群也演化成唯一能夠在斷奶後飲用乳汁的哺乳動物 [38-45]。人類對農作物基因體究竟造成了什麼影響,它們又怎麼影響我們的基因體,是方興未艾的研究,我們知道的還甚少。
既然我們已透過選汰和育種的方法來大幅改造了農作物的基因體,我們把幾個基因塞進農作物裡,算什麼大不了的事了? 主婦聯盟指出,「基因工程為透過病毒或細菌等媒介植入特定基因,打破生物界『不同種生物無法互換DNA』的規則,與傳統育種在同種生物間進行培育得到目標作物是完全不一樣的概念與技術,這已是一般民眾都能理解的基礎生物學。基因工程與傳統育種絕對不是食藥署所宣稱的『沒什麼不同』。」這裡頭有很大的問題, 就是指稱生物界裡,不同種生物無法在自然的情況下互換DNA,是錯的!
生物學家早就知道不同物種之間能夠透過基因水平轉移〔Horizontal gene transfer,HGT,或稱基因側向轉移(lateral gene transfer,LGT)〕的方式交換基因,自然界中已知從不同物種,甚至不同界(kingdom)的生物之間取得基因,已知的真核生物案例就有雙子葉 的 Striga hermonthica 從單子葉的高粱取得的基因 [46]、蚜蟲從真菌取得製造類胡蘿蔔素的基因 [47, 48]、瘧原蟲從人類偷取的基因 [49]、一種甲蟲(Coffee borer beetle)從細菌取得的基因HhMAN1 [50, 51]等等。
我們人類僅是聰明地藉助各種方法,把這個過程按照人類–而非大自然–的意思來模仿大自然的這個「正常」過程而已。這樣作並非不會製造問題,可是我們要想的是:究竟這麼做是利大於弊嗎?
老實說,我也很討厭孟山都等大生技企業的很多作法,有些基改作物也確實被濫用,例如把農作改造得更耐他們公司出的農藥等等,或者試圖掌控第三世界的農業命脈的行徑等等。不過有些環保團體提出的主張卻也未必實際,例如立法大幅提高基改作物安全測試的門檻,看似有道理,卻反而可能造成大企業更容易壟斷,因為有些成本小公司反而負擔不起,搞不好弄得有創新的小公司只能被大企業收購一途,就像製藥產業一樣。通往地獄的路為善意所鋪的,就是這個意思。不過政策上,問題過於複雜,在此就不展開討論。
基改作物對人類和其他生物的影響,也是錯綜複雜的。有研究發現基改作物裡抗蟲害的成份對其他野生昆蟲的生存也不利,有些益蟲也受到了影響。可是公視的記錄片《蜂狂》(Toxic Bees- Nature’s Mayday)卻也指出,因為害蟲對基改作物的抗蟲成份有了抗性,讓農民改種非基改作物而且改用系統性農藥,可能是導致北美蜜蜂大量死亡的原因之一,甚至還可能增加了過動兒。所以判斷基改作物的利弊也不是件簡單的事,凡事皆可能是雙面刃。
我們很容易批評現在工業化的農業等等,可是我們也得瞭解到,要餵養六七十億人口不是件簡單的事。我在這篇文章中〈回應〈發明疾病的人?〉〉中指出,現代醫療和公共衛生是現代人能夠活得健康長壽的原因之一,其實只說對了一半,另一大原因還有乾淨充足的飲水和食物,只是當時不想扯太多而模糊焦點。 這要歸功的除了淨水及輸送技術,還有保存食物的技術(如防腐保鮮技術和冰箱等),當然還有生產充足糧食的綠色革命(Green Revolution)。
改良品種、大量使用化肥和水利灌溉的綠色革命有弊也有利,可是我們能夠突破馬爾薩斯(Thomas R. Malthus,1766-1834)的詛咒,拜的就是農耕技術的突破。可是我們今天再度面對的是人口不僅逐漸上升,新興國家的中產階級也需要更富足的生活,可是大量可耕地反而因為都市化、工業污染、鹽化等而逐年喪失,加上全球氣候變遷火上澆油,我們很可能需要再一場綠色革命,才能提升甚至維持糧食的穩定供應量,才能讓窮人也不致於挨餓。基改作物如果未來朝著提升產量,以及適應不良土地(如鹽化)、耐熱抗旱等等,我們才有更多武器對抗未來嚴峻的挑戰!當然,依靠傳統育種選植的方式也不是不能達成,只是這些方法較耗時,而我們最缺乏的東西之一也就是時間XD
我想,對於基改作物,我們沒有理由完全排斥,明確的標示或許是個辦法,但是卻不容易辦到,因為上超市買的東西,我們可以明確看到標示,去便當店吃飯,總不會要求老闆一樣一樣說明有無基改作物成份吧?因此政府在源頭把關,或許也很重要。還有,如果真的在乎健康,少吃加工食品,多吃在地當季的食物,吃的食物種類愈多樣愈好,可能比擔心基改作物還實際吧!
參考文獻:
- Conner AJ, Glare TR, Nap JP (January 2003). “The release of genetically modified crops into the environment. Part II. Overview of ecological risk assessment“. Plant J. 33 (1): 19–46. doi:10.1046/j.0960-7412.2002.001607.x. PMID 12943539.
- Wolfenbarger LL, Phifer PR (December 2000). “The ecological risks and benefits of genetically engineered plants“. Science 290 (5499): 2088–93. doi:10.1126/science.290.5499.2088. PMID 11118136.
- Brookes, Graham and Barfoot, Peter (May 2012) GM crops: global socio-economic and environmental impacts 1996-2010 PG Economics Ltd. UK, Retrieved 3 January 2012
- Dorsch, J.A; Candas, M; Griko, N.B; Maaty, W.S.A; Midboe, E.G; Vadlamudi, R.K; Bulla Jr, L.A (2002). “Cry1A toxins of Bacillus thuringiensis bind specifically to a region adjacent to the membrane-proximal extracellular domain of BT-R1 in Manduca sexta:“. Insect Biochemistry and Molecular Biology 32 (9): 1025–36. doi:10.1016/S0965-1748(02)00040-1. PMID 12213239.
- Romeis, Jörg; Hellmich, Richard L.; Candolfi, Marco P.; Carstens, Keri; De Schrijver, Adinda; Gatehouse, Angharad M. R.; Herman, Rod A.; Huesing, Joseph E.; McLean, Morven A.; Raybould, Alan; Shelton, Anthony M.; Waggoner, Annabel (2010). “Recommendations for the design of laboratory studies on non-target arthropods for risk assessment of genetically engineered plants“. Transgenic Research 20 (1): 1–22. doi:10.1007/s11248-010-9446-x. PMC 3018611. PMID 20938806.
- Romeis, Jörg; Bartsch, Detlef; Bigler, Franz; Candolfi, Marco P; Gielkens, Marco M C; Hartley, Susan E; Hellmich, Richard L; Huesing, Joseph E; Jepson, Paul C; Layton, Raymond; Quemada, Hector; Raybould, Alan; Rose, Robyn I; Schiemann, Joachim; Sears, Mark K; Shelton, Anthony M; Sweet, Jeremy; Vaituzis, Zigfridas; Wolt, Jeffrey D (2008). “Assessment of risk of insect-resistant transgenic crops to nontarget arthropods“. Nature Biotechnology 26 (2): 203–8. doi:10.1038/nbt1381. PMID 18259178.1
- Losey, John E.; Rayor, Linda S.; Carter, Maureen E. (1999). “Transgenic pollen harms monarch larvae“. Nature 399 (6733): 214. doi:10.1038/20338. PMID 10353241.
- Sears MK, Hellmich RL, Stanley-Horn DE, Oberhauser KS, Pleasants JM, Mattila HR, Siegfried BD, Dively GP (October 2001). “Impact of Bt corn pollen on monarch butterfly populations: a risk assessment“. Proc. Natl. Acad. Sci. U.S.A. 98 (21): 11937–42. Bibcode:2001PNAS…9811937S. doi:10.1073/pnas.211329998. JSTOR 3056827. PMC 59819. PMID 11559842.
- Gatehouse AM, Ferry N, Raemaekers RJ (May 2002). “The case of the monarch butterfly: a verdict is returned“. Trends Genet. 18 (5): 249–51. doi:10.1016/S0168-9525(02)02664-1. PMID 12047949.
- Lövei GL, Andow DA, Arpaia S (April 2009). “Transgenic insecticidal crops and natural enemies: a detailed review of laboratory studies“. Environ. Entomol. 38 (2): 293–306. doi:10.1603/022.038.0201. PMID 19389277.
- Shelton AM, Naranjo SE, Romeis J, Hellmich RL, Wolt JD, Federici BA, Albajes R, Bigler F, Burgess EP, Dively GP, Gatehouse AM, Malone LA, Roush R, Sears M, Sehnal F (June 2009). “Setting the record straight: a rebuttal to an erroneous analysis on transgenic insecticidal crops and natural enemies“. Transgenic Res. 18 (3): 317–22. doi:10.1007/s11248-009-9260-5. PMID 19357987.
- Carpenter JE (2011). “Impact of GM crops on biodiversity“. GM Crops 2 (1): 7–23. doi:10.4161/gmcr.2.1.15086. PMID 21844695.
- Icoz, Isik; Stotzky, Guenther (2008). “Fate and effects of insect-resistant Bt crops in soil ecosystems“. Soil Biology and Biochemistry 40 (3): 559. doi:10.1016/j.soilbio.2007.11.002.
- Bohan, D. A; Boffey, C. W.H; Brooks, D. R; Clark, S. J; Dewar, A. M; Firbank, L. G; Haughton, A. J; Hawes, C.; Heard, M. S; May, M. J; Osborne, J. L; Perry, J. N; Rothery, P.; Roy, D. B; Scott, R. J; Squire, G. R; Woiwod, I. P; Champion, G. T (2005). “Effects on weed and invertebrate abundance and diversity of herbicide management in genetically modified herbicide-tolerant winter-sown oilseed rape“. Proceedings of the Royal Society B: Biological Sciences 272 (1562): 463. doi:10.1098/rspb.2004.3049.
- Strandberg, Beate; Bruus Pedersen, Marianne; Elmegaard, Niels (2005). “Weed and arthropod populations in conventional and genetically modified herbicide tolerant fodder beet fields“. Agriculture, Ecosystems & Environment 105: 243. doi:10.1016/j.agee.2004.03.005.
- Gibbons, D. W; Bohan, D. A; Rothery, P.; Stuart, R. C; Haughton, A. J; Scott, R. J; Wilson, J. D; Perry, J. N; Clark, S. J; Dawson, R. J.G; Firbank, L. G (2006). “Weed seed resources for birds in fields with contrasting conventional and genetically modified herbicide-tolerant crops“. Proceedings of the Royal Society B: Biological Sciences 273 (1596): 1921. doi:10.1098/rspb.2006.3522.
- Chamberlain, D.E.; Freeman, S.N.; Vickery, J.A. (2007). “The effects of GMHT crops on bird abundance in arable fields in the UK“. Agriculture, Ecosystems & Environment 118: 350. doi:10.1016/j.agee.2006.05.012.
- Pleasants, John M.; Oberhauser, Karen S. (2013). “Milkweed loss in agricultural fields because of herbicide use: Effect on the monarch butterfly population“. Insect Conservation and Diversity 6 (2): 135. doi:10.1111/j.1752-4598.2012.00196.x.
- Relyea RA (2005). “The Impact of Insecticides and Herbicides on The Biodiversity and Productivity of Aquatic Communities“. Ecological Applications 15 (2): 618–627. doi:10.1890/03-5342. PMID 17069392.
- Lu Y, Wu K, Jiang Y, Xia B, Li P, Feng H, Wyckhuys KA, Guo Y (May 2010). “Mirid bug outbreaks in multiple crops correlated with wide-scale adoption of Bt cotton in China“. Science 328 (5982): 1151–4. Bibcode:2010Sci…328.1151L. doi:10.1126/science.1187881. PMID 20466880.
- Zhao JH, Ho P, Azadi H (August 2012). “Erratum to: Benefits of Bt cotton counterbalanced by secondary pests? Perceptions of ecological change in China“. Environ Monit Assess 184 (11): 7079. doi:10.1007/s10661-012-2699-5. PMID 22864609.
- Stone, Glenn Davis (2011). “Field versus Farm in Warangal: Bt Cotton, Higher Yields, and Larger Questions“. World Development 39 (3): 387–98. doi:10.1016/j.worlddev.2010.09.008.
- Chilcutt, Charles; Tabashnik, BE. (18 May 2004). “Contamination of refuges by Bacillus thuringiensis toxin genes from transgenic maize“. Proceedings of the National Academy of Science of the United States of America 101 (20): 7526–7529. Bibcode:2004PNAS..101.7526C. doi:10.1073/pnas.0400546101. PMC 419639. PMID 15136739.
- Watrud LS, Lee EH, Fairbrother A, Burdick C, Reichman JR, Bollman M, Storm M, King G, Van de Water PK (October 2004). “Evidence for landscape-level, pollen-mediated gene flow from genetically modified creeping bentgrass with CP4 EPSPS as a marker“. Proc. Natl. Acad. Sci. U.S.A. 101 (40): 14533–8. Bibcode:2004PNAS..10114533W. doi:10.1073/pnas.0405154101. PMC 521937. PMID 15448206.
- Quist D, Chapela IH (November 2001). “Transgenic DNA introgressed into traditional maize landraces in Oaxaca, Mexico“. Nature 414 (6863): 541–3. doi:10.1038/35107068. PMID 11734853.
- Kaplinsky N, Braun D, Lisch D, Hay A, Hake S, Freeling M (April 2002). “Biodiversity (Communications arising): maize transgene results in Mexico are artefacts“. Nature 416 (6881): 601–2; discussion 600, 602. Bibcode:2002Natur.416..601K. doi:10.1038/nature739. PMID 11935145.
- Ortiz-Garcia, S.; Ezcurra, E.; Schoel, B.; Acevedo, F.; Soberon, J.; Snow, A. A. (2005). “Absence of detectable transgenes in local landraces of maize in Oaxaca, Mexico (2003-2004)“. Proceedings of the National Academy of Sciences 102 (35): 12338–43. Bibcode:2005PNAS..10212338O. doi:10.1073/pnas.0503356102. PMC 1184035. PMID 16093316.
- Piñeyro-Nelson A, Van Heerwaarden J, Perales HR, Serratos-Hernández JA, Rangel A, Hufford MB, Gepts P, Garay-Arroyo A, Rivera-Bustamante R, Alvarez-Buylla ER (February 2009). “Transgenes in Mexican maize: molecular evidence and methodological considerations for GMO detection in landrace populations“. Mol. Ecol. 18 (4): 750–61. doi:10.1111/j.1365-294X.2008.03993.x. PMC 3001031. PMID 19143938.
- American Association for the Advancement of Science (AAAS), Board of Directors (2012). “Legally Mandating GM Food Labels Could Mislead and Falsely Alarm Consumers“
- A decade of EU-funded GMO research (2001–2010) (PDF). Directorate-General for Research and Innovation. Biotechnologies, Agriculture, Food. European Union. 2010. doi:10.2777/97784. ISBN 978-92-79-16344-9.
- Ronald, Pamela (2011). “Plant Genetics, Sustainable Agriculture and Global Food Security“. Genetics 188 (1): 11–20. doi:10.1534/genetics.111.128553.
- American Medical Association (2012). “Report 2 of the Council on Science and Public Health: Labeling of Bioengineered Foods” “Bioengineered foods have been consumed for close to 20 years, and during that time, no overt consequences on human health have been reported and/or substantiated in the peer-reviewed literature.” (first page)
- United States Institute of Medicine and National Research Council (2004). “Safety of Genetically Engineered Foods: Approaches to Assessing Unintended Health Effects“. National Academies Press. Free full-text. National Academies Press. pp R9-10
- Key S, Ma JK, Drake PM (June 2008). “Genetically modified plants and human health“. J R Soc Med 101 (6): 290–8. doi:10.1258/jrsm.2008.070372. PMC 2408621. PMID 18515776.
- Miller, Henry (2009). “A golden opportunity, squandered“. Trends in Biotechnology 27 (3): 129–130. doi:10.1016/j.tibtech.2008.11.004.
- Perry GH1, Dominy NJ, Claw KG, Lee AS, Fiegler H, Redon R, Werner J, Villanea FA, Mountain JL, Misra R, Carter NP, Lee C, Stone AC. “Diet and the evolution of human amylase gene copy number variation“. Nat Genet. 2007 Oct;39(10):1256-60. Epub 2007 Sep 9.
- Santos JL, Saus E, Smalley SV, Cataldo LR, Alberti G, Parada J, Gratacòs M, Estivill X. “Copy number polymorphism of the salivary amylase gene: implications in human nutrition research“. J Nutrigenet Nutrigenomics. 2012;5(3):117-31. doi: 10.1159/000339951. Epub 2012 Sep 3.
- Bersaglieri, T.; Sabeti, P. C.; Patterson, N.; Vanderploeg, T.; Schaffner, S. F.; Drake, J. A.; Rhodes, M.; Reich, D. E.; Hirschhorn, J. N. (2004). “Genetic Signatures of Strong Recent Positive Selection at the Lactase Gene“. The American Journal of Human Genetics 74 (6): 1111–1120. doi:10.1086/421051. PMC 1182075. PMID 15114531.
- Aoki K (2001). “Theoretical and Empirical Aspects of Gene–Culture Coevolution“. Theoretical Population Biology 59 (4): 253–261. doi:10.1006/tpbi.2001.1518. PMID 11560446.
- Swallow D. M. (2003). “Genetics of Lactase Persistence and Lactose Intolerance“. Annual Review of Genetics 37: 197–219. doi:10.1146/annurev.genet.37.110801.143820. PMID 14616060.
- Itan Y, Powell A, Beaumont MA, Burger J, Thomas MG (2009). “The Origins of Lactase Persistence in Europe“. PLoS Comput Biol 5 (8): e1000491. doi:10.1371/journal.pcbi.1000491. PMC 2722739. PMID 19714206.
- Myles S., Bouzekri N., Haverfield E., Cherkaoui M., Dugoujon J. M., Ward R. (2005). “Genetic evidence in support of a shared Eurasian-North African dairying origin“. Biomedical and Life Sciences 117 (1): 34–42. doi:10.1007/s00439-005-1266-3.
- Tishkoff S. A.; Reed, Floyd A; Ranciaro, Alessia; Voight, Benjamin F; Babbitt, Courtney C; Silverman, Jesse S; Powell, Kweli; Mortensen, Holly M; Hirbo, Jibril B; Osman, Maha; Ibrahim, Muntaser; Omar, Sabah A; Lema, Godfrey; Nyambo, Thomas B; Ghori, Jilur; Bumpstead, Suzannah; Pritchard, Jonathan K; Wray, Gregory A; Deloukas, Panos (2006). “Convergent adaptation of human lactase persistence in Africa and Europe“. Nature Genetics 39: 31–40. doi:10.1038/ng1946. PMC 2672153. PMID 17159977.
- Enattah N. S., Jensen T. G. K., Nielsen M., Lewinski R., Kuokkanen M., Rasinpera H., El-Shanti H., Kee Seo J., Alifrangis M. et al. (2008). “Independent Introduction of Two Lactase-Persistence Alleles into Human Populations Reflects Different History of Adaptation to Milk Culture“. American Journal of Human Genetics 82 (1): 57–72. doi:10.1016/j.ajhg.2007.09.012. PMC 2253962. PMID 18179885.
- Itan Y., Jones B. L., Ingram C. J. E., Swallow D. M., Thomas M. G. (2010). “A worldwide correlation of lactase persistence phenotype and genotypes“. BMC Evolutionary Biology 10: 36. doi:10.1186/1471-2148-10-36.
- Yoshida, Satoko; Maruyama, Shinichiro; Nozaki, Hisayoshi; Shirasu, Ken (28 May 2010). “Horizontal gene transfer by the parasitic plant Striga hermonthica”. Science 328 (5982): 1128. Bibcode:2010Sci…328.1128Y. doi:10.1126/science.1187145. PMID 20508124.
- Nancy A. Moran; Tyler Jarvik (2010). “Lateral Transfer of Genes from Fungi Underlies Carotenoid Production in Aphids“. Science 328 (5978): 624–627. Bibcode:2010Sci…328..624M. doi:10.1126/science.1187113. PMID 20431015.
- Fukatsu T (April 2010). “Evolution. A fungal past to insect color“. Science 328 (5978): 574–5. Bibcode:2010Sci…328..574F. doi:10.1126/science.1190417. PMID 20431000.
- Bar D (16 February 2011). “Evidence of Massive Horizontal Gene Transfer Between Humans and Plasmodium vivax“. Nature Precedings. doi:10.1038/npre.2011.5690.1.
- Lee Phillips, Melissa (2012). “Bacterial gene helps coffee beetle get its fix“. Nature. doi:10.1038/nature.2012.10116.
- “Adaptive horizontal transfer of a bacterial gene to an invasive insect pest of coffee“. PNAS. 2012. doi:10.1073/pnas.1121190109.
本文原刊登於The Sky of Gene。