身為人體總司令,大腦每單位重量所消耗的能量,約為其他器官的 8 至 10 倍[1]。所以,即使大腦只佔據人體總重量的 2%,仍然得消耗人體高達 20% 的總能量才能保持運作,就連休息和睡覺時,消耗的能量也絲毫不減。
為什麼大腦這麼輕,卻得消耗如此多的能量呢?
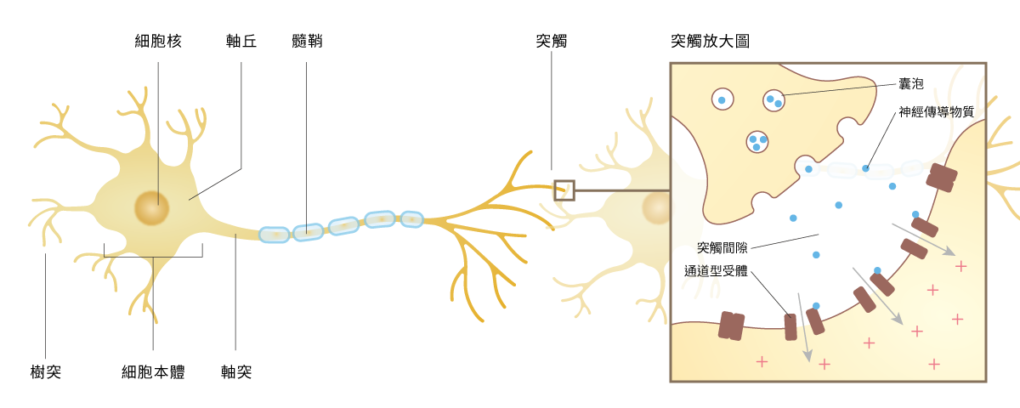
以往,科學家認為這和「腦電活動」有關,也就是腦內神經元運作時,所產生的電活動。神經元是神經系統負責傳遞訊息的基本單位。這些細胞形狀細長,結構可分為三個部分:細胞本體、樹突(dendrite)和軸突(axon)。樹突看起來就像樹枝,有很多專一性受體,可以接收來自上一個神經元的神經傳導物質。
靜止膜電位:穩定的休息狀態
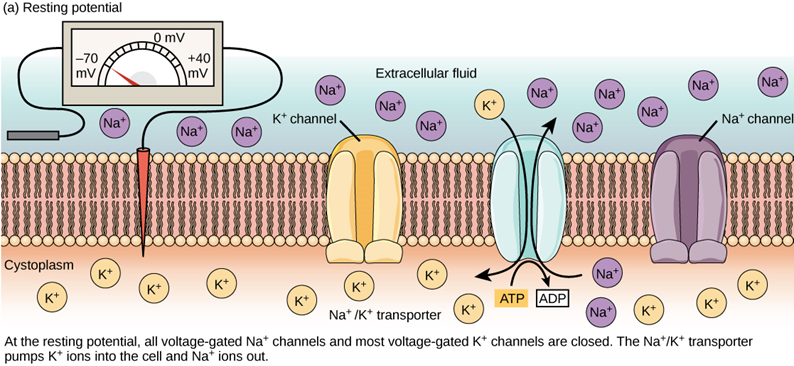
在樹突沒有收到化學訊號的狀態下,神經元的靜止膜電位(resting membrane potential)約為 -70 mV;也就是說,在休息狀態時,神經元內的電壓相較於細胞外低了 70 mV。造成電位差的關鍵在於細胞膜外的正離子(鈉離子,Na+)比較多,膜內的正離子(鉀離子,K+)比較少。
可是,物質不都是從高濃度往低濃度的地方移動嗎?為什麼還可以維持在 -70 mV 呢?
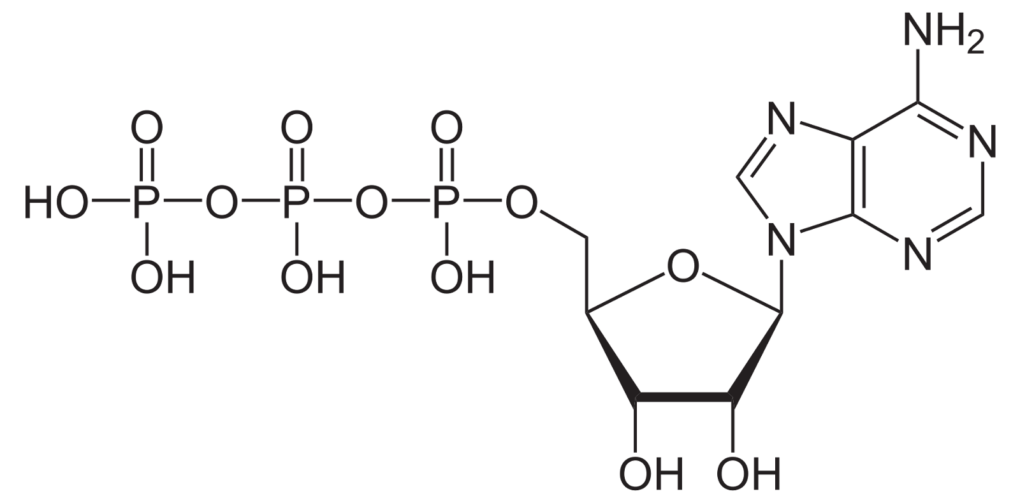
第一,是透過主動運輸。這種運輸方式必須消耗能量才能進行,而負責這項任務的就是細胞膜上的「鈉鉀幫浦」(Na+/K+-ATPase)。鈉鉀幫浦所消耗的能量是三磷酸腺苷,也稱作 ATP,是細胞的「能量貨幣」,專門儲存和提供能量。幫浦每消耗 1 個 ATP,就可以將 3 個鈉送出細胞,再將 2 個鉀送入細胞。只要幫浦不斷運作,就能維持恆定的離子濃度差,使得細胞外有較多鈉離子,而細胞內則有較多鉀離子。
第二,是透過被動運輸。這種運輸方式不需要消耗任何能量,只要有濃度差異,離子就可以經由通道蛋白,從高濃度處擴散到低濃度處。然而,細胞膜上的鉀離子通道蛋白數量較多,約為鈉離子通道蛋白的 50 倍,所以鉀離子可以輕鬆離開細胞,鈉離子卻難以回到細胞,使得細胞內部正離子數量較少。
那麼,收到化學訊號時,神經元的膜電位會怎麼變化呢?
動作電位:活躍的工作狀態
剛剛提到神經元的靜止膜電位約為 -70 mV,細胞膜內帶負電、膜外帶正電,這種兩極化的電荷環境,稱為「極化」(polarization)。當神經傳導物質和樹突上的受體結合,受體就會根據接收到的訊號種類,調整離子通道的通透性。
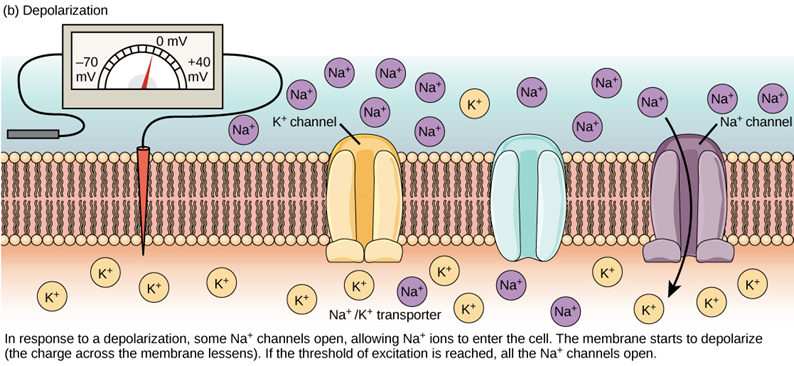
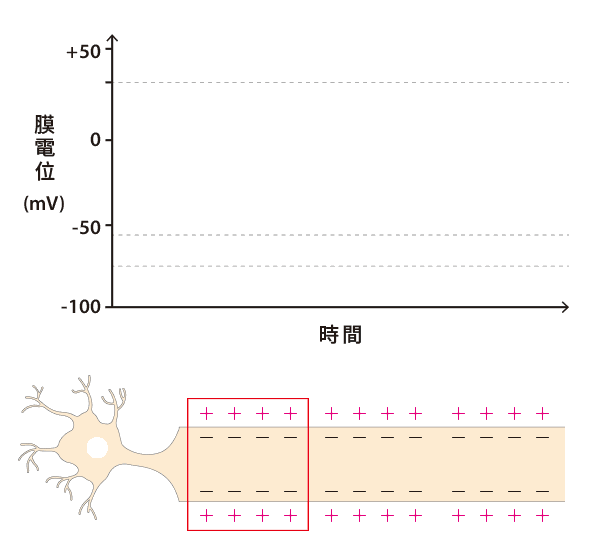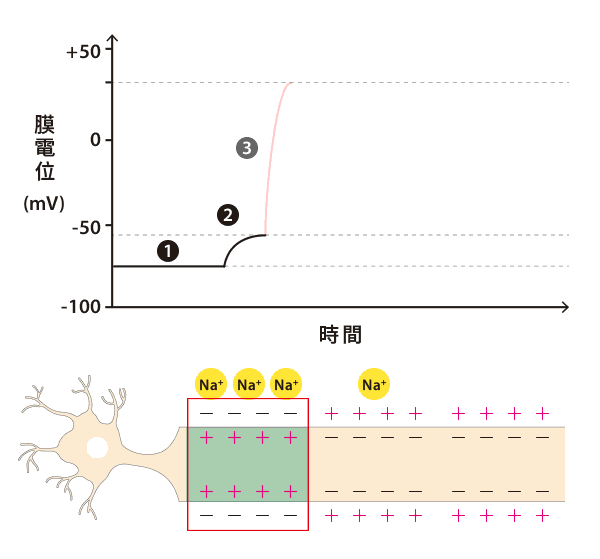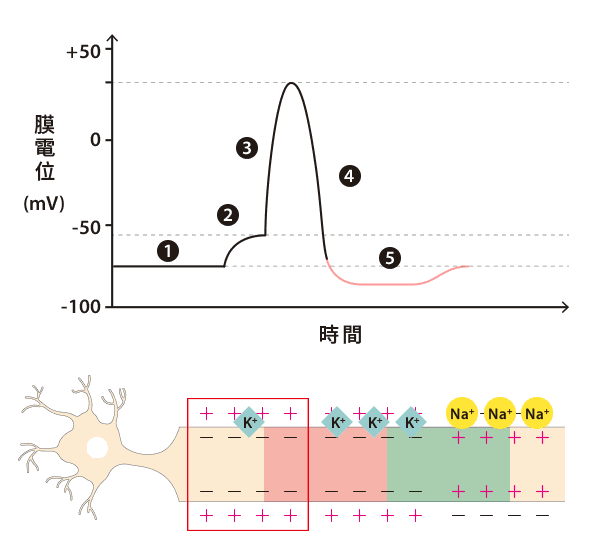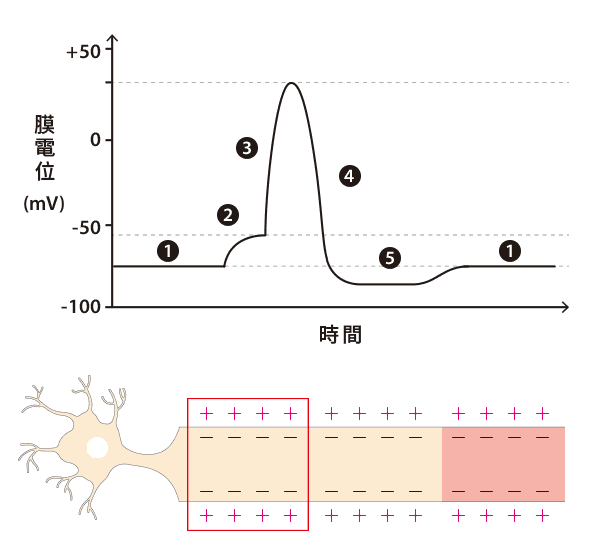
比方說,若是收到興奮性的訊號(專有名詞是「興奮性突觸後電位」;EPSP),就會增加細胞膜對鈉離子的通透性,使鈉離子流入細胞內。因為鈉離子帶有正電,原本維持在 -70 mV 的膜電位就會上升。若是膜電位高於 -55 mV 的閾值,軸突前端的軸丘(axon hillock)就會立即反應,產生動作電位(action potential),以電訊號的形式打開附近所有鈉離子通道,使得鈉離子大量湧入細胞,形成「去極化」(depolarization)。
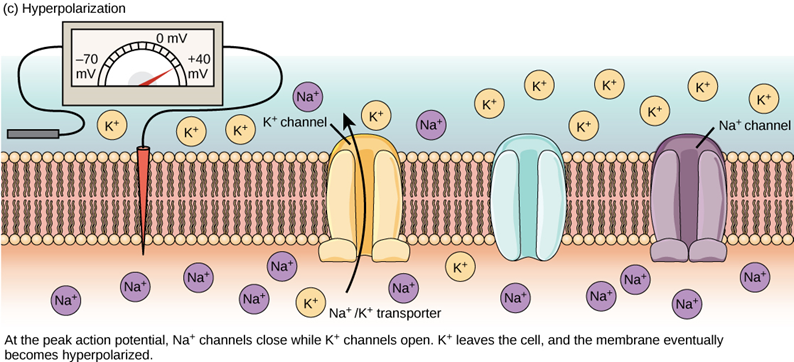
動作電位啟動後,膜電位通常可以衝高到 40 mV。為了平衡細胞膜內過多的正電荷,鈉離子通道便會關閉,而鉀離子通道會同步打開,讓細胞內的鉀離子流出細胞,使得膜電位再次回到帶負電的狀態,稱為「再極化」(repolarization)。
可是,因為鉀離子通道關閉速度較為緩慢,所以當膜電位回復到 -70 mV 時,鉀離子仍不斷流出細胞,造成電位低於靜止膜電位的「過極化」(hyperpolarization)現象。此時,鈉鉀幫浦就會主動消耗 ATP,重複將 3 個鈉離子送出細胞,再將 2 個鉀離子送回細胞的循環,讓膜電位和離子濃度都順利回到最初的極化狀態。
以上四階段(極化、去極化、再極化、過極化)就是一個完整的動作電位!
另一方面,若是樹突上的受體收到抑制性的訊號(專有名詞是「抑制性突觸後電位」;IPSP),就會增加對鉀離子的通透性,使鉀離子流出細胞外,造成原本帶負電的狀態更加極端,無法達到閾值,便不會產生動作電位。
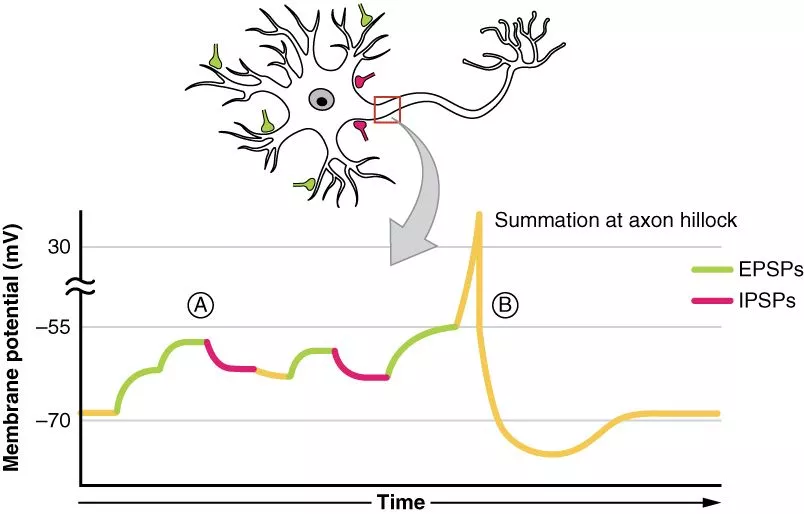
要注意的是,動作電位通常不是根據單一訊號刺激而產生,畢竟神經元隨時都在接收各種不同的訊號,但無論如何,只要加起來的電位變化強度超過閾值,就可以產生動作電位,反之則不會引起任何神經傳導反應。這就是動作電位的「全有全無律」(all-or-none law)。
動作電位如何傳導電訊號?
軸丘產生動作電位後,並不會反傳回細胞本體,而是傳給隔壁的軸突。軸突是一條細長的神經纖維,只要最前端產生動作電位,就可以引發後續一連串的反應。整個過程類似大隊接力,而且不會往回傳,因為當訊號傳送到下一個位置時,前一個發生動作電位的地方處於再極化狀態,鈉離子通道沒有開放,所以無法同時進行去極化。如此一來,就能確保電訊號單向傳導。
當電訊號抵達軸突末端的突觸(synapse)時,會刺激突觸小泡(synaptic vesicle)釋放神經傳導物質,以化學刺激的形式將訊息傳遞出去。下一個神經元的樹突接收到訊號後,就會根據訊號類型,開啟鈉離子通道(引發去極化,產生動作電位)或鉀離子通道(引發過極化,不產生動作電位)。綜上所述,神經系統就是透過神經元不斷重複這樣的循環來傳遞訊息。
最新研究發現大腦耗能的關鍵
現在,我們大致知道了神經元如何以電訊號和化學訊號傳導訊息。(如果你沒有看懂,那也沒關係,總之這整個過程都需要燃燒大量 ATP!)科學家以往都認為大腦之所以這麼耗能,就是因為神經元隨時都在消耗 ATP,而且這些神經元的數量多達 860 億個[2]。可是,過去幾十年的臨床研究發現,在植物人和重度昏迷患者腦內,神經元產生的電活動極少,大腦消耗的能量卻沒有明顯下降。
如果不是電活動,那究竟是什麼消耗了這麼多能量?
去(2021)年底發布在《Science Advances》期刊的一篇研究公布了答案。研究團隊來自威爾康奈爾醫學院(Weill Cornell Medicine),第一作者是提姆.萊恩(Timothy Ryan)教授,他專攻生物化學和結構生物學。近年來,他的團隊深入研究神經元的突觸,試圖找出大腦耗能的原因。有鑑於老鼠的大腦結構和神經迴路都近似人腦,團隊決定透過實驗鼠進行研究。

首先,團隊使用毒素,讓實驗鼠的神經元停止運作,阻斷電訊號,卻發現突觸仍然持續消耗能量。為了進一步釐清原因,團隊將焦點轉移到專門儲存、釋放神經傳導物質的突觸小泡,讓小泡表面各種不同功能的幫浦失去活性,使得突觸無法釋放相對應的化學訊號。
與此同時,團隊利用螢光顯微鏡觀察突觸。經過比對後,發現正在偷偷燃燒 ATP 的是一種稱為「氫離子幫浦」(proton pump)的通道蛋白,其運作形式類似鈉鉀幫浦。研究結果顯示,即使神經元處在休息狀態,突觸小泡內的氫離子幫浦仍然得持續工作,將不同的神經傳導物質送進小泡待命,以備不時之需。可是,作為交換,幫浦會帶走小泡內部的氫離子(H+)。
如果進入小泡的化學物質是甘氨酸、麩胺酸或 GABA,幫浦就會帶走 1 個氫;如果是血清素、多巴胺、組織胺、乙醯膽鹼或正腎上腺素,幫浦則會帶走 2 個氫[3]。有時候,就算沒有任何化學物質進入小泡,幫浦還是會偷偷帶走氫離子,造成小泡內部的氫離子濃度下降。為了維持穩定的離子濃度,突觸小泡必須不斷製造氫離子才能滿足需求,而這樣的過程佔據了 44% 的突觸能量消耗。
萊恩教授表示,雖然每次流失的氫離子數量不多,也就一兩個,但是神經元數量非常多,「即使沒有任何電活動,整體能量消耗依然非常可觀。」目前還不清楚大腦為什麼會有這種機制,很可能是為了預先儲存神經傳導物質,因應突如其來的電訊號,「就像是高速空轉的賽車引擎,雖然會浪費額外的燃料,卻能以更快的速度起步。」
萊恩和他的團隊認為這份研究成果非常可貴,能讓人類對於大腦有更透徹的瞭解,也希望將來能用於治療帕金森氏症(Parkinson’s disease)這類神經退化性疾病。他表示帕金森氏症患者的大腦可能沒有足夠的能量合成 ATP,「這就像是讓一輛油管破裂的賽車高速空轉,很容易釀成大禍。」
註解
- Pulido, C., & Ryan, T. A. (2021). Synaptic vesicle pools are a major hidden resting metabolic burden of nerve terminals. Science Advances, 7(49). https://doi.org/10.1126/sciadv.abi9027
- Azevedo, F.A., Carvalho, L.R., Grinberg, L.T., Farfel, J.M., Ferretti, R.E., Leite, R.E., Filho, W.J., Lent, R. and Herculano-Houzel, S. (2009). Equal numbers of neuronal and nonneuronal cells make the human brain an isometrically scaled-up primate brain. Journal of Comparative Neurology, 513(5), 532-541. https://doi.org/10.1002/cne.21974
- Synaptic vesicle – Wikipedia
參考資料
- We finally know why the brain uses so much energy | Live Science
- 愛放電的神經細胞|國家實驗研究院
- 生命科學與人類生活 Ch 8. 大腦迷思-大腦與神經/羅竹芳
- 公鴿生物小講堂:神經元與靜止膜電位
- 2-Minute Neuroscience: The Neuron
- 公鴿生物小講堂:動作電位與突觸
- 2-Minute Neuroscience: Action Potential
- 2-Minute Neuroscience: Synaptic Transmission
- Crash Course: The Nervous System, Part 3 – Synapses!
- Hyperpolarization (biology) – Wikipedia
- Adenosine triphosphate – Wikipedia