文/洪浩恩 │ 中興大學獸醫學系

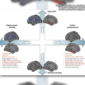
北美洲的金背地松鼠(Callospermophilus lateralis)被作為研究冬眠的實驗動物。科學家發現松鼠在冬眠時,大腦中磷酸化 tau蛋白(tau protein)會大量的出現,就像程度嚴重的阿茲海默症(Alzheimer’s disease)患者一樣,而隨著環境慢慢恢復成適合牠們活動的條件,松鼠就像是沒事一般的甦醒過日子,讓人吃驚的是牠們原來瀰漫於大腦中的磷酸化 tau蛋白幾乎完全消失。

阿茲海默症與磷酸化 tau 蛋白
從失智症患者的大腦組織被觀察到類澱粉蛋白斑塊(amyloid plaques)至今,阿茲海默症持續被人們研究了 110 年,即使我們對於疾病的進程有更多的了解,卻始終無法找到一個好的方法能有效治療它。
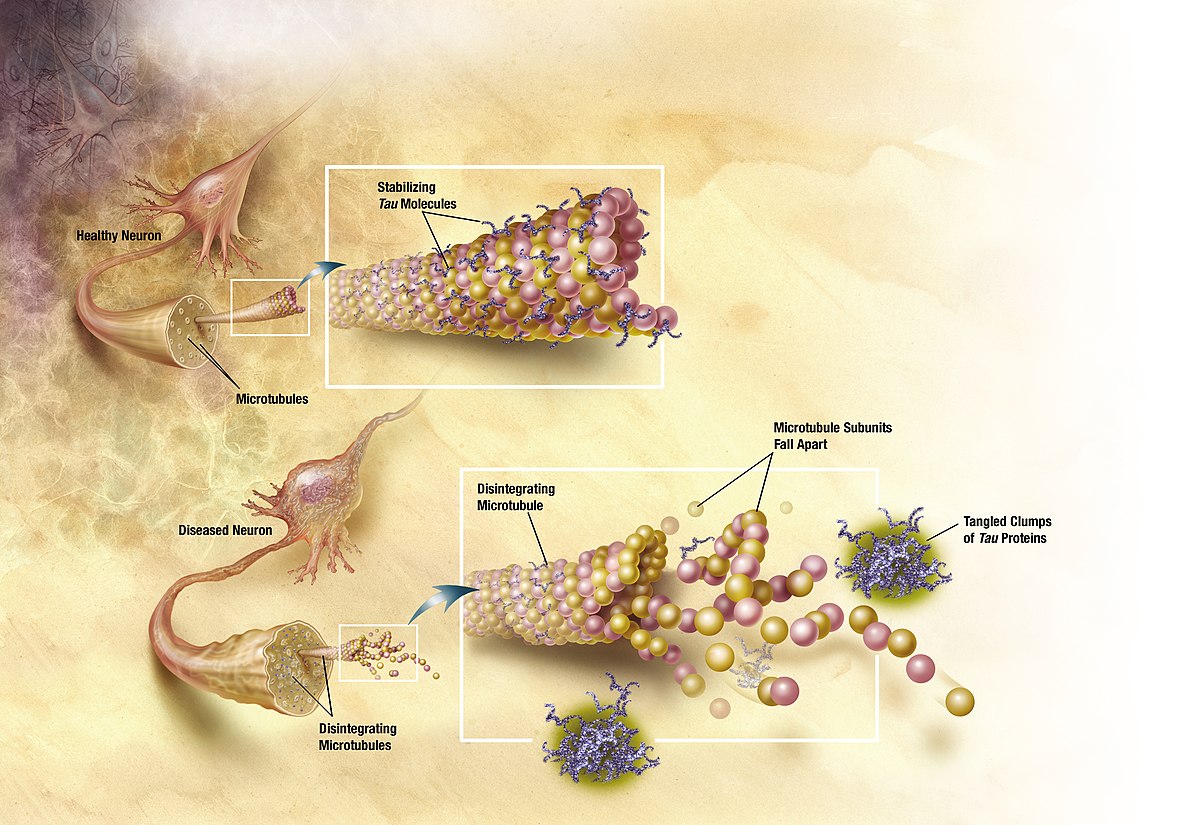
以現在累積的證據來看,人們相信阿茲海默症的成因,最可能肇因於一種(可能)用來協助神經細胞維持和運輸功能的微管蛋白tau,這些原本就廣布於神經系統的蛋白因為某個不明原因,可能是受到遺傳或是環境因子影響而產生了過度磷酸化(hyperphosphorylation),而後這些磷酸化 tau蛋白就到處瀰漫,甚至與組織間的其他碎屑產生糾纏,於是讓身體不得不透過炎症反應來玉石俱焚的類澱粉蛋白斑塊就這麼誕生了。
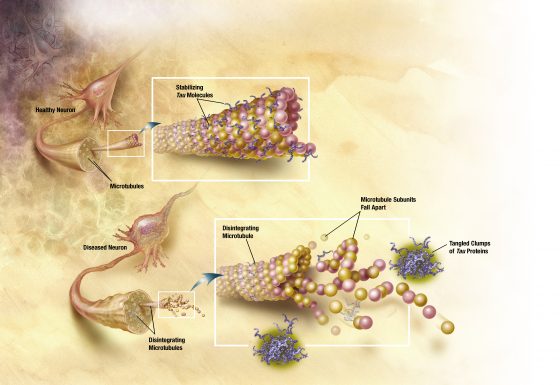
在神經退化性疾病的研究中,科學家致力於尋找活化神經可塑性(neuronal plasticity)的關鍵,因為如阿茲海默症的例子,即使我們清除了所有的斑塊,也得讓患者的神經系統恢復到原來的樣子,眾多關於神經可塑性的探索行動,有人開始注意到冬眠(hibernation)這種一直存在於我們身邊的神奇事情。
協助大腦冬眠「關機」的 tau 蛋白
冬眠是一種動物用來渡過惡劣環境以盡量減少能量消耗的行為策略,在冬眠期間的哺乳動物,其代謝速率、心跳和呼吸頻率都會大幅下降,在這個時候為了不必要的能量消耗,大腦幾乎停止活動,腦細胞會減少,那麼,tau蛋白在這時候大量出現又隨著甦醒消失,如此安排用意為何呢?
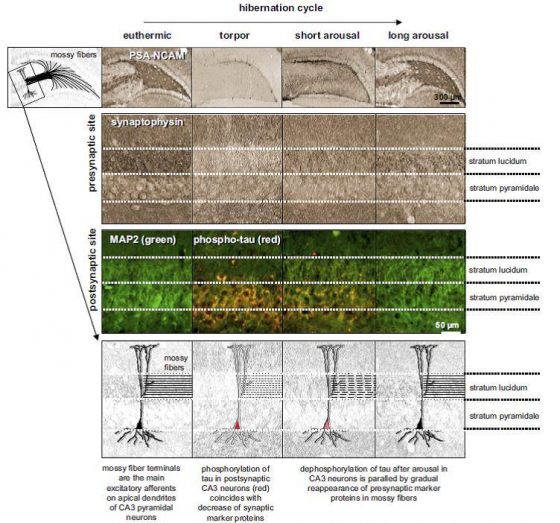
科學家相信磷酸化 tau蛋白的出現,帶來一種協助大腦「關機」的訊號,在環境不利於生存時,腦中需要將暫時不需要的神經連結除去,以保住那些和生命直接相關的部分,這個現象也發現在倉鼠和黑熊腦中,特別是科學家還在壽命較長的黑熊腦中,發現了未被還原而留下來形成斑塊的 tau蛋白,根據目前在動物行為上的長期記憶實驗結果,這些甦醒的動物在社交上的記憶是不受冬眠影響的,而空間性的學習記憶則有程度不一的損傷,有一種鼠耳蝠(Myotis myotis)則能保留完整的空間記憶。
在漫長的演化歷程中,人類的基因始終帶著這樣的機制,阿茲海默症患者的腦中,tau蛋白說不定預知了危險,為了保護大腦而來,可惜喚醒它的可能是我們的衰老或其他因素,面對突如其來的變化,沒有走進冬眠程序的我們無法逆轉它。
松鼠和其他動物,靠著冬眠捱過嚴冬,在遙遠的未來,如果人們想要實現太空旅行,除了交通載具的突破外,如何讓人進入冬眠又能毫髮無傷地悠然轉醒會是相當重要的,或許等到那時候,一直困擾著科學家的阿茲海默症也將得到了解答。

參考資料:
- Arendt T, Bullmann T., Neuronal plasticity in hibernation and the proposed role of the microtubule-associated protein tau as a “master switch” regulating synaptic gain in neuronal networks. Am J Physiol Regul Integr Comp Physiol, 2013. (305): 478-489.
- Arendt T, Stieler J, Strijkstra AM, Hut RA, Rüdiger J, Van der Zee EA, Harkany T, Holzer M, Härtig W. Reversible paired helical filament-like phosphorylation of tau is an adaptive process associated with neuronal plasticity in hibernating animals. J Neurosci. 2003 (18): 6972-6981.
- von der Ohe CG, Darian-Smith C, Garner CC, Heller HC. Ubiquitous and temperature-dependent neural plasticity in hibernators. J Neurosci. 2006 (41):10590-10598.