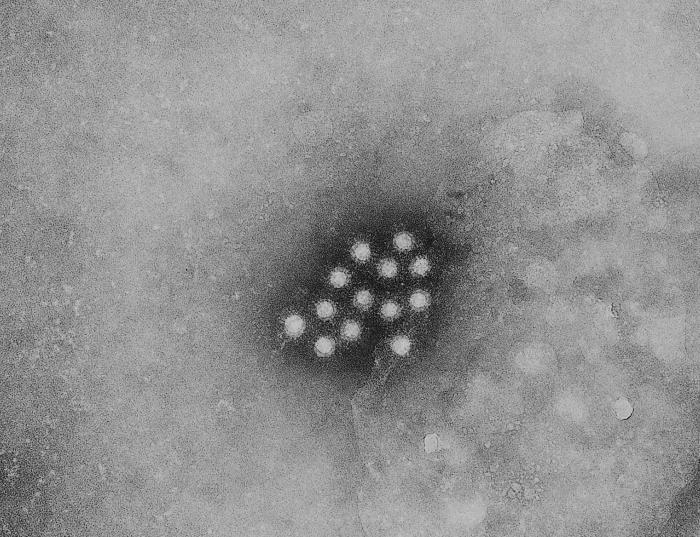
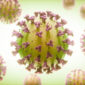
病毒很難在試管內培養,因此早期研究人員看不到它們,在實驗室內無從著力,不過那也是探究病毒本質的一條線索。把病毒擺進含有化學營養成分的培養基裡面,它並不會生長,這是由於病毒只能在活細胞裡面複製。用專業術語來講,它是「絕對細胞內寄生生物」(obligate intracellular parasite)。病毒的尺寸很小,基因組也很小,精簡到只足夠讓它伺機進行依附式生存。它自身不含有繁殖機具。它四處揩油、偷盜。
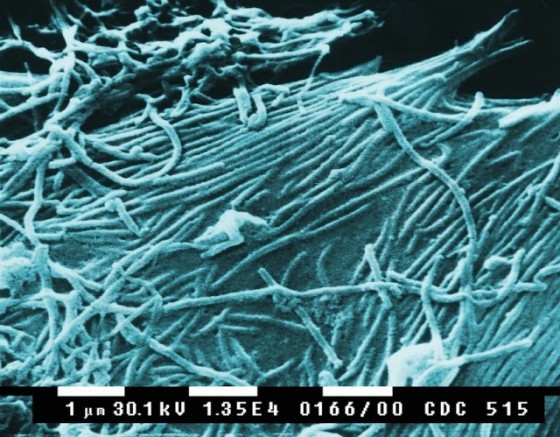
「很小」是指多小?普通病毒大約為普通細菌的十分之一大小。採用公制單位來說,圓形病毒的直徑大約從十五奈米(也就是十億分之十五米)到三百奈米不等。不過病毒並不都呈圓球形,有些呈圓柱狀,另有一些像繩索呈細長狀,還有些看來就像拙劣的未來派建築或登月小艇。不論是哪種形狀,病毒的內部容積都十分微小。塞在這般細小容器裡面的基因組,也相應有其侷限,核苷酸數目從兩千到最多約一百二十萬不等。
相較而言,小鼠的基因組所含核苷酸數目約為三十億。界定一個胺基酸需要三個核苷酸鹼基,構成一個蛋白質平均約需要兩百五十個胺基酸(不過有些蛋白質還大上許多)。基因的用處就是製造蛋白質;細胞或病毒內的其他一切事項,全都是後續反應的產物。所以只含區區兩千個字碼的基因組,甚至含一萬三千個(流感病毒)或三萬個(SARS 病毒)字碼的基因組,都可說是非常寒酸的工程規格。然而,即便以微小得只能編寫出八到十個蛋白質的基因組規模,病毒卻仍有可能相當狡猾,而且表現出高度效能。
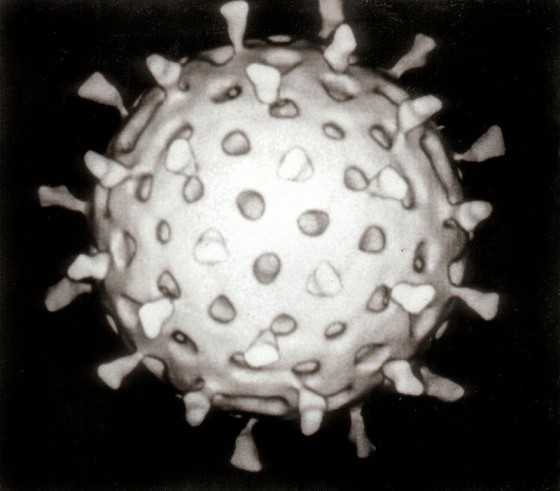
病毒面對四項基本挑戰:如何從一個宿主轉到另一個宿主身上;如何鑽進那個宿主體內的細胞;如何接管那顆細胞的配備和資源,來生成自己的多重副本;還有如何回到外界—擺脫細胞,離開宿主,繼續侵入下一個宿主。病毒的結構和基因功能都打造得非常精簡,堪可達成這些使命。
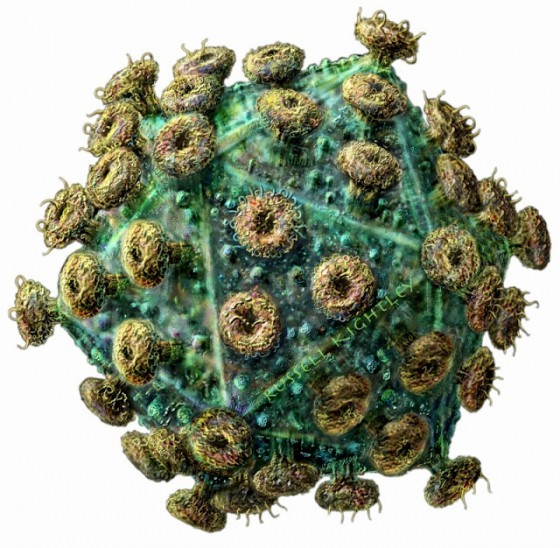
彼得.梅達華(Peter Medawar)爵士是英國的傑出生物學家,和伯內特在同一年獲得諾貝爾獎,他把病毒定義為「用蛋白質裹著的壞消息」。梅達華心中所想的「壞消息」是遺傳物質,這種東西利用宿主生物的細胞來藏身、繁殖,同時經常(卻非總是)對宿主造成傷害。病毒的蛋白質包裹材料稱為衣殼(capsid)。衣殼也稱為殼體,具有兩種功能:能在必要時保護病毒的內部構造,並協助病毒進入宿主細胞。位於細胞外的個別病毒單元,都是完整的顆粒,稱為病毒體(virion)。衣殼也決定病毒的外形。
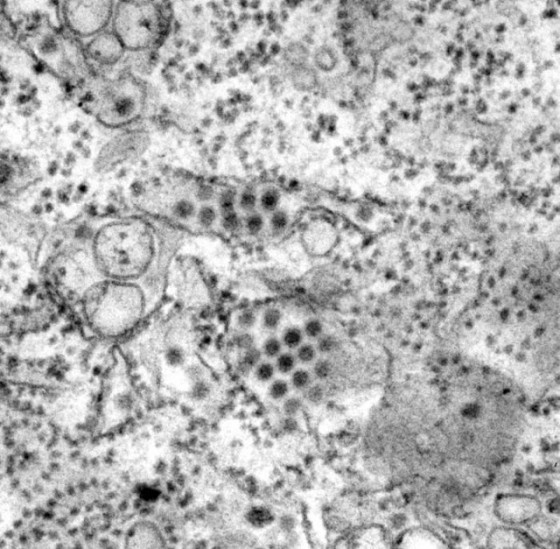
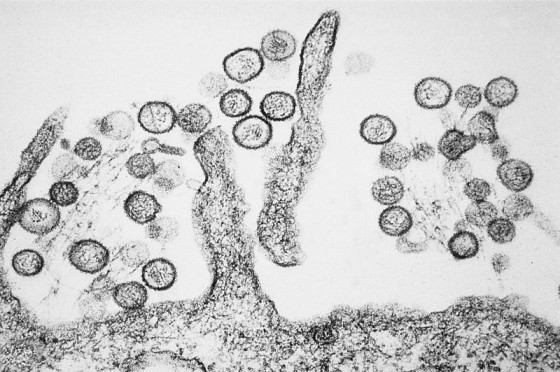
舉例來說,伊波拉病毒和馬堡病毒的病毒體都呈長絲狀,因此劃歸為線狀病毒這一類。其他有些病毒的顆粒呈圓球形或卵圓形,另有些則呈螺旋形或者狀似二十面體(就像巴克明斯特.富勒[Buckminster Fuller]設計的足球結構)。第一型 HIV 顆粒呈球形。狂犬病毒體的模樣就像子彈。一碟伊波拉病毒體混亨德拉病毒體,看來就像髮絲細麵拌一些酸豆醬。
許多病毒都額外包覆了一層套膜(envelope),套膜不只由蛋白質組成,還包含取自宿主細胞的脂質分子—某些情況下,病毒體脫離細胞時會從細胞膜把脂質一併帶走。病毒體的套膜外表面有可能滿布大量尖刺狀分子突起,就像老式水雷的引爆觸桿。這些尖刺具有非常重要的功能,每種病毒分別具有專屬的尖刺,構造就像鑰匙,能與目標細胞外表的分子鎖匹配;病毒體靠著尖刺,讓自己附著上目標細胞,就像太空船和另一艘太空船對接,接著尖刺就打開入口侵入。
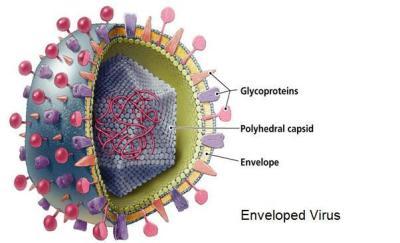
尖刺的專一性不只約束特定病毒能感染的宿主種類,還侷限該病毒可以用最高效能侵染的細胞種類—神經細胞、胃細胞、呼吸道上皮細胞—從而決定病毒有可能引致哪種疾病。儘管尖刺對病毒具有這等用途,卻也成為容易遭受攻擊的弱點所在。它們是受感染宿主免疫反應的主要標靶,白血球製造的抗體分子能抓住尖刺,防止病毒體附上細胞。
可別把衣殼和細胞壁或細胞膜混為一談,這些結構只是功能相仿。自從病毒學創建之初,學界就從反面角度來定義病毒(沒辦法用濾器篩除、沒辦法用化學營養成分來培養、不完全算是活的),最基本的反面公設則是,病毒體並不是細胞。病毒的運作方式和細胞不同,不具備和細胞相同的能力或弱點。這些特點反映在一件事實上,病毒不怕抗生素—抗生素是一類很有價值的化學物質,能用來殺滅細菌(細菌也是細胞),或起碼能妨礙細菌生長。
青黴素(盤尼西林)的作用是阻止細菌製造細胞壁。胺羥芐青黴素是青黴素的相似合成物質,也有相同的功能。四環黴素(tetracycline)能干擾細菌的內部代謝作用,妨礙細菌製造生長、複製所需的蛋白質。病毒沒有細胞壁,也沒有內部代謝作用,因此對這類殺菌藥劑的效用毫無所懼。
病毒衣殼內部一般都只含遺傳物質,也就是能製造出具有相同模式的新病毒體的一組指令。這組指令只有在病毒介入活細胞的運作之後才能執行。病毒的遺傳物質本身可為 DNA 或 RNA,實際就看是該病毒屬於分類學上的哪一科而定。兩類分子各有優缺點,不過都能記錄資訊並表現出來。含 DNA 的類群包括疱疹病毒、痘病毒(poxvirus)和乳突病毒(papillomavirus);此外還有六個你從來沒聽過的病毒科也含有 DNA,好比虹彩病毒(iridovirus)、桿狀病毒(baculovirus)和肝炎病毒(hepadnavirus,其中一種會引致 B 型肝炎)。
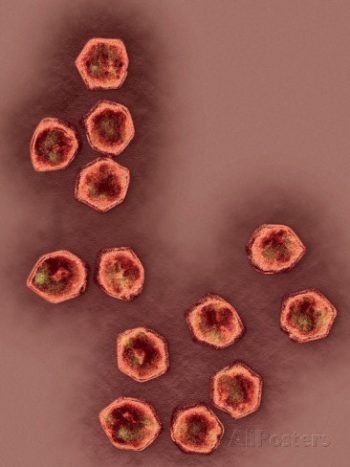
其他多科病毒則把遺傳資訊儲存成 RNA 型式,包括線狀病毒、反轉錄病毒(retrovirus,例如聲名狼藉的第一型 HIV)、冠狀病毒(含 SARS 冠狀病毒),以及其他多達約十二科的病毒,比如麻疹病毒、流行性腮腺炎病毒、亨德拉病毒、立百病毒、黃熱病毒、登革病毒、西尼羅病毒、狂犬病毒、馬丘波病毒、胡寧病毒、拉薩病毒和屈公病毒,加上所有漢他病毒、所有流感病毒以及普通感冒病毒。
DNA 和 RNA 的不同之處,決定了各種病毒之間一項極端重大的差異:突變率。DNA 是雙股分子,也就是著名的雙螺旋,因為兩股長鏈藉由核苷酸鹼基對之間非常獨特的關係匹配在一起(腺嘌呤只與胸腺嘧啶配對,胞嘧啶只與鳥嘌呤配對),因此自我複製時,若鹼基的位置出現錯誤,一般也都能夠修正過來。這種修正作業由 DNA 聚合酶負責執行,這種聚合酶能夠根據其中一股催化建構出新的一股 DNA。倘若腺嘌呤放錯位置,與鳥嘌呤配對(腺嘌呤不是鳥嘌呤的正確對象),DNA 聚合酶能認出錯誤,退回到前一個配對,修正錯誤的結合,接著繼續進行下去。所以多數 DNA 病毒的突變率都相當低。
RNA 病毒是以一條單鏈分子編碼形成,沒有這種修正配置,沒有這種搭檔系統,沒有這種負責校讀的聚合酶,因此得承擔高出數千倍的突變率。(在此請各位注意,有一小群 DNA 病毒把遺傳密碼編寫在單股 DNA 上,突變率也都很高,就像 RNA 病毒。同時也有一小群 RNA 病毒具有雙股分子。凡有規則,就有例外。不過這裡我們就不理會那些次要的異常事例,因為這件事本身已經夠複雜了。)這個基本要點十分重要,我還要再講一遍:RNA 病毒的突變頻率漫無節制。
突變會帶來新的遺傳變異,變異是天擇的運作原料。突變大多有害,會帶來嚴重功能障礙,把突變型生命體推上演化絕路。不過偶爾突變巧具用途,並能適應環境。突變出現得愈頻繁,生成優質突變的機會也愈高。(突變愈多,則生成有害突變的機率也愈高,這會害死病毒;也因此突變率有最高上限。)所以 RNA 病毒的演化速率,有可能高於地球上的其他任何生物。也就是這樣,它們才那麼反覆無常、難以逆料,又那麼難纏。
儘管梅達華曾以妙語評斷,但卻非所有病毒都是「裹著蛋白質的壞消息」—起碼對於受感染宿主來講,病毒不見得都是壞消息。有時甚至是好消息,某些病毒能為宿主提供有益健康的服務。「感染」不必然都會伴隨出現重大損害,這個詞只代表某種微生物已建立起勢力。病毒不見得必須先讓宿主生病,才能達成任何成果。它的私利目標只是能夠複製,並傳播出去。病毒會進入細胞,沒錯;接著擾亂細胞的生理機具來自我複製,沒錯;而且病毒離開時還往往會摧毀那群細胞,這也沒錯;不過遭破壞的細胞或許還沒有多到會帶來真正的損害。病毒有可能悄無聲息地棲居宿主體內,不造成破壞,只適度複製,並從一個宿主感染到另一個宿主身上,也不引發任何症狀。
舉例來說,病毒和儲存宿主的關係,往往牽涉到這樣一種休戰協定,有時是歷經長遠交往和許多世代的相互演化適應才達成這樣的狀況,病毒變得愈來愈溫和,宿主也變得愈來愈寬容。這也正是定義儲存宿主的部分要項:沒有症狀。並非所有病毒與宿主的關係都朝著這種友善的狀態演變,這是一種特殊的生態平衡型式。
就像其他所有生態平衡,這也是一種為期短暫的偶發臨時狀態。一旦發生溢出事件,把病毒送進了一種新的宿主,停戰協定就廢止了。寬容性並不會隨之轉移,平衡局勢打破了,嶄新的關係就此開展。病毒才剛在陌生宿主體內站穩腳跟,它有可能是個不惹是生非的過客,也可能惹出些許事端,不過也或許是苦難的根源。這就要看情況囉。



















《運動基因》立體封面72dpi.jpg)